- Del C: Opbygning af kulstofforbindelser
- Laboratorieundersøgelse 1: Bevis for en kemisk ændring
- Kontrol
- Diskutere
- Laboratorieundersøgelse 2: Modellering af fotosyntese og cellerespiration
- Checking In
- Laboratorieundersøgelse 3: Biosyntese af nye biomolekyler fra glukose
- Diskutere
- Kontrol
- Stop og tænk:
- Optionelle udvidelser
Del C: Opbygning af kulstofforbindelser


I kulstofkredsløbet er kulstofatomer konstant i bevægelse, idet de cirkulerer ind og ud af de forskellige komponenter i biosfæren og geosfæren. Kulstofatomer indgår ikke i kredsløbet som enkeltatomer, men bevæger sig i stedet som en del af kulstofforbindelser, nogle små og enkle og andre store og meget komplekse. Kulstofkredsløbet er tæt forbundet med andre biogeokemiske kredsløb – kredsløb af andre kemiske grundstoffer som f.eks. kvælstof, fosfor, svovl og jern, der bevæger sig ind og ud af forskellige komponenter i geosfæren og biosfæren. . For eksempel indeholder mange kulstofforbindelser, der produceres af levende organismer, kvælstof- og fosforatomer.
Det globale kulstofkredsløb, der viser kulstofatomers vej (pile) fra en del af kulstofkredsløbet til en anden del af kulstofkredsløbet. Lilla bogstaver henviser til de steder, hvor der findes kulstofforbindelser, og orange bogstaver henviser til de processer, der får kulstof til at bevæge sig langs disse veje.
Se billedet af det globale kulstofkredsløb, der er vist til højre (klik for at forstørre billedet). Hver pil repræsenterer en vej, som kulstofatomer følger, når de bevæger sig gennem geosfæren og biosfæren. Nogle af disse kulstofforbindelser bevæger sig hurtigt fra en del af kulstofkredsløbet til en anden, mens andre bliver lagret i millioner og atter millioner af år. Når kulstofforbindelser bevæger sig gennem geosfæren og biosfæren, gennemgår de mange forskellige kemiske ændringer. Disse kemiske ændringer (transformationer) kræver, at kemiske bindinger mellem atomerne brydes og opbygges. Nogle af disse kemiske ændringer synes ganske ubetydelige, men kan have stor indflydelse på kulstofkredsløbet, klimaet og miljøet. Når planter f.eks. omdanner uorganisk CO2 til organisk sukker (C6H12C6), giver de føde til dyr og andre heterotrofe organismer organismer, der ikke kan fremstille deres egen føde og i stedet får deres føde og energi ved at optage organiske stoffer, som regel vegetabilsk eller animalsk materiale; dyr, protozoer, svampe og de fleste bakterier er heterotrofe organismer. Når jordbakterier nedbryder kulstofforbindelser i jorden, frigiver de kuldioxid (CO2) eller metan (CO4). Begge disse gasser er drivhusgasser og er blevet sat i forbindelse med klimaændringer.
Videnskabsfolk forudser, at der findes mere end ti millioner forskellige kulstofforbindelser på Jorden i dag. I dette afsnit skal du udføre fire korte undersøgelser for at undersøge, hvordan kulstofatomer kan forbindes med andre typer atomer for at danne de millioner af forskellige typer kulstofforbindelser, der findes i geosfæren og biosfæren. For at få dig i gang med at tænke over kulstofs evne til at danne så mange forskellige typer kulstofforbindelser kan du se dette korte NPR-videoklip, It’s All About Carbon: Episode 1.
BEMÆRK: Hvis videoen ikke kan indlæses, kan du se videoen her: Episode 1: Global Warming, It’s All About Carbon – YouTube Du kan også følge dette link, hvor du kan se andre episoder af denne NPR-serie.
Laboratorieundersøgelse 1: Bevis for en kemisk ændring

Koraller og andre organismer, der bygger skaller, såsom muslinger, østers og hummere, er afhængige af kalciumkarbonat for at opbygge deres skaller og skeletter.
I den video, du lige har set, lærte du, at kulstofatomer bindes let og stærkt med andre atomer for at danne mange forskellige typer kulstofforbindelser. I denne undersøgelse skal du lede efter tegn på, at der dannes en ny kulstofforbindelse, når to kulstofforbindelser bringes sammen: CO2 fra din egen ånde og en opløsning af calciumhydroxid Ca(OH)2.
- Lugtændring ( for eksempel – lugt af svovl, når en matchet brændes)
- Farveændring ( for eksempel – sølv til rødbrun, når jern ruster).
- Vandring af temperatur
- Vandring af sammensætning (f.eks. – papir bliver til aske, når det brændes)
- Lys- og/eller varmeafgivelse
- Formation af gasser, der ofte optræder som bobler i væsker
- Formation af et bundfald (faste uopløselige partikler), der optræder i opløsning
- Afbrydning af organisk materiale (f.eks. rådnende mad)
- Forandringen er vanskelig eller umulig at vende
Til klassen:
- Et stykke kridt
- Hvid eddike
- Øjeblomst
For hver gruppe:
- klar plastkop delvist fyldt med kalkvand
- klar plastkop delvist fyldt med vand
- tom klar plastkop
- to sugerør
- to sugerør
- lille (nr. 2) kaffefilter
- vand
- hvid eddike
- øjenbrænder
- (Klassedemo) Kridt er lavet af kalciumkarbonat (CaCO3). Når eddike tilsættes til kridt, opstår der en brusning, hvilket indikerer, at kridt er lavet af calciumcarbonat. Du skal bruge eddikeprøven til at indikere tilstedeværelsen af calciumcarbonat.
- Undersøg kalkvandet, og beskriv dets udseende. Kalkvand er den almindelige betegnelse for mættet calciumhydroxidopløsning, Ca(OH)2 (aq).
- Placer et af drikkestrådene ned i kalkvandet og blæs forsigtigt i væsken. INDÅNDER IKKE OG BLÆSER IKKE FOR HÅRDT. Fortsæt med at ånde ud gennem sugerøret, indtil der dannes et hvidt bundfald (fast stof). Opløsningen skal se meget mælkeagtig ud med små partikler.
- Placér kaffefiltret over den tomme kop. Hæld forsigtigt kalkvandet i koppen gennem filteret for at adskille udfældningen fra væsken.
- Sæt filteret med den hvide udfældning til side, og lad det tørre og størkne.
- Sæt et sugerør i en kop almindeligt vand (i stedet for kalkvand), og pust forsigtigt. Iagttag, hvad der sker. Dette tjener som din eksperimentelle kontrol.
- For at bevise, at det stof, du filtrerede ud af kalkvandet, rent faktisk er calciumcarbonat, skal du bruge pipetten til at tilsætte en lille mængde hvid eddike til udfældningen.
Kontrol
Beskriv, hvordan kalkvand og almindeligt vand reagerer forskelligt, når der tilsættes kuldioxidgas til dem begge.
Diskutere
- Hvilket bevis har du observeret for, at der blev dannet en ny slags kulstofforbindelse i denne undersøgelse.
- Beskriv, hvad der sker med kulstofatomerne i kuldioxid (CO2), når du blæser CO2 ind i kalkvandet?
- Hvorfor tjener denne undersøgelse som en model til at forstå kemisk forandring som en vigtig del af kulstofkredsløbet.
 Kuldioxid- og vandmolekyler.
Kuldioxid- og vandmolekyler. Laboratorieundersøgelse 2: Modellering af fotosyntese og cellerespiration
I denne undersøgelse skal du bruge et molekylærmodelsæt med “kugler og pinde” til at undersøge, hvordan de to centrale biosfæreprocesser fotosyntese og cellerespiration skaber nye kulstofforbindelser. Saml dine materialer, og følg instruktionerne for modellering af fotosyntese og celle respiration nedenfor:
6 kulstofdioxidmolekyler – (6 kulstofatomer, 12 oxygenatomer, 24 elektronbindingspinde)
6 vandmolekyler – (6 hydrogenatomer, 12 oxygenatomer, 12 elektronbindingspinde)
Billedet til højre illustrerer, hvordan de ser ud.
- Kulstofatomer er sorte(eller grå) og har hver fire “tænder”. Hver tand repræsenterer en elektronbinding mellem atomerne.
- Hydrogenatomer er hvide. Brint har kun én tænder, så det kan kun lave én elektronbinding med et andet atom.
- Syreatomer er røde og har to tænder. Derfor kan oxygenatomer lave to elektronbindinger med andre atomer, herunder et andet oxygenatom.
- Hver hvid eller grå pind repræsenterer én elektronbinding mellem to atomer. BEMÆRK: Nogle gange kan kulstof og ilt danne dobbeltbindinger.
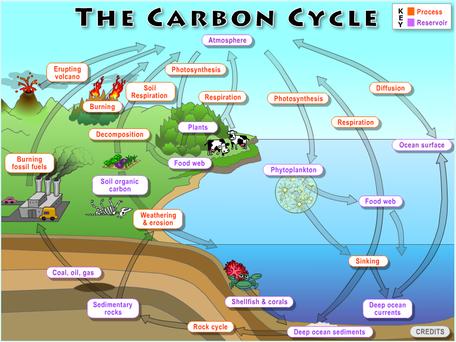
CO2-molekyler kommer ind i planterne gennem bladene. H2O-molekyler bevæger sig ind i planterne fra planterødderne. Brug de seks kuldioxid- og seks vandmolekyler til at modellere fotosyntesen. Her er den kemiske ligning for fotosyntese.
6CO2 + 6H2O ==> C6H12O6 + 6O2

1. Begynd med at skille kuldioxid- og vandmolekylerne ad.
2. Opbyg dit glukosemolekyle ved at bruge billedet af et glukosemolekyle, der er afbilledet til højre, som vejledning. Hvis du klikker på billedet for at forstørre det, kan du nemt se, hvordan kulstof-, hydrogen- og oxygenatomerne er bundet til hinanden. BEMÆRK: Du må ikke skille glukosemolekylet ad, før du begynder Undersøgelse 3:
3. Brug de resterende iltatomer og bindinger til at bygge seks O2-molekyler (O=O). Disse iltgasmolekyler frigives til luften og giver noget af den nødvendige ilt til liv på jorden.

Respirationsprocessen bryder de kemiske bindinger i glukosemolekylet fra hinanden og gør energi tilgængelig for cellens funktioner. Atomer fra glukosemolekylet bruges også til at opbygge biomasse. De CO2- og O2-molekyler, der produceres i denne reaktion, bevæger sig ud af bladet og ud i den omgivende luft.
4. Undersøg ligningen for celleånding, som er afbildet til højre. Den kemiske ligning for celleånding er:
C6H12O6 + 6O2==> 6CO2 + 6H2O + energi til cellefunktioner
Svar derefter på spørgsmålene til kontrol nedenfor:
Checking In
Laboratorieundersøgelse 3: Biosyntese af nye biomolekyler fra glukose
- Tag dit glukosemolekyle og gå sammen med mindst ét andet hold.
- Tag glukosemolekylerne fra hinanden. BEMÆRK: I behøver ikke at afbryde alle bindinger fra atomerne.
- Brug atomerne og bindingerne fra begge hold til at opbygge et nyt biomolekyle organiske kulstofforbindelser, der produceres i levende væsener; eksempler omfatter kulhydrater, lipider (fedt, fedtstoffer, fedtstoffer, voks) og DNA. Dit biomolekyle kan have den form, du ønsker. Den eneste regel, som du skal følge, er, at ingen “elektronbindingssporer” ikke må være uforbundet med et andet atom. Det er muligt at have et par atomer og bindinger tilbage, når du bygger dit biomolekyle. BEMÆRK: Din lærer kan beslutte at producere dig med nitrogenatomer. Ved at bruge disse atomer kan I bygge proteinmolekyler.
- Når I er færdige med at bygge jeres nye biomolekyler, skal I sammenligne dem med andre biomolekyler, som andre hold har lavet.
Diskutere
Se på de andre biomolekyler, som klassen har lavet ud fra de oprindelige glukose-biomolekyler.
- Hvordan ligner de hinanden? Hvordan er de forskellige?
- Hvis du havde tusind glukose-biomolekyler, hvor mange forskellige typer biomolekyler tror du så, at du kunne lave? Hvorfor?
- Forestil dig, at kulstof kun kunne danne én elektronbinding i modsætning til fire. Hvilken virkning kan det have på størrelsen og mangfoldigheden af de molekyler, du hidtil har været i stand til at bygge?
Biomassen i alle organismer består for det meste af proteiner, kulhydrater, nukleinsyrer (DNA, RNA) og lipider (fedtstoffer, olier og voks). Glukose og andre kulhydrater indeholder kulstof-, hydrogen- og oxygenatomer. Organismer i biosfæren opbygger imidlertid millioner af forskellige biomolekyler, som indeholder kvælstof, fosfor og svovl. Faktisk består 97 % af en levende organisme kun af seks grundstoffer: kulstof, brint, nitrogen, ilt, fosfor og svovl eller forkortet CHNOPS. Andre grundstoffer som f.eks. magnesium og jern er også vigtige, men i meget små mængder. Mangel på et eller flere af disse jordnæringsstoffer i jorden, som er vigtige for plantevækst; de vigtigste jordnæringsstoffer er kvælstof, fosfor, magnesium og svovl. vil begrænse plantevækst og kulstoflagring. I denne undersøgelse skal du undersøge flere Jmol-billeder af biomolekyler og identificere typerne af grundstoffer (atomer) i hver enkelt.
- Papir eller notesbog
- Jmol-farvekodningsskema
- Optionel: MolView visualiserings-webappen giver dig mulighed for at rotere, zoome ind og finde baggrundsoplysninger om biomolekyler.
- Kulstof (sort eller grå)
- Hydrogen (hvid)
- Nitrogen (blå)
- Oxygen (rød)
- Phosphorus (orange)
- Svovl (gul)
- Magnesium (grøn)
- Jern (bronze/kobber)
- Opret et skema med tre kolonner i din laboratoriehæfte eller på et separat stykke papir. Giv dit skema følgende overskrifter:
- Spalte A = navn på biomolekylet (f.eks. DNA, fruktose osv.);
- Spalte B = type biomolekyle (f.eks. kulhydrat, protein osv.);
- Spalte C = typer af atomer (grundstoffer). Brug de første bogstaver (C H N N O P S Mg I);
Fruktose, et kulhydratfrugtsukker. Når du spiser frugt som f.eks. æbler og appelsiner, spiser du fructose.

DNA, en nukleinsyre. DNA kaldes ofte livets blåtryk, fordi det indeholder de genetiske instruktioner, som gør det muligt for organismer at opbygge sig selv og udføre alle deres livsaktiviteter. Uden DNA bliver en organisme ikke bygget op. Denne visualisering af DNA repræsenterer kun et meget lille udsnit af et helt DNA-molekyle.
Cellulose, et kulhydrat. De fibrøse og træagtige dele af planter er lavet af cellulosemolekyler, der er forbundet i lange kæder. Cellulosens fibrøse natur giver planter den struktur, der gør det muligt for dem at stå oprejst. Træer består af ca. 50 % til 53 % cellulose, afhængigt af træets art.

Klorofyl, et grønt pigmentmolekyle. Planter bruger dette pigment til at absorbere energi fra solen til fotosyntese. Klorofyl er et eksempel på et biomolekyle, der ikke tilhører nogen bestemt gruppe (dvs. kulhydrater, nukleinsyrer, proteiner, lipider) Kan du finde magnesiumatomet?

Cytochrom C, et planteprotein. Proteiner er makromolekyler, der biosynteseres af alle levende organismer, og som har forskellige funktioner, der er afgørende for livet. Cytokrom c er f.eks. et protein, som planter og andre organismer har brug for til at udføre celleatmningen. Kan du finde svovlatomerne og de to jernatomer i dette cytochrom-proteinmolekyle?
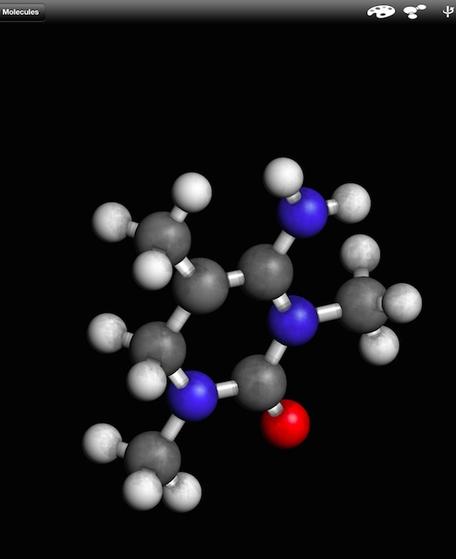
En aminosyre- en del af et protein. Organismer opbygger komplette proteiner af hundredvis af aminosyrer. Cytochrom c-molekylet, der er afbilledet til højre, er et komplet protein, der består af mange aminosyrer.
Kontrol
Stop og tænk:
1: Forklar, hvorfor kulstofatomerne i kulstofforbindelser som proteiner og DNA oprindeligt kom fra CO2-molekyler i atmosfæren.
2: Forklar, hvorfor mangel på næringsstoffer i jorden (f.eks. kvælstof, fosfor, svovl og magnesium) begrænser et træs evne til at vokse og lagre kulstof.
3: Forklar, hvordan træer og alle andre organismer i biosfæren er i stand til at lave millioner af forskellige konfigurationer af kulstofforbindelser.
Optionelle udvidelser
Vil du lære mere om kulstofforbindelser, biomolekyler, CHNOPS, jordnæringsstoffer og meget mere? Tjek disse ressourcer.
- Research den nyeste forskning! Der foregår hele tiden ny forskning om kulstofkredsløbet, klimaet og miljøet. Du kan bruge ScienceDaily og Phys.org til at undersøge nyere forskning om forholdet mellem kulstofkredsløbet og andre biokemiske kredsløb ved at bruge kombinationer af følgende tags: carbon cycle, carbon storage/sequestration, CO2 fertilization, trees, forests, soil nutrients (CO2-gødning, træer, skove, jordnæringsstoffer). Her er et eksempel: Et eksempel: Jordnæringsstoffer begrænser planters evne til at bremse klimaændringer
- Brug MolView til at udforske Jmol biomolekyler, der er fremstillet af mange forskellige typer organismer.