Dette er en kort oversigt over oplysninger i forbindelse med FDA’s godkendelse til markedsføring af dette produkt. Se nedenstående links til resuméet af sikkerheds- og effektivitetsdata (SSED) og produktmærkningen for mere fuldstændige oplysninger om dette produkt, dets indikationer for anvendelse og grundlaget for FDA’s godkendelse.
Produktnavn: Axonics Sacral Neuromodulation System
PMA Ansøger: Ansøger: Axonics Modulation Technologies, Inc.
Adr: 26 Technology Drive, Irvine, CA 92618
Godkendelsesdato: Godkendelsesdato: 13. november 2019
Godkendelsesbrev:: 13. november 2019
Godkendelsesbekendtgørelse
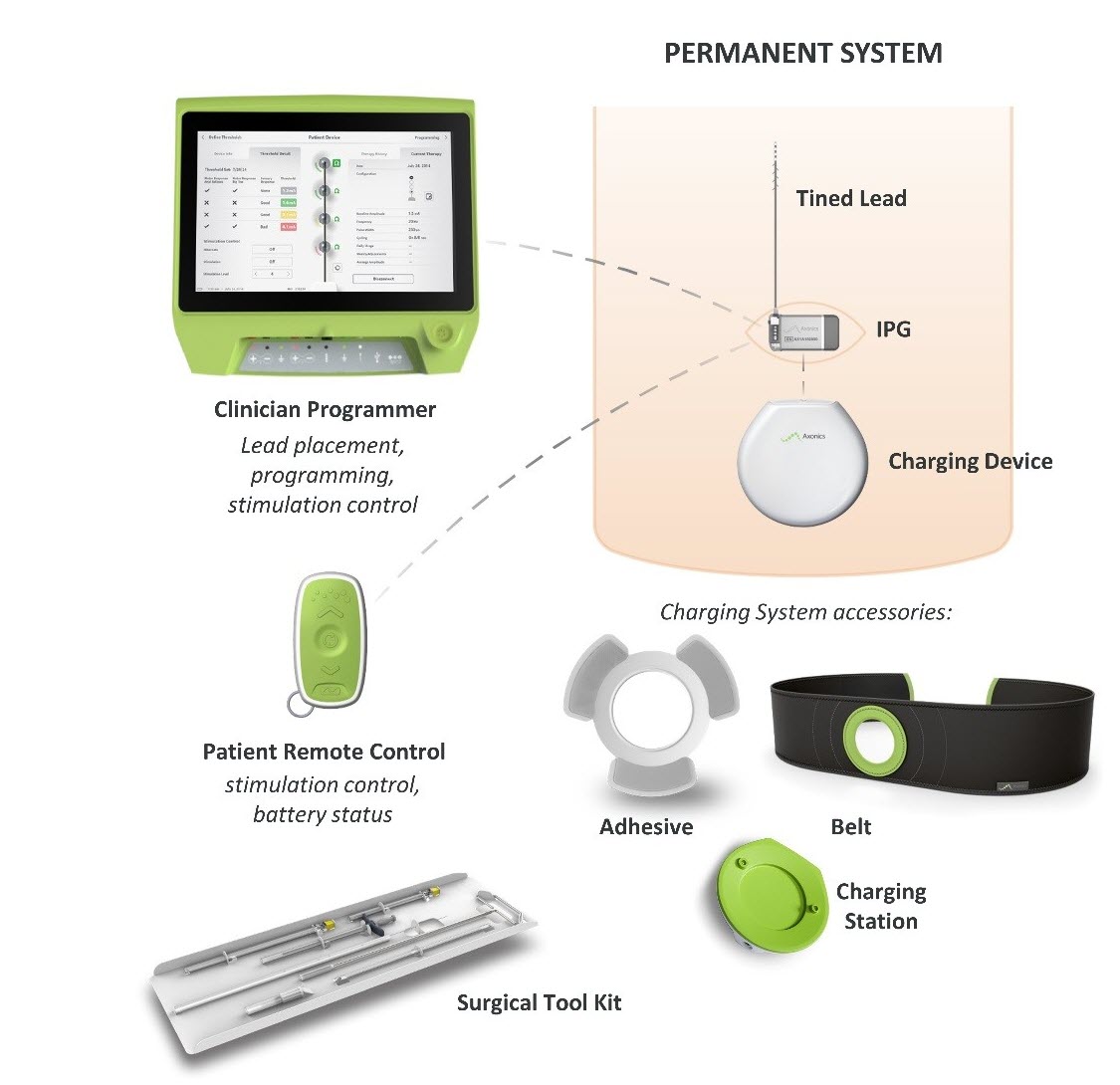
Hvad er det? Axonics Sacral Neuromodulation (SNM) System er et sacral nervestimulationssystem (SNS), der er beregnet til at behandle urinretention og symptomerne på overaktiv blære. Det bruger en implanteret stimulator til at levere elektriske impulser gennem en ledning til elektroder, der er placeret nær sakralnerven.
Hvordan virker det? En implanterbar pulsgenerator (IPG) placeres kirurgisk under huden i det øverste baldeområde og fastgøres til en ledningstråd, der passerer mellem bækkenets hofteknogler og ender ved sakralnerven. IPG’en sender elektriske impulser gennem ledningstråden til sakralnerven, der går fra rygmarven til blæren for at hjælpe med at forbedre kontrollen med vandladningen.
Hvornår bruges den? Axonics SNM-systemet til urinregulering anvendes til behandling af urinretention og symptomerne på overaktiv blære hos patienter, der har fejlet eller ikke har kunnet tolerere andre behandlinger, såsom livsstilsændringer, bækkenbundsøvelser eller medicin. Hvis de ikke behandles, kan urinretention og overaktiv blære reducere patientens livskvalitet og resultere i betydelige udfordringer med at opretholde aktiviteter i dagligdagen.
Hvad vil det udrette? Resultaterne fra en klinisk undersøgelse af Axonics SNM-systemet kombineret med yderligere kliniske data indsamlet fra en systematisk gennemgang af den tilgængelige litteratur om et lignende SNM-apparat viser, at der er fordele for de fleste patienter med urinretention og symptomer på overaktiv blære, som har fejlet eller ikke har kunnet tolerere andre behandlinger. I Axonics’ kliniske undersøgelse af patienter med tranginkontinens opnåede 90 % (116/129) af patienterne med det implanterede SNM-system en reduktion på mindst 50 % i antallet af tranglækager efter 6 måneder sammenlignet med antallet af tranglækager uden SNM-systemet. I en længerevarende undersøgelse (van Kerrebroeck, 2007) blev 152 patienter, der fik implanteret et lignende SNM-apparat, fulgt i 5 år. Efter 5 år havde 58 % (56/96) af patienterne med urgeurininkontinens mindst 50 % forbedring (målt i antal lækager pr. dag). Efter 5 år havde 40 % (10/25) af patienterne med urgency-frekvens desuden en forbedring på mindst 50 % (målt i antal tømninger pr. dag), og 58 % (18/31) af patienterne med urinretention havde en forbedring på mindst 50 % (målt i antal kateteriseringer pr. dag). I betragtning af lighederne i design, teknologi, ydeevne, indikationer for brug, outputkarakteristika og den patientpopulation, det er beregnet til at behandle, mener FDA, at Axonics SNM-systemet vil have samme ydeevne som det kommercielt tilgængelige SNM-system, der er evalueret i de offentliggjorte undersøgelser.
Hvornår bør det ikke anvendes? Axonics SNM-systemet bør ikke anvendes til:
- Patienter, der ikke har vist et passende respons på teststimulering; eller
- Patienter, der ikke er i stand til at betjene Axonics SNM-systemet
Supplerende oplysninger (herunder advarsler, forholdsregler og uønskede hændelser):
- Summary of Safety and Effectiveness Data
- Patient Labeling
- Physician Labeling
- Physician Labeling
- PMA Database Entry