- Was ist Lutetium
- Wo wird Lutetium gefunden
- Geschichte
- Lutetium Identifikation
- Eigenschaften und Merkmale von Lutetium
- Allgemeine Eigenschaften
- Physikalische Eigenschaften
- Chemische Eigenschaften
- Atomische Daten von Lutetium (Element 71)
- Wofür wird es verwendet
- Mögliche Auswirkungen auf die Gesundheit
- Interessante Fakten
- Kosten von Lutetium
Was ist Lutetium
Lutetium (ausgesprochen als loo-TEE-shee-em) ist ein silbriges, hartes, dichtes Seltenerdmetall, das zu den Lanthaniden gehört und durch das chemische Symbol Lu dargestellt wird. Es ist das letzte chemische Element der Lanthanidenreihe, wobei das natürlich häufigste stabile Isotop 175Lu (97,4 % Häufigkeit) ist. Ein weiteres langlebiges radioaktives Isotop, 176Lu, hat eine Halbwertszeit von 3,78 X 1010 Jahren.

Lutetium Symbol
Wo wird Lutetium gefunden
Lutetium wird wie die anderen Lanthanoide kommerziell aus dem Mineral Monazit gewonnen. Da es nur in geringen Mengen (etwa 0,003 %) im Monazit vorkommt, ist seine Gewinnung schwierig und erfolgt durch Reduktion von wasserfreiem Fluorid mit Calciummetall. Obwohl das Element in Spuren in fast allen yttriumhaltigen Mineralien vorkommt, können diese als natürliche Lutetiumquellen betrachtet werden. Die 3 wichtigsten Lutetium produzierenden Länder sind China, Russland und Malaysia, während die 3 wichtigsten Reserven haltenden Nationen China, die GUS-Länder und die USA sind.

Lutetium
Geschichte
Herkunft des Namens: Der Name des Elements leitet sich von dem römischen Wort “Lutetia” ab, dem antiken Namen für die französische Stadt Paris.
Wer entdeckte es: Obwohl der französische Chemiker Georges Urbain, der amerikanische Chemiker Charles James und der österreichische Wissenschaftler Carl Auer von Welsbach das Element unabhängig voneinander entdeckten, ging das Verdienst der Entdeckung an Urbain, da er als erster über die Ergebnisse berichtete.
Wann und wie wurde es entdeckt
Das Mineral Gadolinit oder Yttrium, das 1794 entdeckt wurde, war die Quelle von Yttrium, Terbia, Erbia und anderen Seltenerdelementen . Der Schweizer Chemiker Jean Charles Marignac trennte Erbia in zwei Komponenten, darunter Ytterbia und Erbia, von denen man annahm, dass Ytterbia eine Verbindung von Ytterbium sei.
Im Jahr 1907 isolierte Georges Urbain bei seinen Experimenten an der Sorbonne in Paris erfolgreich Ytterbium in zwei Elemente, die er Lutecium und Neoytterbium nannte. Allerdings wurden diese Elemente später von Chemikern in Lutetium bzw. Ytterbium umbenannt. Carl Auer von Welsbach trennte das Element von Ytterbium und nannte es Cassipoium nach dem Sternbild Cassiopeia. Auch Charles James gelang es, das Element an der Universität von New Hampshire zu extrahieren.
Obwohl es schwierig herzustellen ist, wurde 1953 reines Lutetium-Metall produziert.
Lutetium Identifikation |
|||
| Atomzahl | 71 | ||
| CAS-Nummer | 7439-94-3 | ||
| Position im Periodensystem | Gruppe | Periode | Block |
| Lanthanide | 6 | f | |

Lage von Lutetium im Periodensystem
Eigenschaften und Merkmale von Lutetium
Allgemeine Eigenschaften |
||||||||||||||||
| Atomische Masse | 174.967 amu | |||||||||||||||
| Relative Atommasse | 174.967 | |||||||||||||||
Physikalische Eigenschaften |
||||||||||||||||
| Farbe | Silbrig-weiß | |||||||||||||||
| Schmelzpunkt/Gefrierpunkt | 1663 °C, 3025 °F | |||||||||||||||
| Siedepunkt | 3402 °C, 6156 °F | |||||||||||||||
| Dichte | 9.84 g cm-3 | |||||||||||||||
| Zustand der Materie bei Raumtemperatur (fest/flüssig/gasförmig) | Fest | |||||||||||||||
| Härte | ||||||||||||||||
| – Brinell | 893 MPa | |||||||||||||||
| – Mohs | 2.6 | |||||||||||||||
| – Vickers | 1160 MPa | |||||||||||||||
| Elektrische Leitfähigkeit | 1.8X106 S/m | |||||||||||||||
| Wärmeleitfähigkeit | 16 W/(m K) | |||||||||||||||
| Spezifische Wärme | 154 J kg-1 K-1 | |||||||||||||||
| Blockmodul | 47.6 GPa | |||||||||||||||
| Schermodul | 27,2 GPa | |||||||||||||||
| Jungscher Modul | 68.6 GPa | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| – Temperatur (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Druck (Pa) | – | – | – | 3.28X 10-11 | 1.59X 10-7 | 6.79X 10-5 | 6.28X 10-3 | 0.211 | 3.18 | 26.7 | – | |||||
Chemische Eigenschaften |
||||||||||||||||
| Oxidationsstufen | 3 | |||||||||||||||
| Isotope | Isotop | Masse | Häufigkeit | Half-Lebensdauer | Zerfallsart | |||||||||||
| 175Lu | 174.941 | 97.40 | – | – | ||||||||||||
| 176Lu | 175.943 | 2.60 | 3.73 X 1010 Jahre | β-
β+ EC |
||||||||||||
Atomische Daten von Lutetium (Element 71)
| Wertigkeit Elektronen | 3 | |||||||
| Quantenzahlen | 2D3/2 | |||||||
| Elektronenkonfiguration (Edelgaskonfiguration) | 4f145d16s2 | |||||||
| Atomstruktur | ||||||||
| – Anzahl der Elektronen | 71 | |||||||
| – Anzahl der Neutronen | 104 | |||||||
| – Anzahl der Protonen | 71 | |||||||
| Radius des Atoms | ||||||||
| – Atomradius | 2.24 Å | |||||||
| – Kovalenter Radius | 1.74 Å | |||||||
| Elektronengativität (Pauling-Skala) | 1.0 | |||||||
| Elektronenaffinität | 32.81 kJ mol-1 | |||||||
| Ionisierungsenergie (kJ mol-1) | 1. | 2. | 3. | 4. | 5. | 6. | 7. | 8. |
| 523.516 | 1341.1 | 2022.275 | 4365.96 | 6445.2 | – | – | – | |
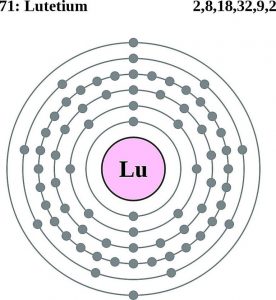
Lutetium-Elektronenkonfiguration (Bohr’sches Modell)
Wofür wird es verwendet
Außerhalb der wissenschaftlichen Forschung hat es kaum praktische Verwendung. Einige kommerzielle Verwendungen von Lutetium sind im Folgenden aufgeführt:
- Es kann als Katalysator für das Cracken von Erdölprodukten in Ölraffinerien verwendet werden.
- Radioimmuntherapie mit Lutetium-177-Dotatat wird als eine Form der Krebsbehandlung verwendet, während Lutetium-176 für die radiometrische Datierung von Meteoriten verwendet wird.
- Lutetium-Oxyorthosilikat wird in PET-Detektoren (Positronen-Emissions-Tomographie) für medizinische Scans verwendet, um ein 3D-Bild der Zellaktivität im Körper zu erstellen.
Mögliche Auswirkungen auf die Gesundheit
Lutetium hat eine geringe Toxizität und keine bekannten biologischen Funktionen im menschlichen Körper; es wird jedoch angenommen, dass es den Stoffwechsel ankurbeln kann. Es wird auch als explosionsgefährlich angesehen.
Interessante Fakten
- Lutetium ist das härteste und dichteste Element der Lanthanidengruppe.
- Es existiert in Verbindungen im Allgemeinen in seinem dreiwertigen Zustand, Lu3+.
- Das Element wird manchmal visuell durch ein Bild dargestellt, das auf dem Wappen von Paris basiert.
Kosten von Lutetium
Die reine Form von Lutetium kostet etwa 350 $ pro Gramm, aber es kostet rund 7.000 $ pro 100 Gramm in loser Schüttung.
- http://www.rsc.org/periodic-table/element/71/lutetium
- https://education.jlab.org/itselemental/ele071.html
- https://www.livescience.com/38425-lutetium.html
- https://www.webelements.com/lutetium/isotopes.html
- https://www.chemicool.com/elements/lutetium.html
- http://periodictable.com/Elements/071/data.html
- http://web.newworldencyclopedia.org/entry/Lutetium
- https://hobart.k12.in.us/ksms/PeriodicTable/lutetium.htm