US Pharm. 2012;37(6):26-29.
La enfermedad renal crónica (ERC) se define como un daño renal persistente acompañado de una reducción de la tasa de filtración glomerular (TFG) y la presencia de albuminuria. La prevalencia de la ERC ha aumentado de forma constante en las dos últimas décadas, y en 2004 se informó de que afectaba a más del 13% de la población estadounidense.1 En 2009, más de 570.000 personas en Estados Unidos fueron clasificadas como enfermos renales en fase terminal (ERT), incluidos casi 400.000 pacientes en diálisis y más de 17.000 receptores de trasplantes.2 Se considera que un paciente padece ERT cuando necesita un tratamiento sustitutivo, que incluye diálisis o trasplante renal. El aumento de la incidencia de la ERC se atribuye al envejecimiento de la población y al incremento de la hipertensión (HTA), la diabetes y la obesidad en la población estadounidense. La ERC se asocia a una serie de complicaciones, como desequilibrios electrolíticos, trastornos minerales y óseos, anemia, dislipidemia e hipertensión. Es bien sabido que la ERC es un factor de riesgo para las enfermedades cardiovasculares (ECV), y que un FG reducido y la albuminuria se asocian de forma independiente con un aumento de la mortalidad cardiovascular y por todas las causas.3,4
Se ha informado de que la HTA se da en el 85% al 95% de los pacientes con ERC (estadios 3-5).5 La relación entre la HTA y la ERC es de naturaleza cíclica. La HTA no controlada es un factor de riesgo para el desarrollo de la ERC, se asocia con una progresión más rápida de la ERC y es la segunda causa principal de ERS en los EE.UU.6,7 Por otra parte, la enfermedad renal progresiva puede exacerbar la HTA no controlada debido a la expansión del volumen y al aumento de la resistencia vascular sistémica.Múltiples directrices discuten la importancia de reducir la presión arterial (PA) para frenar la progresión de la enfermedad renal y reducir la morbilidad y la mortalidad cardiovasculares.8-10 Sin embargo, para lograr y mantener un control adecuado de la PA, la mayoría de los pacientes con ERC necesitan combinaciones de agentes antihipertensivos; a menudo puede ser necesario emplear hasta tres o cuatro clases de medicamentos11.
Patofisiología
La hipertensión es una de las principales causas de ERC debido a los efectos nocivos que el aumento de la PA tiene sobre la vasculatura renal.La PA elevada y no controlada a largo plazo provoca una presión intraglomerular elevada, lo que afecta a la filtración glomerular.12,13 Los daños en los glomérulos conducen a un aumento de la filtración de proteínas, lo que provoca un aumento de las cantidades de proteínas en la orina (microalbuminuria o proteinuria).12,13 La microalbuminuria es la presentación de pequeñas cantidades de albúmina en la orina y suele ser el primer signo de la ERC. La proteinuria (relación proteína/creatinina ≥200 mg/g) se desarrolla a medida que la ERC progresa, y se asocia a un mal pronóstico tanto de la enfermedad renal como de la ECV.3,4,14
Como se ha comentado anteriormente, la relación entre la ERC y la HTA es cíclica, ya que la ERC puede contribuir o causar HTA. La elevación de la PA provoca daños en los vasos sanguíneos del riñón, así como en todo el cuerpo. Este daño afecta a la capacidad del riñón para filtrar líquidos y residuos de la sangre, lo que provoca un aumento del volumen de líquido en la sangre y, por tanto, un aumento de la PA.
Estadística de la ERC
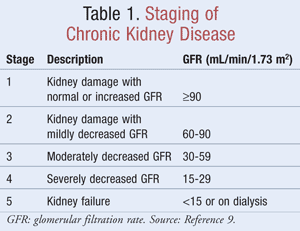
La estimación del FG, que ayuda a los médicos a determinar el grado de filtración de residuos por parte de los riñones, se utiliza en la estadificación de la ERC. La Fundación Nacional del Riñón define la ERC como un daño renal, identificado por marcadores en la orina o la sangre o por imágenes, con o sin cambios en el FG, o un FG <60 mL/min/1,73 m2 durante un mínimo de 3 meses.9 La TABLA 1 muestra los criterios de estadificación según las directrices de la Kidney Disease Outcomes Quality Initiative (K/DOQI).9
Objetivos del tratamiento
Los pacientes con ERC diabética y no diabética deben tener un objetivo de PA de <130/80 mmHg.8-10Mantener el control de la PA y minimizar la proteinuria en los pacientes con ERC e HTA es esencial para prevenir la progresión de la enfermedad renal y el desarrollo o el empeoramiento de la ECV.8,9
Las publicaciones recientes sugieren que los objetivos de PA en la ERC diabética y no diabética pueden tener que individualizarse en función de la presencia de proteinuria. Algunos ensayos no han mostrado una reducción de los resultados cardiovasculares o renales en pacientes diabéticos y no diabéticos con ERC cuando se alcanza un objetivo de PA de <130/80 mmHg en comparación con la reducción de la PA a <140/90 mmHg.15,16 Sin embargo, los pacientes que tienen proteinuria tienen menos probabilidades de experimentar un deterioro de la función renal, insuficiencia renal o muerte cuando se alcanza el objetivo de PA más bajo.15,17Es probable que las futuras directrices incluyan un objetivo de PA más bajo, <130/80 mmHg, para los pacientes con proteinuria, pero mantengan un objetivo de<140/90 mmHg para los pacientes sin proteinuria.
Tratamiento
Los agentes que no sólo reducen la PA sino también la proteinuria se recomiendan como tratamiento de primera línea para la mayoría de los pacientes con ERC y NHT; los datos indican que puede haber beneficios significativos a largo plazo en los resultados tanto cardiovasculares como renales cuando se reduce la proteinuria.9Varias clases de agentes antihipertensivos pueden tener un papel en el tratamiento de la ERC y la HTA. Los fármacos dirigidos al sistema renina-angiotensina-aldosterona (SRAA), como los inhibidores de la enzima convertidora de la angiotensina (IECA) o los bloqueadores de los receptores de la angiotensina (ARA), se consideran generalmente como tratamiento antihipertensivo de primera línea para esta población de pacientes.8,9,18 La TABLA 2 ofrece orientación sobre los agentes antihipertensivos recomendados para pacientes con ERC con o sin diabetes y con o sin proteinuria.
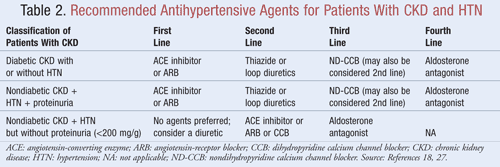
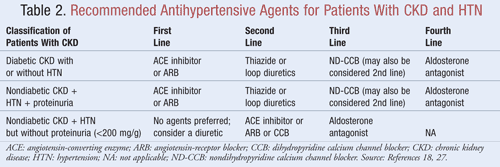
Inhibidores de la ECA o ARA: Los estudios han demostrado que los agentes antihipertensivos dirigidos al sistema renina-angiotensina previenen el deterioro renal en mayor medida que otros agentes, incluso cuando se logran objetivos de PA similares.19 Estos resultados se encontraron principalmente en pacientes con proteinuria, mientras que el beneficio fue menos sustancial para aquellos sin proteinuria. Sobre la base de estos resultados, las directrices recomiendan el tratamiento con inhibidores de la ECA o ARA como tratamiento de primera línea para los pacientes con diabetes o los que presentan enfermedad renal no diabética, HTA y proteinuria. Los datos indican que los inhibidores de la ECA y los ARA son igualmente eficaces para reducir la PA y la proteinuria.20 Un reciente metanálisis sugiere que el tratamiento con inhibidores de la ECA puede proporcionar un beneficio superior al tratamiento con ARA para el tratamiento de la HTA debido a una reducción del 10% en la mortalidad por todas las causas.21 Estos resultados se determinaron para los pacientes con HTA y no se aplicaron a los pacientes con comorbilidades adicionales como la ERC. Por lo tanto, la selección de un agente en lugar de otro dependerá de factores específicos del paciente, como los posibles efectos secundarios y el coste. No se recomienda el tratamiento con un inhibidor de la ECA y un ARA, ya que se ha demostrado que esta combinación empeora la función renal. El tratamiento combinado de inhibidores de la ECA y ARA no redujo la mortalidad o morbilidad cardiovascular en comparación con la monoterapia de un inhibidor de la ECA.20,21
Los inhibidores de la ECA y los ARA son generalmente bien tolerados. Los inhibidores de la ECA pueden provocar tos seca, lo que desgraciadamente requiere a menudo un cambio de tratamiento. Los ARA no se asocian a la tos seca. El angioedema es muy poco frecuente; sin embargo, los pacientes que empiezan a tomar IECAs o ARAs deben ser informados de los signos y síntomas que pueden presentarse con angioedema.Informar a los pacientes de que el angioedema es poco probable, pero si experimentan hinchazón en la cara (a menudo incluyendo los párpados) y/o en las extremidades, deben interrumpir el tratamiento y buscar atención médica inmediatamente.18
Tiazida vs. Diuréticos de asa: Para los pacientes sin proteinuria, no se ha establecido claramente un tratamiento preferido de primera línea, y pueden considerarse otros agentes, como una tiazida. Los pacientes con ERC e HTA suelen experimentar retención de líquidos o sobrecarga de líquidos. En consecuencia, los diuréticos suelen ser necesarios en su régimen de tratamiento. Las tiazidas se recomiendan para los pacientes con ERC en estadios 1 a 3 (TFG ≥30 mL/min), y se han establecido como agentes eficaces para la reducción de la PA y del riesgo de ECV.22 Los diuréticos de asa se recomiendan para los pacientes con ERC en estadios 4 o 5 (TFG <30 mL/min), ya que han demostrado ser más eficaces en la reducción del volumen de líquido extracelular en los pacientes con una TFG muy reducida.18 Sin embargo, el efecto a largo plazo de los diuréticos de asa sobre los resultados cardiovasculares no se ha establecido claramente.23
Los diuréticos tiazídicos (clortalidona, hidroclorotiazida) y los diuréticos de asa (bumetanida, furosemida, torsemida) provocan hiperuricemia (aumento de la micción). Este aumento de la pérdida de líquidos puede provocar un desequilibrio electrolítico. Es importante que los pacientes que toman estos agentes tengan controlados sus electrolitos para asegurarse de que no experimentan anomalías electrolíticas como hiperpotasemia o hipomagnesemia. La hipotensión ortostática puede ocurrir en respuesta a cualquier agente antihipertensivo; sin embargo, es común con los diuréticos. Es importante aconsejar a los pacientes que inician el tratamiento con diuréticos sobre la necesidad de levantarse lentamente desde una posición sentada o tumbada.24,25
Bloqueantes de los canales del calcio: Los bloqueantes de los canales del calcio (BCC) se consideran un tratamiento de segunda o tercera línea en el tratamiento de la HTA en pacientes con ERC.8,9 Aunque puede no haber diferencias en el efecto de la disminución de la PA entre los BCC no dihidropiridínicos (BCC-ND; por ejemplo, diltiazem, verapamilo) y los BCC dihidropiridínicos (por ejemplo, amlodipino, nifedipino), los BCC-ND han demostrado que reducen significativamente la proteinuria cuando se utilizan solos o en combinación con un inhibidor de la ECA o un ARA.26 Debido a su potencial para reducir la proteinuria, además de sus efectos antihipertensivos, los BCC-ND deberían considerarse como tratamiento de segunda o tercera línea en pacientes con ERC diabética o ERC no diabética con proteinuria. Los BCC dihidropiridínicos pueden utilizarse como agentes de segunda línea en pacientes con ERC no diabética sin proteinuria. Los efectos adversos comunes incluyen edema y estreñimiento con los BCC-ND (especialmente el verapamilo) y rubor y edema periférico con los agentes dihidropiridínicos.18
Antagonistas de la aldosterona: La aldosterona desempeña un papel muy perjudicial en la progresión de la ERC. Los antagonistas de los receptores de la aldosterona (por ejemplo, espironolactona, eplerenona) pueden tener un lugar en el tratamiento de la ERC cuando no se han alcanzado los objetivos de PA con el tratamiento de primera y segunda línea. Estos agentes han demostrado en ensayos humanos que proporcionan una reducción de la proteinuria cuando se añaden a un inhibidor de la ECA o a un ARA.27,28
Los antagonistas de la aldosterona son diuréticos ahorradores de potasio, que aumentan el riesgo de hiperpotasemia, especialmente si se toman con un inhibidor de la ECA o un ARA. Es importante que los pacientes que empiezan a tomar diuréticos ahorradores de potasio se sometan a un control de sus niveles de potasio para asegurarse de que no sufren anomalías electrolíticas. Los síntomas de hiperpotasemia incluyen arritmia cardíaca y debilidad muscular grave.Desgraciadamente, la hiperpotasemia puede presentarse de forma asintomática, lo que subraya la importancia del control.18,27
Inhibidor de la renina: El aliskiren es el único inhibidor de la renina disponible actualmente en el mercado. Está indicado para el tratamiento de la HTA como monoterapia o como terapia combinada con valsartán. Los datos recientes del ensayo ALTITUDE han llevado a la contraindicación de su uso con inhibidores de la ECA o ARA en pacientes con diabetes o insuficiencia renal (FG <60 mL/min) debido al mayor riesgo de insuficiencia renal, hipotensión e hiperpotasemia.29 El aliskiren puede considerarse si el paciente no puede tomar un inhibidor de la ECA o un ARA; sin embargo, su uso no puede recomendarse en pacientes con insuficiencia renal en estadio 4 o 5.30
Bloqueantes beta: Los datos que evalúan el efecto de los betabloqueantes en la progresión de la ERC y la proteinuria son limitados.27 Aunque los betabloqueantes no se incluyen en la TABLA 2, estos agentes pueden considerarse como tratamiento de segunda o tercera línea si el paciente tiene una indicación convincente para un betabloqueante, como la enfermedad arterial coronaria o la insuficiencia cardíaca crónica.18
Recomendaciones no farmacológicas
Cronoterapia: Este tipo de terapia tiene en cuenta los patrones circadianos de la PA, e instituye la administración de la medicación antihipertensiva con respecto a los patrones diarios, alejándose de la administración de todos los medicamentos antihipertensivos por la mañana. Los ensayos han demostrado un mejor control de la PA durante las 24 horas en los pacientes que se administran BCC por la noche en lugar de por la mañana.31,32 Otros estudios han identificado el beneficio de la administración nocturna de otros medicamentos antihipertensivos como los inhibidores de la ECA o los ARA.33,34 La cronoterapia puede justificar alguna consideración para aquellos que no pueden alcanzar su objetivo de PA cuando se administran todos los agentes antihipertensivos por la mañana. Si los pacientes toman más de dos agentes antihipertensivos, puede ser apropiado administrar dos agentes por la mañana y los agentes adicionales por la noche.
Modificación del estilo de vida: El aumento de la actividad física, la pérdida de peso y las modificaciones de la dieta se recomiendan para todos los pacientes con HTA.8 La modificación del estilo de vida sigue siendo un componente crítico del tratamiento de la HTA, independientemente de que los pacientes requieran medicamentos para alcanzar su objetivo de PA. La dieta DASH (Dietary Approaches to Stop Hypertension) hace hincapié en el aumento del consumo de frutas y verduras, la inclusión de productos lácteos bajos en grasa y proteínas magras, y la restricción de las grasas saturadas; se ha demostrado que este plan de alimentación reduce significativamente la PA sistólica, casi de forma equivalente a la reducción lograda por la monoterapia antihipertensiva.35 Además, se ha establecido que la disminución de la ingesta de sodio y alcohol es una intervención eficaz para reducir la PA.8La iniciación de estas prácticas dietéticas saludables, al tiempo que se aumenta la actividad diaria, aumenta el beneficio recibido del tratamiento antihipertensivo y puede desempeñar un papel esencial en la consecución de los objetivos de PA.
Resumen
La interrelación de la ERC y la HTA hace que se haga más hincapié en la importancia de lograr el control de la PA y la disminución de la proteinuria, si está presente. Los agentes que reducen la proteinuria, además de la PA, son generalmente de primera línea, pero los pacientes pueden necesitar a menudo de tres a cuatro agentes antihipertensivos para alcanzar sus objetivos y minimizar su riesgo de ECV y ERS. Además, las modificaciones del estilo de vida saludable deben considerarse siempre como un componente vital de cualquier régimen terapéutico antihipertensivo.
1. Coresh J, Selvin E, Stevens LA, et al. Prevalencia de la enfermedad renal crónica en los Estados Unidos. JAMA. 2007;298:2038-2047.
2. Collins AJ, Foley RN, Chavers B, et al. U.S. renal data system 2011 annual data report. Am J Kidney Dis. 2012;59(suppl 1):evii.
3. Matsushita K, van der Velde M, Astor BC, et al.Association of estimated glomerular filtration rate and albuminuria withall-cause and cardiovascular mortality in general population cohorts: acollaborative meta-analysis. Lancet. 2010;375:2073-2081.
4. Rashidi A, Sehgal AR, Rahman M, O’Connor AS. El caso de que la enfermedad renal crónica, la diabetes mellitus y el infarto de miocardio sean factores de riesgo equivalentes para la mortalidad cardiovascular en pacientes mayores de 65 años. Am J Cardiol. 2008;102:1668-1673.
5. Rao MV, Qiu Y, Wang C, Bakris G. Hypertension and CKD:Kidney Early Evaluation Program (KEEP) and National Health and NutritionExamination Survey (NHANES), 1999-2004. Am J Kidney Dis. 2008;51(suppl 2):S30-S37.
6. Botdorf J, Chaudhary K, Whaley-Connell A. Hypertension in cardiovascular and kidney disease. Cardiorenal Med. 2011;1:183-192.
7. Segura J, Ruilope L. Hipertensión en pacientes con ERC moderada-grave no diabéticos. Adv Chronic Kidney Dis. 2011;18:23-27.
8. Chobanian AV, Bakris GL, Black HR, et al. The seventhreport of the Joint National Committee on Prevention, Detection,Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA. 2003;289:2560-2572.
9. Fundación Nacional del Riñón. K/DOQI clinical practiceguidelines for chronic kidney disease: evaluation, classification, andstratification. Am J Kidney Dis. 2002;39(suppl 1):S1-S266.
10. Asociación Americana de la Diabetes. Standards of medical care in diabetes-2012. Diabetes Care. 2012;35(suppl 1):S1-S63.
11. Bakris GL, Williams M, Dworkin L, et al. Preservación de la función renal en adultos con hipertensión y diabetes: un enfoque de consenso. National Kidney Foundation Hypertension and Diabetes ExecutiveCommittees Working Group. Am J Kidney Dis. 2000;36:646-661.
12. Keane WF, Eknoyan G. Proteinuria, albuminuria, risk,assessment, detection, elimination (PARADE): a position paper for theNational Kidney Foundation. Am J Kidney Dis. 1999;33:1004-1010.
13. Yoshioka T, Rennke HG, Salant DJ, et al. Role ofabnormally high transmural pressure in the permselectivity defect ofglomerular capillary wall: a study in early passive Heymann nephritis. Circ Res. 1987:61:531-538.
14. Sarnak M, Levey A, Schoolwerth A, et al. Kidneydisease as a risk factor for the development of cardiovascular disease: astatement from the American Heart Association Councils on Kidney inCardiovascular Disease, High Blood Pressure Research, ClinicalCardiology, and Epidemiology and Prevention. Circulation. 2003;108:2154-2169.
15. Upadhyay A, Earley A, Haynes SM, Uhlig K. Systematicreview: blood pressure target in chronic kidney disease and proteinuriaas an effect modifier. Ann Intern Med. 2011;154:541-548.
16. Cushman C, Evan GW Byington RP, et al. The ACCORDstudy group. Intensive blood-pressure control in type 2 diabetesmellitus. N Engl J Med. 2010;363:1575-1585.
17. Brenner BM, Cooper ME, De Zeeuw D, et al. Effects oflosartan on renal and cardiovascular outcomes in type 2 diabetes andnephropathy. N Engl J Med. 2001;345:861-869.
18. Kidney Disease Outcomes Quality Initiative (K/DOQI).K/DOQI clinical practice guidelines on hypertension and antihypertensiveagents in chronic kidney disease. Am J Kidney Dis. 2004;43(suppl 1):S1-S290.
19. Remuzzi G, Chiurchiu C, Ruggenenti P. Proteinuria predicting outcome in renal disease: nondiabetic nephropathies (REIN). Kidney Int Suppl. 2004;66:S90-S96.
20. Sharma P, Blackburn RC, Parke CL, et al.Inhibidores de la enzima convertidora de angiotensina y bloqueadores de los receptores de angiotensina para adultos con enfermedad renal crónica no diabética temprana (estadio 1 a 3). Cochrane Database Syst Rev. 2011;(10):CD007751.
21. van Vark LC, Bertrand M, Akkerhuis KM, et al.Los inhibidores de la enzima convertidora de la angiotensina reducen la mortalidad en la hipertensión: un metaanálisis de los ensayos clínicos aleatorios de los inhibidores del sistema renina-angiotensina-aldosterona con 158.998 pacientes. Eur Heart J. 2012 Apr 17; Epub ahead of print.
22. Major outcomes in high-risk hypertensive patientsrandomized to angiotensin-converting enzyme inhibitor or calcium channelblocker vs. diuretic: the Antihypertensive and Lipid-Lowering Treatmentto Prevent Heart Attack Trial (ALLHAT). JAMA. 2002;288:2981-2997.
23. Musini VM, Wright JM, Bassett K, Jauca CD. Eficacia reductora de la presión arterial de los diuréticos de asa para la hipertensión primaria (Revisión Cochrane traducida). Cochrane Database Syst Rev. 2009;(4):CD003825.
24. Prospecto de Microzide (cápsulas orales de hidroclorotiazida). Watson Pharma, Inc: Morristown, NJ; 2011.
25. Prospecto de los comprimidos orales de clortalidona. Mylan Pharmaceuticals, Inc: Morgantown, WV; 2006.
26. Bakris GL, Weir MR, Secic M, et al. Differentialeffects of calcium antagonist subclasses on markers of nephropathyprogression. Kidney Int. 2004;65:1991-2002.
27. Navaneethan SD, Nigwekar SU, Sehgal AR, et al.Aldosterone antagonists for preventing the progression of chronic kidneydisease. Clin J Am Soc Nephrol. 2009;4:542-551.
28. Mehdi UF, Adams-Huet B, Raskin P, et al. Addition ofangiotensin receptor blockade or mineralocorticoid antagonism to maximalangiotensin-converting enzyme inhibition in diabetic nephropathy. J Am Soc Nephrol. 2009;20:2641-2650.
29. Medicamentos que contienen aliskiren: comunicación de seguridad del medicamento-nueva advertencia y contraindicación. MedWatch.20 de abril de 2012.www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm301120.htm?source=govdelivery;4/20/2012.Consultado el 1 de mayo de 2012.
30. Trimarchi H. Papel de aliskiren en el control de la presión arterial y la renoprotección. Int J Nephrol Renovasc Dis. 2011;4:41-48.
31. Portaluppi F, Vergnani L, Manfredini R, et al.Time-dependent effect of isradipine on the nocturnal hypertension inchronic renal failure. Am J Hypertens. 1995;8:719-726.
32. Hermida RC, Calvo C, Ayala DE, et al. Efectos dependientes de la dosis y del tiempo de administración de nifedipino GITS sobre la presión arterial ambulatoria en sujetos hipertensos. Chronobiol Int. 2007;24:471-493.
33. Hermida RC, Ayala DE. Cronoterapia con el inhibidor de la enzima convertidora de la angiotensina ramipril en hipertensión esencial: mejor control de la presión arterial con la dosis a la hora de acostarse. Hypertension. 2009;54:40-46.
34. Hermida RC, Calvo C, Ayala DE, et al. Efectos dependientes del tiempo de administración de valsartán sobre la presión arterial ambulatoria en sujetos hipertensos. Hypertension. 2003;42:283-290.
35. Sacks FM, Svetkey LP, Vollmer WM, et al. Effects onblood pressure of reduced dietary sodium and the Dietary Approaches toStop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group.N Engl J Med. 2001;344:3-10.