Pressure, Volume, and Temperature Relationships in Real Gases
Ideaalikaasulle \(PV/nRT\) vs. \(P\) kuvaaja antaa vaakasuoran viivan, jonka leikkauspiste on 1 \(PV/nRT\)-akselilla. Todellisissa kaasuissa on kuitenkin huomattavia poikkeamia ideaalikaasulta odotetusta käyttäytymisestä, erityisesti korkeissa paineissa (kuva \(\PageIndex{1a}\)). Vain suhteellisen alhaisissa paineissa (alle 1 atm) todelliset kaasut lähestyvät ideaalikaasun käyttäytymistä (kuva \(\PageIndex{1b}\)).
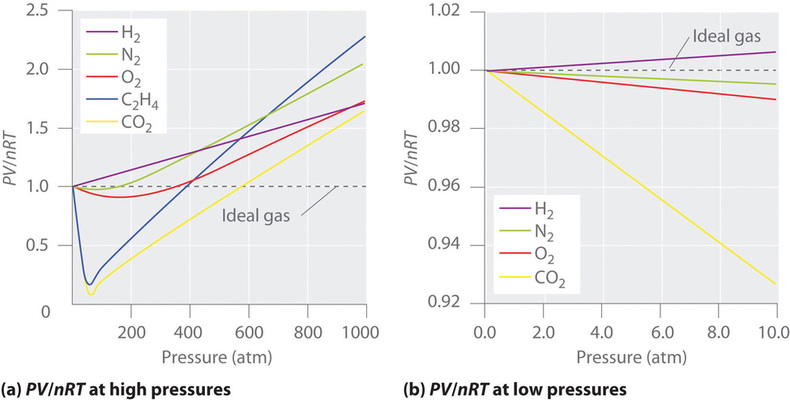
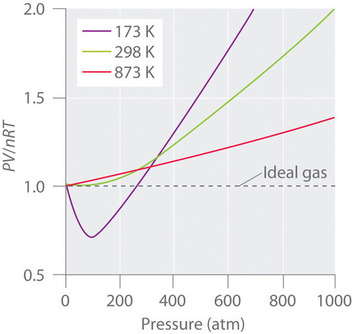
Todelliset kaasut lähestyvät ideaalikaasun käyttäytymistä lähempänä myös korkeammissa lämpötiloissa, kuten kuvassa \(\PageIndex{2}\) \(N_2\) näkyy. Miksi todelliset kaasut käyttäytyvät niin eri tavalla kuin ideaalikaasut korkeissa paineissa ja alhaisissa lämpötiloissa? Näissä olosuhteissa ideaalikaasulain kaksi perusoletusta – nimittäin se, että kaasumolekyylien tilavuus on mitätön ja että molekyylien väliset vuorovaikutukset ovat merkityksettömiä – eivät enää päde.
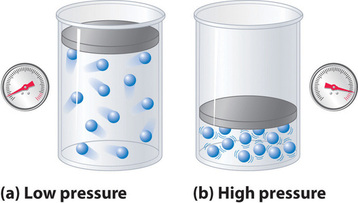
Koska ideaalikaasun molekyyleillä oletetaan olevan nollatilavuus, niiden käytettävissä oleva tilavuus liikettä varten on aina sama kuin säiliön tilavuus. Sitä vastoin todellisen kaasun molekyyleillä on pienet mutta mitattavissa olevat tilavuudet. Pienissä paineissa kaasumolekyylit ovat suhteellisen kaukana toisistaan, mutta kaasun paineen kasvaessa molekyylien väliset etäisyydet pienenevät koko ajan (kuva \(\PageIndex{3}\)). Tämän seurauksena molekyylien viemästä tilavuudesta tulee merkittävä verrattuna säiliön tilavuuteen. Näin ollen kaasun kokonaistilavuus on suurempi kuin ideaalikaasulain ennustama tilavuus. Näin ollen hyvin korkeissa paineissa kokeellisesti mitattu PV/nRT-arvo on suurempi kuin ideaalikaasulain ennustama arvo.
Lisäksi kaikki molekyylit vetävät toisiaan puoleensa voimien yhdistelmällä. Nämä voimat tulevat erityisen tärkeiksi kaasuille alhaisissa lämpötiloissa ja korkeissa paineissa, joissa molekyylien väliset etäisyydet ovat lyhyempiä. Molekyylien väliset vetovoimat vähentävät törmäysten määrää säiliön seinämän kanssa, ja tämä vaikutus korostuu, kun vetovoimaisten vuorovaikutusten määrä kasvaa. Koska molekyylien keskimääräinen etäisyys pienenee, kaasun säiliön seinämään kohdistama paine pienenee, ja havaittu paine on odotettua pienempi (kuva \(\PageIndex{4}\)). Kuten kuvasta \(\PageIndex{2}\) nähdään, alhaisissa lämpötiloissa \(PV/nRT\) -suhde on alhaisempi kuin ideaalikaasulle ennustettu, ja tämä vaikutus tulee erityisen ilmeiseksi monimutkaisille kaasuille ja yksinkertaisille kaasuille alhaisissa lämpötiloissa. Hyvin korkeissa paineissa nollasta poikkeavan molekyylitilavuuden vaikutus on hallitseva. Näiden vaikutusten välinen kilpailu aiheuttaa monille kaasuille \(PV/nRT\) vs. \(P\) -kuvaajassa havaitun minimin.
Nollasta poikkeava molekyylitilavuus tekee todellisen tilavuuden ennustettua suuremmaksi korkeissa paineissa; molekyylien väliset vetovoimat tekevät paineen ennustettua pienemmäksi.
Korkeissa lämpötiloissa molekyyleillä on riittävästi kineettistä energiaa, jotta ne pystyvät kukistamaan molekyylien väliset vetovoimat ja nollasta poikkeavan molekyylitilavuuden vaikutukset ovat hallitsevia. Sitä vastoin lämpötilan laskiessa kaasumolekyylien kineettinen energia pienenee. Lopulta saavutetaan piste, jossa molekyylit eivät enää pysty voittamaan molekyylien välisiä vetovoimia, ja kaasu nesteytyy (tiivistyy nesteeksi).