- Mikä on polaarinen kovalenttinen sidos?
- Polaaristen kovalenttisten sidosten ominaisuudet
- Esimerkkejä polaarisista kovalenttisista sidoksista
- Vesi (H2O)
- Kloorivety (HCl)
- Ammoniakki (NH3)
- Vetybromidi (HBr)
- Polaarisen ja poolittoman kovalenttisen sidoksen ero
- Polaarinen kovalenttinen sidos vs. ei-polaarinen kovalenttinen sidos. Epäpolaarinen kovalenttinen sidos
Mikä on polaarinen kovalenttinen sidos?
Kovalenttinen sidos muodostuu, kun kaksi atomia jakaa elektroneja keskenään. Kovalenttinen sidos on todennäköisesti polaarinen, kun elektronit ovat jakautuneet epätasaisesti. Vinous syntyy kahden atomin elektronegatiivisuuserosta. Elektronegatiivisuus mittaa atomin taipumusta vetää puoleensa sidoselektroniparia. Sitä mitataan Paulingin asteikolla, ja se vaihtelee välillä 0,7-4. Seuraavassa taulukossa selitetään, minkä tyyppinen kemiallinen sidos muodostuu tämän elektronegatiivisuuseron vuoksi.
| Kemiallisen sidoksen tyyppi | Elektronegatiivisuusero |
|---|---|
| Epäpolaarinen kovalenttinen | 0 |
| Vähän polaarinen kovalenttinen | 0 .1 – 0,4 |
| Polaarinen kovalentti | 0,5 – 2 |
| Ioninen | > 2 |
Mitä merkittävämpi ero elektronegatiivisuudessa on, sitä suuremmat ovat polariteetti ja sidoksen voima. Näin ollen polaarisilla kovalenttisilla sidoksilla on keskinkertainen sidoslujuus.
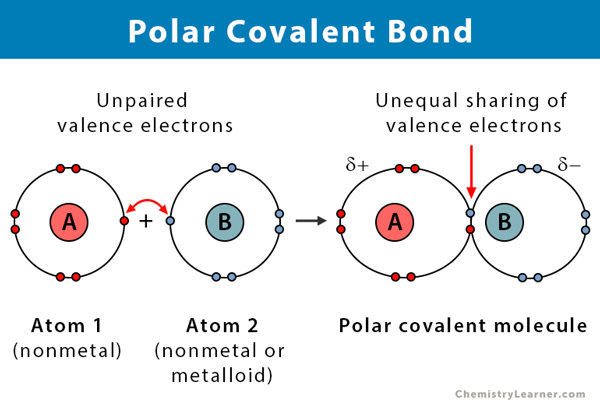
Polaaristen kovalenttisten sidosten ominaisuudet
Seuraavassa on joitain faktoja polaarisista kovalenttisista sidoksista.
- Se tapahtuu kahden epämetallin välillä tai epämetallin ja metalloidin välillä
- Elektronien epätasa-arvoinen jakautuminen yhdisteessä
- Atomien välinen elektronegatiivisuusero on välillä 0.1 ja 2
- Sidoksen toinen pää on positiivisesti varautunut ja toinen pää negatiivisesti varautunut
- Polaariset yhdisteet liukenevat polaariseen liuottimeen
Esimerkkejä polaarisista kovalenttisista sidoksista
Tässä on esimerkkejä polaarisista kovalenttisista sidoksista, joissa on elektronegatiivisuusero kahden sidoksen muodostaneen atomin välillä :
| Yhdisteen nimi | Molekyylikaava | Sidos | Elektronegatiivisuus Ero | |
|---|---|---|---|---|
|
Vesi |
H2O |
O-H |
||
| Fluorivety | HF | H-F | 1.9 | |
| Kloorivety | HCl |
H-Cl |
0.9 | |
|
Vetybromidi |
HBr |
H-Br |
||
|
Ammonia |
NH3 |
N-H |
||
|
Rikkidioksidi |
SO2 | S=O | 1 | |
| Rikkivety | H2S | H-S | 0.4 | |
| Metanoli | CH3OH | O-H | 1.4 |
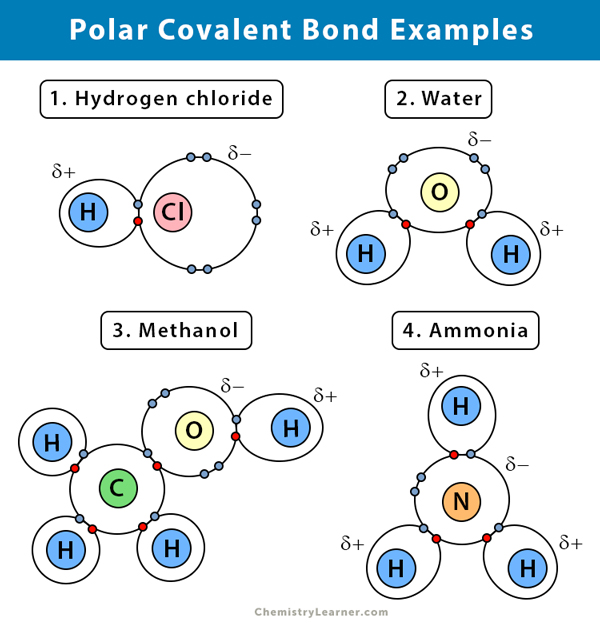
Alhaalla on selitys polaarisesta kovalenttisesta sidoksesta eräissä yhdisteissä.
Vesi (H2O)
Vesi on polaarinen liuotin. Polaarinen kovalenttinen sidos syntyy, kun happiatomi (O), joka on vetyä elektronegatiivisempi, vetää jaetut elektronit itseensä. Tämän seurauksena happiatomiin liittyy osittain negatiivinen varaus. Vetygeenit (H) taas ovat pohjimmiltaan protoneja, ja niihin liittyy osittainen positiivinen varaus.
Kloorivety (HCl)
Kloorivety on polaarinen kovalenttinen yhdiste, koska klooriatomi (Cl) on elektronegatiivisempi kuin vetyatomi (H). Kloorilla on siis osittain negatiivinen varaus, kun taas vedyllä on osittain positiivinen varaus.
Ammoniakki (NH3)
Ammoniakki on poolinen molekyyli. Keskusatomi, typpi (N), on sitoutunut kolmeen vetyatomiin (H). Koska N on elektronegatiivisempi kuin H, elektronit pyrkivät roikkumaan N-atomin ympärillä.
Vetybromidi (HBr)
Elektronegatiivisuusero vedyn (H) ja bromin (Br) välillä ei ole liian suuri. Siksi HBr-kaasulla on kovalenttinen sidos polarisoitunut, ja vetyatomilla on lievästi positiivinen varaus ja bromilla lievästi negatiivinen varaus. Tämän seurauksena elektronipari vetää puoleensa bromia.
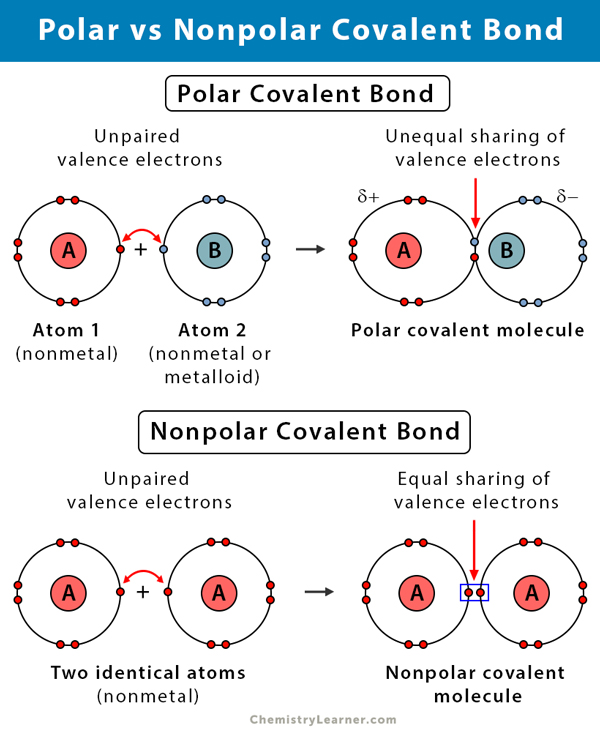
Polaarisen ja poolittoman kovalenttisen sidoksen ero
Seuraavassa taulukossa verrataan ja vastakkain polaarista ja poolitonta kovalenttista sidosta.
Polaarinen kovalenttinen sidos vs. ei-polaarinen kovalenttinen sidos. Epäpolaarinen kovalenttinen sidos |
|||
| Polaarinen | Epäpolaarinen | ||
|---|---|---|---|
|
Atomityypit |
Kahden ei-metallin välillä joilla on eri elektronegatiivisuus |
Kahden saman elektronegatiivisuuden omaavan epämetallin välillä |
|
|
Elektronegatiivisuusero |
0.1 – 2 |
||
|
Elektronijakauma |
Asymmetrinen. Epätasainen jakautuminen. |
Symmetrinen. Tasapuolinen jakautuminen. |
|
|
Jakautuneiden elektronien siirtyminen |
Elektronegatiivisempaan atomiin päin, jolloin kyseinen osa on negatiivinen |
Ei siirtymistä. Sähköisesti neutraali. |
|
|
Dipolimomentti |
Ei-nolla |
Nolla |
|
|
Muiden sidostyyppien esiintyminen yhdisteissä |
Vetysidos |
Van der Waalsin sidos |
|
|
Affiniteetti vettä kohtaan |
Hydrofiilinen |
Hydrofobinen |
|
|
Yhdisteiden fysikaaliset ominaisuudet |
korkea sulamis- ja kiehumispisteet |
Matalat sulamis- ja kiehumispisteet |
|
|
Nesteiden haihtuvuus |
Matalat haihtuvuudet |
Korkea haihtuvuus |
|
|
Yhdisteiden liukoisuus |
Liukenee polaarisiin liuottimiin |
Liukenee ei-polaarisiin liuottimiin |
|
|
Esimerkkejä |
Vesi (H2O), ammoniakki (NH3) ja kloorivety (HCl) |
Vety (H2), happi (O2) ja typpi (N2) |
|
.