Abstract
Kaulan alueen massan diagnosointi voi olla haasteellista. Aikuisilla yleisin diagnoosi on pahanlaatuisuus, ja sekä primaariset että metastaattiset kasvaimet on otettava huomioon. Muita yleisiä vaihtoehtoja ovat infektioprosessit. Esittelemme tapauksen 88-vuotiaasta naispotilaasta, jolla oli submandibulaarinen massa, johon liittyi tulehdusoireita ja joka ei reagoinut antibioottihoitoon, ja jonka ohutneula-aspiraatiobiopsia osoitti tulehdusleesiota. Massa kehittyi kuukauden aikana, ja siihen liittyi anoreksia, minkä vuoksi hänet otettiin hoitoon diagnoosin tekoa varten ja tehtiin avoin biopsia. Vastaanoton jälkeen todettiin oikean rinnan invasiivinen karsinooma, ja submandibulaarisen massan biopsian mykobakteeriviljely oli positiivinen Mycobacterium tuberculosis -bakteerille. Iäkkäiden immunosenessenssi lisää alttiutta syöville, mutta myös infektioille, jotka voivat esiintyä epätyypillisesti ja johtaa siten viivästyneeseen diagnoosiin.
Johdanto
Kaulan massojen erotusdiagnostiikka on erittäin haastavaa, sillä useita tekijöitä on otettava huomioon. Tärkein diagnoosivaihtoehto aikuisilla on pahanlaatuisuus, joko primaarinen, metastaattinen ylähengitysteiden tai ruoansulatuskanavan kasvaimista tai lymfooma . Myös hyvänlaatuisia kasvaimia, kuten lipoomia, fibroomia ja hemangioomia, voi esiintyä.
Seitsemänkymmentäviisi prosenttia yli 40-vuotiailla potilailla esiintyvistä kaulan kasvaimista on pahanlaatuisia , ja riski kasvaa iän myötä . Vaurion koko ja oireiden kesto ovat muita tärkeitä pahanlaatuisuusriskin ennustajia , samoin kuin krooninen auringolle altistuminen, tupakointi, alkoholinkäyttö, huono hampaisto, ympäristöaltistukset ja sukuhistoria .
Massan fyysiset ominaisuudet ovat myös tärkeitä erotusdiagnostiikassa. Kiinteät, kovat tai kiinteät, epäsäännöllisesti rajatut massat viittaavat kiinteisiin pahanlaatuisiin kasvaimiin; useat pehmeät ja kumimaiset massat viittaavat lymfoomaan; massat, joissa on tulehdusoireita, viittaavat infektiosyihin .
Tulehdukselliset massat voivat olla seurausta imusolmukkeiden tulehduksesta (kohdunkaulan adeniitti), jotka ovat tavallisesti itsestään rajoittuvia ja häviävät spontaanisti . Submandibulaari- tai parotisrauhasten krooninen tulehdus, johon liittyy krooninen sialadeniitti, on myös mahdollinen .
Tulehdukselliset syyt voivat olla luonteeltaan virus-, bakteeri- tai sieniperäisiä . Virusinfektiot, kuten sytomegalovirus (CMV), Epstein-Barrvirus (EBV), tuhkarokko, adenovirus, echovirus, rinovirus ja Respiratory Syncitial Virus (RSV), esiintyvät tavallisesti useissa imusolmukkeissa, joissa on kohdunkaulan adeniitti. Bakteeri-infektiot voivat aiheuttaa nekroosia, paiseiden muodostumista, spontaania tyhjenemistä ja jopa kroonisen fistelin muodostumista . Myös muut aiheuttajat on otettava huomioon nimittäin mykobakteerit , Bartonellan aiheuttama kissan raapiminen , aktinomykoosi , Toxoplasma gondii .
Muita harvinaisempia syitä ovat kihti , tulehduksellinen pseudotumori , Kimuran tauti , Castlemanin tauti ja sarkoidoosi .
Diagnoosi tehdään tavallisesti hienon neulan aspiraatiosytologialla, joka on nopea ja herkkä menetelmä . Jos diagnoosi jää epäselväksi, avoin biopsia voi olla tarpeen . Laboratoriokokeet vaihtelevat esiintymistavan mukaan, mutta niihin tulisi sisältyä tulehdusparametrit, mukaan lukien leukosyyttien määrä, erytrosyyttien laskeutumisnopeus (ESR), C-reaktiivinen proteiini (CRP), virus- ja bakteeriserologia kliinisen anamneesin ja tutkimuksen mukaan sekä tuberkuliinin ihotesti . Massan karakterisointi voidaan tehdä ultraäänellä, joka erottaa kystiset leesiot, sylkirauhaskasvaimet, reaktiiviset tai pahanlaatuiset imusolmukkeet toisistaan käyttämällä kriteerejä, kuten kokoa ja vaskularisaatiota . Tietokonetomografia (CT) ja magneettikuvaus (MRI) auttavat lisäksi massojen luonnehdinnassa koon ja morfologisten poikkeavuuksien (keskeinen nekroosi, rasvakudos ja heterogeenisuus) perusteella. Positroniemissiotomografiaa voidaan käyttää kaulan massojen tutkimiseen, koska se havaitsee lisääntyneen aineenvaihdunnan, mutta sitä ei kuitenkaan suositella itsenäisenä testinä, koska se ei erota tulehduksellisia ja neoplastisia leesioita toisistaan. Jos pahanlaatuisuutta epäillään, on tehtävä lisätutkimuksia, kuten kokovartalon tietokonetomografia ja endoskooppiset tutkimukset ylähengitysteistä ja ruoansulatuskanavasta .
Tapauskertomus
Esittelemme tapauksen, jossa 88-vuotias hoivakodissa asuva heikkokuntoinen nainen saapui päivystyspoliklinikalle 3-4 viikkoa kestäneen progressiivisen kulun, anoreksian ja oikeanpuoleisen, tulehdusoireita sisältäneen submandibulaarisen massan vuoksi. Häntä tutkittiin leukakirurgian osastolla, joka oli tehnyt massasta ohutneulasytologisen aspiraatiosytologian, jossa todettiin tulehdussoluja, jotka olivat negatiivisia kasvainsolujen suhteen. Lisäksi häntä oli jo lääkitty suun kautta otettavalla amoksisilliini-klavulaanihapolla (875 mg/125 mg 3id 7 päivän ajan) ilman parannusta.
Hänen aiempaan sairaushistoriaansa kuului essentiaalinen hypertensio, sinusbradykardia, perifeerinen valtimosairaus, lievä kognitiivinen heikentyminen ja masennus. Hän oli polymedikoitu aspiriinilla, olmesartaanilla, pentoksifylliinillä, paroksetiinilla ja alpratsolaamilla.
Tutkimuksessa hän oli ylipainoinen, ja hänellä näkyi 3 × 3 cm:n kokoinen, kiinteä, mutta kumimainen submandibulaarinen kasvain, johon liittyi tulehdusoireita, mutta jossa ei ollut eksudaattia (kuva 1). Hän oli kuumeeton eikä hänellä ollut muita merkityksellisiä kliinisiä oireita.
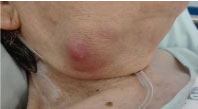 Kuva 1: Kuva oikeanpuoleisesta submandibulaarisesta massasta. Näytä kuva 1
Kuva 1: Kuva oikeanpuoleisesta submandibulaarisesta massasta. Näytä kuva 1
Taudin etenemisen vuoksi potilas otettiin jatkotutkimuksiin, mukaan lukien massan avoin biopsia, ja hänelle aloitettiin empiirinen hoito suonensisäisellä amoksisilliini-klavulaanihapolla (1000 mg/200 mg vielä 9 päivän ajan) ja klindamysiinillä (600 mg 4id 7 päivän ajan), myös ilman kliinistä paranemista.
Verikokeet osoittivat vain mikrosyyttisen hypokromaattisen anemian, johon liittyi raudanpuute, ja negatiiviset tulehdusparametrit (taulukko 1).
Taulukko 1: Potilaan verikokeet.Näytä taulukko 1
Kokovartalon tietokonetomografiassa (TT) todettiin useita nekroottisia kaulan imusolmukkeita, suurimmat vasemmassa supraklavikulaarisessa fossassa ja kyhmy oikeassa rintarauhasessa, epäsäännöllinen, jossa oli verisuonistumiseen viittaava hyperattenuoitumismerkki (kuvat 2 ja 3) (kuva 2 ja 3).
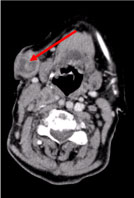 Kuva 2: Kaulan TT-kuvaus: Useita nekroottisia kaulan imusolmukkeita, suurin ihonalainen, halkaisijaltaan 27 mm (nuoli). Näytä kuva 2
Kuva 2: Kaulan TT-kuvaus: Useita nekroottisia kaulan imusolmukkeita, suurin ihonalainen, halkaisijaltaan 27 mm (nuoli). Näytä kuva 2
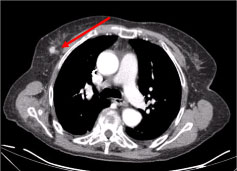 Kuva 3: Rintakehän TT-kuvaus: 10 mm:n leesio oikeassa rintarauhasessa, nodulaarinen epäsäännöllinen, jossa on verisuonistumiseen viittaava hyperattenuaatio (nuoli). Näytä kuva 3
Kuva 3: Rintakehän TT-kuvaus: 10 mm:n leesio oikeassa rintarauhasessa, nodulaarinen epäsäännöllinen, jossa on verisuonistumiseen viittaava hyperattenuaatio (nuoli). Näytä kuva 3
Tehtiin avoin biopsia, joka osoitti pehmytkudosinfiltraation polymorfisten ydinleukosyyttien ja histiosyyttien ja vaskuliitin. Gram-, Grocott-, Ziehl-Neelsen- ja PAS-värjäykset olivat negatiivisia; polymeraasiketjureaktioon (PCR) perustuva määritys Mycobacterium tuberculosis -bakteerin osoittamiseksi kudoksesta oli myös negatiivinen.
Potilas kotiutettiin ja häntä seurattiin edelleen rintakirurgian ja leukakirurgian klinikoilla.
Rintakirurgian klinikalla tehtiin ultraääniohjattu ydinnaulabiopsia rinnan leesiosta. Diagnoosina oli invasiivinen rintasyövän NOS, aste 1. Kasvain oli ER-positiivinen (90 %), PR-positiivinen (90 %), HER2 2+ immunohistokemiallisesti, ISH negatiivinen, proliferaatioindeksi (Ki67) 10 % (luminaalinen A-molekyylinen alatyyppi) (kuva 4). Se luokiteltiin cT1N0M0-luokkaan. Tällöin potilaalle aloitettiin tamoksifeenihoito.
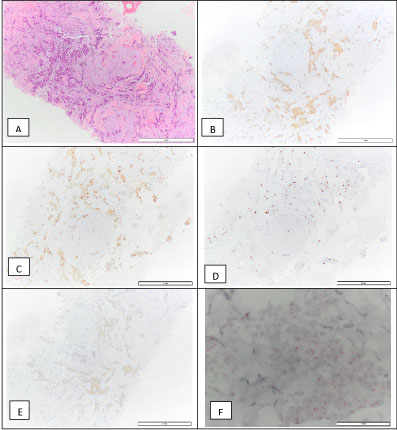 Kuva 4: Rinnan invasiivisen karsinooman biopsia: H&E (A), positiivinen estrogeenireseptorille – 90 % (B), positiivinen progesteronireseptorille – 90 % (C), Ki67 – 10 % (D), HER2 2+ (E) ja negatiivinen HER2-amplifikaatio D-ISH:llä (F), joka on yhteensopiva luuminaalisen A:n molekulaarisen alatyypin kanssa. Näytä kuva 4
Kuva 4: Rinnan invasiivisen karsinooman biopsia: H&E (A), positiivinen estrogeenireseptorille – 90 % (B), positiivinen progesteronireseptorille – 90 % (C), Ki67 – 10 % (D), HER2 2+ (E) ja negatiivinen HER2-amplifikaatio D-ISH:llä (F), joka on yhteensopiva luuminaalisen A:n molekulaarisen alatyypin kanssa. Näytä kuva 4
Kaksi kuukautta myöhemmin avoimen biopsian mykobakteeriviljely oli positiivinen Mycobacterium tuberculosis complex -bakteerille, joka oli herkkä kaikille ensilinjan antibiooteille. Potilas aloitti hoidon ensilinjan tuberkuloosilääkkeillä (300 mg isoniatsidia, 600 mg rifampisiinia, 1500 mg pyratsiiniamidia ja 1200 mg etambutolia kahden kuukauden ajan, jonka jälkeen neljä kuukautta 300 mg isoniatsidia ja 600 mg rifampisiinia), ja hänet ohjattiin tuberkuloosipoliklinikalle seurantaa varten.
Potilas kuoli 1 vuoden kuluttua alkuperäisestä diagnoosista.
Keskustelu
Kuten aiemmin on käsitelty, kaulamassan diagnoosiin vaikuttavat useat tekijät. Ikä ja hauraus ovat merkittäviä huomioon otettavia tekijöitä.
Ikään liittyy immuunivasteen heikkeneminen, jota kuvataan usein immunosenessenssiksi . Se vaikuttaa sekä adaptiiviseen että synnynnäiseen järjestelmään eri tavoin . Adaptiivisen immuunijärjestelmän toiminta heikkenee usein, yleensä T-solujen aktiivisuuden vähenemisenä . Toisaalta synnynnäisen immuunijärjestelmän on kuvattu olevan liiallinen, koska sillä ei ole riittävästi säätelyvoimaa, mikä voi johtaa pro-inflammatoriseen tilaan, joka on myös haitallinen . Immunosenessenssi on yhdistetty infektioiden yleistymiseen ja vakavuuden lisääntymiseen , pahanlaatuisten solujen heikompaan immuunivalvontaan ja rokotusten heikentyneeseen tehoon .
Immunosenessenssi vaikuttaa siis osaltaan siihen, että syöpädiagnoosit ovat lisääntyneet iäkkäillä, joiden mediaani-ikä diagnoosihetkellä on 70 vuotta . Muilla tekijöillä on merkitystä, kuten lisääntynyt altistumisaika karsinogeneesille tai ikääntyneiden solujen suurempi alttius karsinogeneesille , mutta myös lisääntynyt paradoksaalinen tulehdusreaktio .
Infektiot ovat yleisempiä ikääntyneillä, erityisesti hengitystieinfektiot , joihin liittyy suuri kuolleisuus. Tuberkuloosi on tärkeä kansanterveysongelma, joka vaikuttaa 9,6 miljoonaan ihmiseen maailmanlaajuisesti ja on lisääntynyt yli 65-vuotiaiden keskuudessa . On esitetty, että iäkkäiden tuberkuloosi johtuu usein piilevän tuberkuloosin uudelleenaktivoitumisesta, kun soluvälitteinen immuunivaste heikkenee . Se voi kuitenkin johtua myös primaari-infektiosta tai aiemmin hoidetun potilaan uudelleeninfektiosta . Muut tekijät lisäävät tuberkuloosin riskiä iäkkäillä, kuten vanhainkodissa asuminen, joka lisää riskiä 2-3-kertaisesti . Jotkin liitännäissairaudet, kuten diabetes mellitus , krooninen obstruktiivinen keuhkosairaus , maksasairaus, pahanlaatuiset kasvaimet ja sydän- ja verisuonitaudit ; immunosuppressiiviset hoidot kortikoideilla ja TNF:n vastaisilla aineilla ; ja aliravitsemus .
Tuberkuloosilla on iäkkäillä epätyypillinen kliininen esitys . Pääasiallinen esiintymistapa on edelleen keuhkotauti 75 prosentissa tapauksista , mutta keuhkojen ulkopuoliset paikat ovat yleisempiä . Elinspesifiset oireet ovat harvinaisempia, ja potilailla on enemmän epämääräisiä oireita, kuten asteniaa ja kognitiivisia häiriöitä . Diagnoosi on myös vaikeampi, koska iäkkäillä on usein kroonisia poikkeavuuksia, kuten poikkeavia maksaentsyymejä, hypoalbuminaemiaa, hyponatemiaa, hypokalemiaa ja anemiaa . Röntgenologisesti kroonisia muutoksia on vähemmän . Tuberkuliinin ihotesti jää usein määrittelemättä anergian vuoksi, ja on tarpeen tehdä uusinta, jossa hyödynnetään tehostusvaikutusta . Näyteviljelyt voivat olla negatiivisia . Hoito on haasteellista myös iäkkäillä, koska hoitomyöntyvyys on huonompi ja monilääkitys lisää toksisuuden, erityisesti maksatoksisuuden, riskiä. Kuolleisuus on myös huomattavasti korkeampi, jopa kymmenkertainen.
Tämä tapausselostus havainnollistaa iäkkäiden kaulan alueen massan diagnosointiin liittyviä haasteita. Paikalliset tulehdusoireet viittasivat infektioon, mutta systeemiset oireet herättivät epäilyn pahanlaatuisuudesta. Jälkikäteen voidaan väittää, että useat merkit ja laboratoriokokeet voisivat viitata tuberkuloosiin, kuten tulehdusoireet, antibioottiresistenssi, anemia ja hyponatremia. Samanaikainen invasiivisen rintasyövän diagnoosi oli satunnaislöydös. On kuitenkin perusteltua olettaa, että syöpä on saattanut myötävaikuttaa immunosenessenssiin, mikä on helpottanut piilevän tuberkuloosin uudelleenaktivoitumista.
Rahoitustuki
Rahoitustukea ei ollut.
Tekijöiden osuus
Kaikki kirjoittajat ovat osallistuneet tutkimukseen yhtä suurella osuudella.
- Gleeson M, Herbert A, Richards A (2000) Management of lateral neck masses in adults. BMJ 320: 1521-1524.
- Schwetschenau E, Kelley DJ (2002) The adult neck mass. Am Fam Physician 66: 831-838.
- Armstrong WB, Giglio MF (1998) Onko tästä kaulan kyhmystä syytä huolestua? Postgrad Med 104.
- Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.
- Barnes L (1996) Pathology of the head and neck: General considerations. (3rd edn), In: Myers EN, Suen JY, 17-32.
- Goffart, Y, Hamoir M, Deron P, Claes J, Remacle M (2005) Management of neck masses in adults. B-ENT 1: 133-140.
- Karem KL, Paddock CD, Regnery RL (2000) Bartonella henselae, B. quintana ja B. bacilliformis: historialliset patogeenit, joilla on uutta merkitystä. Microbes Infect 2: 1193-1205.
- Mccabe RE, Brooks RG, Dorfman RF, Remington JS (1987) Clinical spectrum in 107 cases of toxoplasmic lymphadenopathy. Rev Infect Dis 9: 754-774.
- Landau A, Reese DJ, Blumenthal DR, Chin NW (1990) Tophaceous neck mass presenting as a thyroglossal duct cyst. Arthritis Rheum 33: 910-911.
- Hytiroglou P, Brandwein MS, Strauchen JA, Mirante JP, Urken ML, et al. (1992) Inflammatory pseudotumor of the parapharyngeal space: case report and review of literature. Head Neck 14: 230-234.
- Armstrong WB, Allison G, Pena F, Kim JK (1998) Kimuran tauti: kaksi tapausselostusta ja kirjallisuuskatsaus. Ann Otol Rhinol Laryngol 107: 1066-1071.
- YI AY, deTar M, Becker TS, Rice DH (1995) Giant lymph node hyperplasia of the head and neck (Castlemanin tauti): raportti viidestä tapauksesta. Otolaryngol Head Neck Surg 113: 462-466.
- Shah Uk, White JA, Gooey JE, Hybels RL (1997) Otolaryngologic manifestations of sarcoidosis: Presentation and diagnosis. Laryngoscope 107: 67-75.
- Underhill T, Mcguirt F, Williams D (2000) Advances in imaging head and neck tumors. Current Opinion in Otolaryngology Head and Neck Surgery 8: 91-97.
- Ponnappan S, Ponnappan U (2011) Ikääntyminen ja immuunitoiminta: molekyylimekanismeista interventioihin. Antioxid Redox Signal 14: 1551-1585.
- Gruver AL, Hudson LL, Sempowski GD (2007) Immunosenescence of ageing. J Pathol 211: 144-156.
- Foster AD, Sivarapatna A, Gress RE (2012) The aging immune system and its relationship with cancer. Aging health 7: 707-718.
- Stervbo U, Meier S, Mälzer JN, Baron U, Bozzetti C, et al. (2015) Ikääntymisen vaikutukset ihmisen leukosyytteihin (osa I): synnynnäisten immuunisolujen immunofenotyypitys. Age (Dordr) 37: 92.
- Mcelhaney JE, Effros RB (2009) Immunosenescence: what does it mean to health outcomes in older adults? Curr Opin Immunol 21: 418-424.
- Gloeckler Ries LA, Reichman ME, Lewis DR, Hankey BF, Edwards BK (2003) Cancer survival and incidence from the Surveillance, Epidemiology, and End Results (SEER) program. Oncologist 8: 541-552.
- Finkel T, Serrano M, Blasco MA (2007) Syövän ja ikääntymisen yhteinen biologia. Nature 448: 767-774.
- Vasto S, Carruba G, Lio D, Colonna-Romano G, Di Bona D, et al. (2009) Inflammation, ageing and cancer. Mech Ageing Dev 130: 40-45.
- Gardner ID (1980) The effect of aging on susceptibility to infection. Rev Infect Dis 2: 801-810.
- Bellmann-Weiler R, Weiss G (2009) Iäkkäiden potilaiden infektioiden diagnosoinnin ja hoidon sudenkuopat–a mini-review. Gerontology 55: 241-249.
- LI J, Chung PH, Leung CLK, Nishikiori N, Chan EYY, et al. (2017) The strategic framework of tuberculosis control and prevention in the elderly: a scoping review towards End TB targets. Infect Dis Poverty 6: 70.
- Byng-Maddick R, Noursadeghi M (2016) Does tuberculosis threaten our ageing populations? BMC Infect Dis 16: 119.
- Negin J, Abimbola S, Marais BJ (2015) Tuberculosis among older adults–time to take notice. Int J Infect Dis 32: 135-137.
- Rajagopalan S (2001) Tuberculosis and aging: a global health problem. Clin Infect Dis 33: 1034-1039.
- Rajagopalan S (2016) Tuberculosis in Older Adults. Clin Geriatr Med 32: 479-491.
- Chan E (2006) Tuberculosis in the elderly: Keep a high index of suspicion. Journal of Respiratory Diseases 27: 307-315.
- Jeon CY, Murray MB (2008) Diabetes mellitus lisää aktiivisen tuberkuloosin riskiä: 13 havainnointitutkimuksen systemaattinen katsaus. PLoS Med 5: e152.
- Inghammar M, Ekbom A, Engström G, Ljungberg B, Romanus V, ym. (2010) COPD and the risk of tuberculosis–a population-based cohort study. PLoS One 5: e10138.
- Brode SK, Jamieson FB, Ng R, Campitelli MA, Kwong JC, ym. (2015) Reumalääkkeisiin liittyvä lisääntynyt mykobakteeri-infektioiden riski. Thorax 70: 677-682.
- Morris CD (1990) Pulmonary tuberculosis in the elderly: a different disease? Thorax 45: 912-913.
- Pérez-Guzmán C, Vargas MH, Torres-Cruz A, Villarreal-Velarde H (1999) Does aging modify pulmonary tuberculosis?: Meta-analyyttinen katsaus. Chest 116: 961-967.
- Dutt AK, Stead WW (1993) Tuberculosis in the elderly. Med Clin North Am 77: 1353-1368.
- Nagami Ph, Yoshikawa Tt (1983) Tuberculosis in the geriatric patient. J Am Geriatr Soc 31: 356-363.
- Kwon YS, Chi SY, Oh IJ, Kim KS, Kim YI, et al. (2013) Clinical characteristics and treatment outcomes of tuberculosis in the elderly: a case control study. BMC Infect Dis 13: 121.
- Thompson NJ, Glassroth JL, Snider DE Jr, Farer LS (1979) The booster phenomenon in serial tuberculin testing. Am Rev Respir Dis 119: 587-597.
- Borgdorff MW, Veen J, Kalisvaart NA, Nagelkerke N (1998) Tuberkuloosipotilaiden kuolleisuus Alankomaissa vuosina 1993-1995. Eur Respir J 11: 816-820.
Sitaatti
de Figueiredo IR, Alves RV, Castro SG, Lourenço F, Antunes AM, et al. (2019) A Submandibular Mass in an Elderly Patient. J Geriatr Med Gerontol 5:064. doi.org/10.23937/2469-5858/1510064