- Qu’est-ce que le lutécium
- Où trouve-t-on le lutétium
- Histoire
- Identification du lutécium
- Propriétés et caractéristiques du lutécium
- Propriétés générales
- Propriétés physiques
- Propriétés chimiques
- Données atomiques du lutécium (élément 71)
- À quoi sert-il
- Effets possibles sur la santé
- Faits intéressants
- Coût du lutécium
Qu’est-ce que le lutécium
Le lutécium (prononcé loo-TEE-shee-em) est un métal de terre rare argenté, dur et dense, classé parmi les lanthanides et représenté par le symbole chimique Lu . Il s’agit du dernier élément chimique appartenant à la série des lanthanides, dont l’isotope stable le plus abondant à l’état naturel est le 175Lu (97,4 % d’abondance). Un autre isotope radioactif à longue période 176Lu a une période de demi-vie de 3,78 X 1010 ans .

Lutetium Symbole
Où trouve-t-on le lutétium
Le lutétium, de la même manière que les autres lanthanides, est obtenu commercialement à partir du minéral monazite . Comme il est présent en petites quantités (environ 0,003 %) dans la monazite , son extraction peut être difficile et se fait par réduction du fluorure anhydre à l’aide de calcium métal . Bien que l’élément se trouve à l’état de traces dans presque tous les minéraux contenant de l’yttrium, ceux-ci peuvent être considérés comme des sources naturelles de lutécium. Les 3 principaux pays producteurs de lutécium sont la Chine, la Russie et la Malaisie, tandis que les 3 principaux pays détenteurs de réserves sont la Chine, les pays de la CEI et les États-Unis .

Lutetium
Histoire
Origine de son nom : Le nom de l’élément est dérivé du mot romain “Lutetia”, l’ancien nom de la ville française de Paris .
Qui l’a découvert : Bien que le chimiste français Georges Urbain, le chimiste américain Charles James et le scientifique autrichien Carl Auer von Welsbach aient découvert indépendamment l’élément, le mérite de la découverte revient à Urbain car il a été le premier à rapporter les résultats .
Quand et comment a-t-il été découvert
Le minéral gadolinite ou yttrium, découvert en 1794, a été la source de l’yttria, du terbia, de l’erbia et d’autres éléments de terres rares . Le chimiste suisse Jean Charles Marignac a séparé l’erbia en deux composants dont l’ytterbia et l’erbia, parmi lesquels l’ytterbia était considéré comme un composé de l’ytterbium .
En 1907, Georges Urbain lors d’une expérience à la Sorbonne à Paris a réussi à isoler l’ytterbium en deux éléments, qu’il a nommé lutécium et néoytterbium . Cependant, ces éléments ont ensuite été renommés respectivement lutécium et ytterbium par les chimistes. Carl Auer von Welsbach a séparé l’élément de l’ytterbium et l’a nommé cassipoium d’après la constellation circumpolaire Cassiopée . Charles James a également réussi à extraire l’élément à l’Université du New Hampshire .
Bien qu’il soit difficile à préparer, le lutécium métal pur a été produit en 1953 .
Identification du lutécium |
|||
| Numéro atomique | 71 | ||
| Numéro CAS | 7439-94-.3 | ||
| Position dans le tableau périodique | Groupe | Période | Bloc |
| Lanthanides | 6 | f | |

Localisation du lutécium dans le tableau périodique
Propriétés et caractéristiques du lutécium
Propriétés générales |
|||||||||||||||||||
| Masse atomique | 174.967 amu | ||||||||||||||||||
| Masse atomique relative | 174.967 | ||||||||||||||||||
Propriétés physiques |
|||||||||||||||||||
| Couleur | Blanc argenté | ||||||||||||||||||
| Point de fusion/point de congélation | 1663 °C, 3025 °F | ||||||||||||||||||
| Point d’ébullition | 3402 °C, 6156 °F | ||||||||||||||||||
| Densité | 9.84 g cm-3 | ||||||||||||||||||
| Etat de la matière à température ambiante (solide/liquide/gaz) | Solide | ||||||||||||||||||
| Dureté | |||||||||||||||||||
| – Brinell | 893 MPa | ||||||||||||||||||
| – Mohs | 2.6 | ||||||||||||||||||
| – Vickers | 1160 MPa | ||||||||||||||||||
| Conductivité électrique | 1.8X106 S/m | ||||||||||||||||||
| Conductivité thermique | 16 W/(m K) | ||||||||||||||||||
| Chaleur spécifique | 154 J kg-1 K-1 | ||||||||||||||||||
| Module d’élasticité | 47.6 GPa | ||||||||||||||||||
| Module de cisaillement | 27,2 GPa | ||||||||||||||||||
| Module de Young | 68.6 GPa | ||||||||||||||||||
| Pression de vapeur | |||||||||||||||||||
| – Température (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | ||||||||
| – Pression (Pa) | – | – | – | 3.28X 10-11 | 1,59X 10-7 | 6,79X 10-5 | 6,28X 10-3 | 0,211 | 3,18 | 26.7 | – | ||||||||
Propriétés chimiques |
|||||||||||||||||||
| États d’oxydation | 3 | ||||||||||||||||||
| Isotopes | Isotope | Masse | Abondance | Durée de vie | .vie | Mode de désintégration | |||||||||||||
| 175Lu | 174.941 | 97,40 | – | – | |||||||||||||||
| 176Lu | 175,943 | 2,60 | 3.73 X 1010 ans | β-
β+ EC |
|||||||||||||||
Données atomiques du lutécium (élément 71)
| Valence électrons | 3 | |||||||
| Nombres quantiques | 2D3/2 | |||||||
| Configuration des électrons (configuration des gaz rares) | 4f145d16s2. | |||||||
| Structure atomique | ||||||||
| – Nombre d’électrons | 71 | |||||||
| – Nombre de neutrons | 104 | |||||||
| – Nombre de protons | 71 | |||||||
| Radius de l’atome | ||||||||
| – Rayon atomique | 2.24 Å | |||||||
| – Rayon covalent | 1.74 Å | |||||||
| Electronégativité (échelle de Pauling) | 1.0 | |||||||
| Affinité électronique | 32.81 kJ mol-1 | |||||||
| Énergie d’ionisation (kJ mol-1) | 1ère | 2ème | 3ème | 4ème | 5ème | 6ème | 7ème | 8ème |
| 523.516 | 1341.1 | 2022.275 | 4365.96 | 6445.2 | – | – | – | |
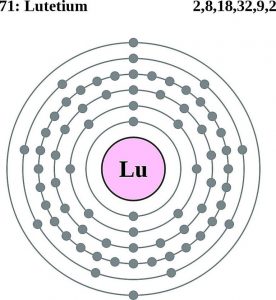
Configuration des électrons du lutécium (modèle de Bohr)
À quoi sert-il
Il a peu d’utilisation pratique en dehors de la recherche scientifique . Quelques utilisations commerciales du lutécium sont données ci-dessous :
- Il peut être utilisé comme catalyseur pour le craquage des produits pétroliers dans les raffineries de pétrole .
- La radio-immunothérapie avec le lutétium-177-dotatate est utilisée comme une forme de traitement du cancer tandis que le lutétium-176 est utilisé pour la datation radiométrique des météorites .
- L’oxyorthosilicate de lutécium est utilisé dans les détecteurs de TEP (tomographie par émission de positrons) pour effectuer un scanner médical afin de créer une image 3D de l’activité cellulaire dans le corps .
Effets possibles sur la santé
Le lutécium a une faible toxicité et aucune fonction biologique connue dans le corps humain ; bien qu’on pense qu’il puisse aider à stimuler le métabolisme. On pense également qu’il présente un risque d’explosion .
Faits intéressants
- Le lutécium est l’élément le plus dur et le plus dense du groupe des lanthanides .
- Il existe dans des composés généralement dans son état trivalent, Lu3+ .
- L’élément est parfois représenté visuellement par une image basée sur les armoiries de Paris .
Coût du lutécium
La forme pure du lutécium coûte environ 350 dollars par gramme , mais il coûte environ 7000 dollars par 100 grammes en vrac .
- http://www.rsc.org/periodic-table/element/71/lutetium
- https://education.jlab.org/itselemental/ele071.html
- https://www.livescience.com/38425-lutetium.html
- https://www.webelements.com/lutetium/isotopes.html
- https://www.chemicool.com/elements/lutetium.html
- http://periodictable.com/Elements/071/data.html
- http://web.newworldencyclopedia.org/entry/Lutetium
- https://hobart.k12.in.us/ksms/PeriodicTable/lutetium.htm