- Introducción
- Métodos
- Datos de distribución y clasificación de biomas
- Composición de especies entre biomas
- Datos de rasgos
- Medición de hipervolúmenes de rasgos
- Distinción funcional y dispersión
- Espacio funcional y similitud de biomas
- Resultados
- Discusión
- Carencias de conocimiento
- Patrones comunes dentro de los biomas
- Comparaciones entre biomas
- Conclusiones
- Disponibilidad de los datos
- Contribuciones de los autores
- Financiación
- Declaración de conflicto de intereses
- Agradecimientos
- Material suplementario
Introducción
Los ecólogos y biogeógrafos organizan la biodiversidad de las plantas terrestres en biomas determinados por el clima, con fisionomías caracterizadas por las formas de crecimiento y los rasgos funcionales de las especies dominantes (Moncrieff et al., 2016). De hecho, el concepto de bioma tiene una larga historia que se remonta a Carl Ludwig Willdenow y Alexander von Humboldt. Willdenow reconoció que climas similares soportan formas de vegetación similares, y Humboldt observó la amplia asociación entre la distribución de las plantas, la fisonomía y los factores ambientales. En general, el concepto de bioma refleja la suposición de que presiones ambientales similares seleccionan especies con atributos funcionales similares, independientemente de su historia evolutiva. Al mismo tiempo, los biomas existentes en la Tierra son hasta cierto punto filogenéticamente distintos, y muchas o la mayoría de las especies características proceden de linajes específicos que presentan adaptaciones clave no solo a la selección climática, sino a presiones adicionales como el fuego o los megaherbívoros (Woodward et al., 2004; Pennington et al., 2006; Donoghue y Edwards, 2014). Dado que los biomas representan regularidades a gran escala en la vegetación de la Tierra, comprender las diferencias funcionales entre los biomas es de vital importancia para modelar el ciclo global del carbono y el funcionamiento del sistema terrestre, incluidas las respuestas al cambio global antropogénico (Bonan et al., 2012; van Bodegom et al., 2014; Xia et al., 2015).
En las últimas dos décadas se ha producido un rápido crecimiento en la comprensión de la dimensión funcional de la biodiversidad vegetal a través de las escalas continentales (Swenson et al., 2012; Lamanna et al., 2014; Šímová et al., 2018). Amplios esfuerzos de síntesis y análisis de datos han definido un espacio limitado de rasgos funcionales que incorpora la variación en el tamaño general de la planta, la economía de las hojas y la hidráulica, conocidos como espectros de rasgos funcionales (Wright et al., 2004; Díaz et al., 2016). Los espectros de rasgos funcionales definen compensaciones fisiológicas y ecológicas que determinan las estrategias de historia de vida de las plantas (Westoby, 1998; Reich et al., 2003; Craine, 2009) y su influencia en el ensamblaje de la comunidad (Kraft et al., 2008), la función del ecosistema (Lavorel y Garnier, 2002; Garnier et al., 2004; Kerkhoff et al., 2005; Cornwell et al., 2008), e incluso las tasas de evolución (Smith y Donoghue, 2008; Smith y Beaulieu, 2009). La generalidad y utilidad de los espectros de rasgos funcionales de las plantas ha acelerado su incorporación a los modelos de distribución global de la vegetación (van Bodegom et al., 2014), el ciclo biogeoquímico (Bonan et al., 2012) y los servicios de los ecosistemas (Díaz et al., 2007; Cadotte et al., 2011; Lavorel et al., 2011). Sin embargo, son pocos los estudios que han examinado medidas exhaustivas de la diversidad funcional a escala del bioma entre las especies y formas de vida dominantes y subordinadas.
Existen dos conjuntos de predicciones contrastadas sobre cómo varía la diversidad funcional entre biomas climática y fisiográficamente distintos. Por un lado, si la biodiversidad de los biomas refleja la variación en el espacio de nicho ecológico disponible, los biomas menos diversos taxonómicamente deberían representar un subconjunto más pequeño y ampliamente anidado del espacio funcional ocupado por los biomas más diversos. Por otro lado, debido a la naturaleza global de las compensaciones fundamentales en la estructura y la función de las plantas, y a las presiones de selección similares que actúan de forma parecida en todas las especies, los conjuntos que ocupan diferentes entornos pueden, de hecho, compartir áreas similares del espacio de rasgos (Reich et al., 2003; Wright et al., 2004; Díaz et al., 2016). Estudios recientes confirman que las relaciones entre el clima y la diversidad funcional y taxonómica (es decir, la riqueza de especies) son complejas y dependen de la escala. En algunos casos, la diversidad funcional sigue de cerca los gradientes climáticos, con una menor diversidad funcional en condiciones más variables y extremas (Swenson et al., 2012; de la Riva et al., 2018), y el volumen del espacio funcional en los ensamblajes locales se expande con el aumento de la riqueza taxonómica (Lamanna et al., 2014; Li et al., 2018). Sin embargo, los análisis de los conjuntos de especies a escala regional sugieren que los grandes cambios en la riqueza de especies pueden estar asociados con impactos mínimos en la diversidad funcional (Lamanna et al., 2014; Šímová et al., 2015). Además, las respuestas de la diversidad taxonómica y funcional al clima pueden diferir entre las principales formas de crecimiento de las plantas (Šímová et al., 2018), y la diversidad relativa de las diferentes formas de crecimiento puede cambiar sustancialmente a lo largo de los gradientes climáticos que definen los diferentes biomas (Engemann et al., 2016).
Los avances en el análisis de la diversidad funcional a escala continental y global se han visto limitados en parte por la escasez de datos para catalogar los aspectos taxonómicos, distributivos, filogenéticos y funcionales de la biodiversidad (Hortal et al., 2015). Además, incluso teniendo en cuenta los limitados datos disponibles, existen importantes retos informáticos asociados a la estandarización e integración de grandes y dispares conjuntos de datos que describen las distribuciones geográficas, los rasgos funcionales y las relaciones filogenéticas de las especies (Violle et al., 2014). Aquí examinamos la distribución de la diversidad funcional de las especies de plantas a través de los biomas de América del Norte y del Sur utilizando la base de datos de la Red de Información Botánica y Ecología (BIEN; Enquist et al., 2016; Maitner et al., 2018), que reúne información sobre la distribución y los rasgos funcionales de >100.000 especies de plantas terrestres. Específicamente, examinamos la variación en la diversidad funcional y el carácter distintivo de los biomas, sobre la base de mapas de distribución de especies de plantas terrestres a una escala de celdas de cuadrícula de 100 × 100 km y un amplio conjunto de datos de seis rasgos funcionales que reflejan los principales ejes de variación en las estrategias ecológicas.
Nuestros objetivos en este estudio son 3. En primer lugar, para poner de manifiesto las persistentes carencias de datos, documentamos el alcance de los datos disponibles que caracterizan la diversidad funcional y el carácter distintivo de los biomas. En segundo lugar, teniendo en cuenta los datos disponibles, caracterizamos la distribución de la diversidad funcional dentro de los biomas entre las formas de crecimiento dominantes y subordinadas. Estos análisis nos permiten cuantificar mejor el carácter distintivo funcional de un bioma identificando las estrategias funcionales más comunes de las especies más extendidas en él. En tercer lugar, nos preguntamos si los biomas se caracterizan de hecho por colecciones de especies funcionalmente distintas, basadas en la superposición de hipervolúmenes multidimensionales en el espacio de rasgos funcionales.
Métodos
Datos de distribución y clasificación de biomas
Para reducir los efectos del sesgo de muestreo característico de los conjuntos de datos de ocurrencia compilados a partir de múltiples recursos, utilizamos los mapas de rango BIEN 2.0 para 88.417 de especies de plantas distribuidas en América del Norte y del Sur (Goldsmith et al., 2016). La base de datos BIEN integra observaciones estandarizadas de plantas provenientes de especímenes de herbario e inventarios de parcelas de vegetación. Los mapas de distribución de las especies en las bases de datos BIEN se estimaron utilizando uno de los tres enfoques, dependiendo de las ocurrencias disponibles para cada especie. Para las especies con sólo una o dos ocurrencias (c. 35% de las especies), el área de distribución geográfica se definió como un área cuadrada de 75.000 km2 alrededor de cada punto de datos. Las áreas de distribución de las especies con tres o cuatro apariciones se identificaron utilizando un casco convexo (c. 15% de las especies). Por último, los mapas de áreas de distribución para las especies con al menos cinco apariciones se obtuvieron utilizando el algoritmo de modelado de distribución de especies Maxent, utilizando 19 capas climáticas como variables predictoras y 19 eigenvectores espaciales como filtros para restringir las predicciones de los modelos (véase Goldsmith et al., 2016 para más detalles sobre la metodología de los mapas de áreas de distribución).
Superpusimos los mapas de especies de plantas de BIEN 2.0 en un mapa de cuadrícula de 100 × 100 km con una proyección de Área Igual Azimutal de Lambert para obtener una matriz de presencia/ausencia de especies para cada celda de la cuadrícula. Basándonos en la clasificación de biomas de Olson et al. (2001), asignamos cada celda de la matriz a una de las categorías de biomas. Debido a las limitaciones computacionales para los análisis subsecuentes, unimos algunos biomas basados en sus similitudes en clima y vegetación y en la literatura para obtener una clasificación amplia como se describe en la Tabla 1 (excluyendo Aguas Interiores, Rocas y Hielos y Manglares). Las ecorregiones del Chaco y la Caatinga fueron clasificadas como Bosques Xéricos y Bosques Secos, respectivamente, siguiendo a Prado y Gibbs (1993), Pennington et al. (2000), Banda et al. (2016), Silva de Miranda et al. (2018).
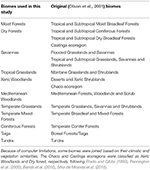
Tabla 1. Visión general de la clasificación de biomas adoptada en este estudio y la clasificación de biomas equivalente (Olson et al., 2001) (excluyendo aguas interiores, rocas y hielo, y manglares).
Composición de especies entre biomas
Para entender la variación en el espacio de rasgos funcionales entre biomas, primero exploramos las diferencias en la composición de especies vegetales entre ellos. Basándonos en la lista de especies de cada cuadrícula y bioma, definimos las especies características de cada bioma como aquellas que tienen la máxima proporción de su área de distribución en ese bioma. Estas listas de especies geográficamente predominantes en un determinado bioma se compararon con la lista de especies de otros biomas. Esta comparación por pares proporciona una forma sencilla de inferir un solapamiento taxonómico direccional entre biomas (es decir, la proporción de especies predominantes de un bioma compartida con otro bioma). De las 88.417 especies con mapas de área de distribución disponibles, 44.899 especies tienen áreas de distribución que abarcan más de un bioma, y 43.518 especies son endémicas de un bioma específico.
Datos de rasgos
Extrajimos toda la información de rasgos para las especies de plantas del Nuevo Mundo disponibles en el conjunto de datos BIEN 3.0 (recuperado el 7 de febrero de 2018) dando un total de 80.405 observaciones de rasgos a nivel de especies. Luego filtramos la información para seis rasgos funcionales: altura máxima de la planta (m), masa de la semilla (mg), densidad de la madera (mg/cm3), área específica de la hoja SLA (cm2/g) y concentración de fósforo y nitrógeno de la hoja por unidad de masa (mg/g). Tras el filtrado quedaron un total de 18.192 observaciones a nivel de especie. De éstas, el subconjunto de 8.820 especies con mapas de rango e información de rasgos se utilizó para los análisis posteriores.
Para estimar el espacio de rasgos funcionales para cada bioma, requerimos datos completos de rasgos. Por esta razón, imputamos filogenéticamente los datos de rasgos que faltaban (Bruggeman et al., 2009; Penone et al., 2014; Swenson, 2014; Swenson et al., 2017) utilizando el paquete R “Rphylopars” v 0.2.9 (Goolsby et al., 2017) y la filogenia de plantas de semilla recientemente publicada por Smith y Brown (2018) como línea de base. La imputación filogenética es una herramienta para predecir los datos que faltan en los conjuntos de datos de rasgos funcionales basada en la suposición de que las especies estrechamente relacionadas tienden a tener valores de rasgos similares (Swenson, 2014). Utilizamos el árbol ALLBM (es decir, el banco de genes y el árbol abierto de taxones de la vida con una columna vertebral proporcionada por Magallón et al., 2015) porque maximizaba el solapamiento entre las especies con información disponible sobre rasgos y distribución. Después de la imputación de rasgos, quedó un total de 7.842 especies con información completa de rasgos y mapas de distribución para su posterior análisis.
Medición de hipervolúmenes de rasgos
Medimos la diversidad funcional relativa de los biomas calculando los hipervolúmenes de rasgos de los grupos de especies dentro de las celdas de los biomas. Debido a las limitaciones computacionales, construimos los hipervolúmenes de rasgos utilizando una muestra aleatoria del 20% de las celdas de cada bioma. Los hipervolúmenes para cada celda de la cuadrícula se estimaron utilizando los seis rasgos funcionales extraídos y el paquete R “hypervolume” (Blonder et al., 2014, 2018), utilizando el método gaussiano KDE con el estimador de ancho de banda Silverman por defecto. La masa de semillas, la altura y la densidad de la madera se transformaron en logaritmos, mientras que la SLA se transformó en raíz cuadrada. Todos los rasgos fueron escalados y centrados antes del análisis. Los hipervolúmenes se informan en unidades de desviaciones estándar (sd) a la potencia del número de rasgos utilizados (es decir, sd6).
Distinción funcional y dispersión
Debido a que los biomas se caracterizan por su vegetación dominante, también examinamos la frecuencia geográfica y la distinción funcional de las especies dentro de los biomas. Utilizando mapas de rango de especies e información de rasgos funcionales, estimamos el carácter distintivo funcional y la generalización de cada especie en cada bioma, siguiendo el marco conceptual de rareza funcional de Violle et al. (2017). Utilizando todo el conjunto de rasgos (medidos e imputados), primero medimos la distancia euclidiana en el espacio de rasgos estandarizados entre todos los pares de especies. A continuación, calculamos la distinción funcional (Di) para cada especie en cada bioma como la distancia funcional media de una especie con respecto a las otras N especies dentro del conjunto de especies del bioma. Di se escaló entre 0 y 1 dentro de cada bioma, con valores más bajos que representan especies funcionalmente comunes (redundantes) y valores más altos que representan especies funcionalmente distintivas, en comparación con las otras especies del bioma. También estimamos la extensión geográfica (Wi) de una especie en un bioma, medida como el número de celdas de la cuadrícula ocupadas por la especie dentro de un bioma sobre el número total de celdas en ese bioma. Un valor de 1 indica que la especie focal está presente en todas las cuadrículas cubiertas por el bioma. Tanto la distintividad funcional como la difusión geográfica se calcularon utilizando el paquete R “funrar” (Grenié et al., 2017).
Debido a que carecemos de medidas exhaustivas de dominancia basadas en la abundancia o la biomasa local, utilizamos las medidas Di y Wi para identificar para cada bioma las especies más “comunes” como aquellas que están geográficamente extendidas (Wi > 0,5) y funcionalmente similares (Di < 0,25). Este último umbral se utilizó porque el tercer cuantil de los valores de distinción funcional entre biomas oscilaba entre 0,2 y 0,3. Por lo tanto, para distinguir las especies funcionalmente distintas de las funcionalmente similares en los análisis posteriores, utilizamos un valor de 0,25 como límite (es decir, especies con valores de distinción < 0,25 se consideraron funcionalmente comunes o redundantes dentro de un bioma específico).
Espacio funcional y similitud de biomas
Para estimar el solapamiento entre los hipervolúmenes de los biomas empleamos el índice de similitud de Sørensen utilizando (i) el número total de especies y (ii) la lista de especies consideradas funcionalmente comunes y geográficamente extendidas para cada bioma. La similitud del espacio de rasgos funcionales se calculó como el solapamiento fraccional por pares de los hipervolúmenes entre biomas. El solapamiento fraccional se calculó dividiendo el doble del volumen de la intersección de dos hipervolúmenes por el volumen de sus uniones. Todos los hipervolúmenes se estimaron utilizando el paquete R “hypervolume” (Blonder et al., 2014, 2018), utilizando el método KDE gaussiano con el estimador de ancho de banda Silverman por defecto.
Resultados
Encontramos un solapamiento sustancial en la composición de las especies de plantas a través de los biomas, basado en la intersección de los rangos de las especies modeladas (ver Figura 1, y Tabla Suplementaria 1). Este solapamiento taxonómico es mayor en los biomas tropicales y templados, con relativamente pocas especies compartidas entre estas dos zonas climáticas. Curiosamente, los bosques xéricos comparten especies tanto con los biomas tropicales como con los templados. A pesar de la elevada proporción de especies características del bosque húmedo tropical (83%), este bioma también comparte un gran número de especies con otros biomas tropicales como los bosques secos, las sabanas, los bosques xéricos y los pastizales tropicales. El elevado solapamiento taxonómico de los biomas templados, como los pastizales templados, los bosques mediterráneos, la taiga y la tundra, sugiere la posibilidad de una baja distinción funcional, ya que algunos biomas templados representan un subconjunto más pobre de los biomas tropicales, más ricos en especies y funcionalmente más diversos.
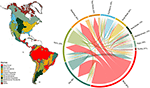
Figura 1. Superposición de especies vegetales entre biomas del Nuevo Mundo. Los valores porcentuales expresan la fracción de especies presentes en un bioma que tienen la mayor proporción de su área de distribución geográfica en ese bioma, N = 84.413. La base de cada flecha ramificada está posicionada para mostrar el bioma que incluye la mayor proporción del área de distribución de una especie, mientras que el ancho representa el número de especies compartidas con los biomas en las puntas de la flecha. Véase la Tabla Suplementaria 1 para la matriz subyacente.
Con menos del 10% de las especies mapeadas representadas, los datos de rasgos eran bastante escasos para nuestros conjuntos de especies a escala biológica (Figura 2A). Además, los datos de rasgos disponibles variaban sustancialmente entre rasgos, clados de plantas y biomas. Filogenéticamente, el P de la hoja y la densidad de la madera estaban particularmente mal representados, con clados enteros que carecían de datos disponibles. Como resultado, de los aproximadamente 2/3 de los valores de los rasgos de nuestras 7.842 especies que tuvieron que ser imputados, muchos tuvieron que ser asignados en ausencia de cualquier taxón estrechamente relacionado. Geográficamente, el SLA, la altura y la masa de semillas están insuficientemente muestreados en los trópicos y en la zona templada de Sudamérica, mientras que el N de la hoja y la densidad de la madera están muestreados de forma más uniforme entre las regiones. El P de la hoja está mal muestreado en todos los biomas. Los hipervolúmenes de rasgos creados a partir de grupos de especies de una selección aleatoria del 20% de las células para cada bioma muestran principalmente diferencias entre los biomas tropicales y los templados/fríos (Figura 2B). Los hipervolúmenes de rasgos tienden a ser mayores y más variables en los biomas tropicales, con la mayor variación en los bosques tropicales húmedos y secos. Entre los biomas templados/fríos, los bosques mixtos de coníferas y templados presentan los mayores hipervolúmenes de rasgos. Curiosamente, los matorrales xéricos muestran una distribución de hipervolúmenes más similar a la de los biomas tropicales que a la de los templados.
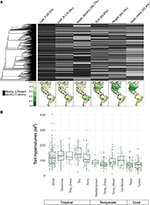
Figura 2. (A) Proporción de especies en la base de datos BIEN 3.0 con valores de rasgos conocidos (gris) o ausentes (negro). La filogenia de la izquierda corresponde al árbol ALLBM de plantas de semilla de Smith y Brown (2018) (es decir, taxones de GenBank y Open Tree of life con una columna vertebral proporcionada por Magallón et al., 2015). Los mapas representan la proporción de especies con información de rasgos en relación con el número total de especies en la base de datos BIEN 2.0. (B) Distribución de los hipervolúmenes de rasgos del 20% de las celdas de 100 × 100 km seleccionadas al azar en cada bioma. Los hipervolúmenes se presentan en unidades de desviaciones estándar a la potencia del número de rasgos utilizados.
La relación entre la distintividad funcional y la distribución geográfica es notablemente similar entre los biomas (Figura 3). En todos los biomas, la gran mayoría de las especies están restringidas geográficamente y son funcionalmente similares. Al mismo tiempo, las especies funcionalmente más distintivas dentro de cada bioma estaban generalmente restringidas geográficamente también, y las especies geográficamente más extendidas eran casi siempre funcionalmente similares.
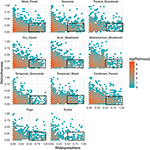
Figura 3. Patrones de distintividad funcional a través de los biomas. El carácter distintivo representa la distancia funcional de las especies entre sí dentro de un bioma (es decir, la distancia fenotípica media por pares de una especie focal a todas las demás). Cuanto mayor sea el valor, más alejada estará una especie del centro del espacio funcional del bioma. La dispersión mide la frecuencia geográfica de una especie en un bioma. Un valor de 0 indica que una especie está presente en una sola celda del bioma. Los valores de las casillas son el número de especies en una escala loge. Los rectángulos representan las especies que se consideran funcionalmente similares y extendidas en cada bioma utilizando valores de corte de 0,25 y 0,5 de distintividad y extensión, respectivamente.
Encontramos una variación considerable en la distribución proporcional de las formas de crecimiento dentro y entre biomas. Las especies leñosas representan las formas de crecimiento dominantes en los biomas tropicales en términos de número de especies, mientras que las especies herbáceas dominan en los ambientes templados (Figura 4). Cuando consideramos sólo las especies que están extendidas y son funcionalmente comunes en cada bioma, la distribución de las formas de crecimiento entre biomas cambió, especialmente en la proporción de árboles, hierbas y pastos. Por ejemplo, en los biomas tropicales, la proporción de árboles disminuyó en cada bioma, excepto en el bosque húmedo. En los biomas templados, la proporción de hierbas aumentó, especialmente hacia las regiones polares. Curiosamente, la distribución de las formas de crecimiento en los bosques xéricos se asemeja más a la distribución en los biomas templados cuando sólo se consideran las especies extendidas y funcionalmente comunes.
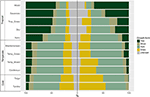
Figura 4. Distribución de las formas de crecimiento en cada bioma (a la izquierda) utilizando el número total de especies, y (a la derecha) utilizando sólo aquellas especies que son funcionalmente similares y están extendidas dentro del bioma (véase la Figura 3).
Las comparaciones por pares de la composición de las especies entre los biomas revelan tres grupos principales que representan las zonas climáticas tropicales, templadas y polares (Figura 5A), lo que refleja el alto solapamiento taxonómico dentro de estas regiones, pero no entre ellas (Figura 1). Las comparaciones por pares de los hipervolúmenes de rasgos entre biomas muestran una agrupación menos clara de las zonas climáticas (Figura 5B). En este caso, el espacio funcional de los bosques xéricos se solapa significativamente con los biomas templados. Este análisis también revela el solapamiento en el espacio funcional de las taigas con los pastizales templados y los bosques mixtos. La comparación por pares de los hipervolúmenes de rasgos entre biomas utilizando sólo las especies consideradas funcionalmente comunes y extendidas muestra un menor solapamiento en los espacios de rasgos entre y dentro de las zonas climáticas (Figura 5C). Sin embargo, aunque los bosques xéricos se agrupan ahora con el resto de biomas tropicales, estos hábitats, junto con los pastizales tropicales, muestran un gran solapamiento en el espacio funcional con biomas templados como los bosques mediterráneos y los pastizales templados.
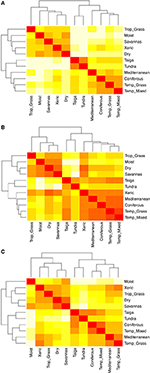
Figura 5. (A) Disimilitud por pares en la composición de especies entre biomas. (B) Disimilitud por pares en hipervolúmenes de rasgos (similitud de 1-Sørensen) entre biomas utilizando el número total de especies. (C) Disimilitud por pares en los hipervolúmenes de rasgos (similitud de 1-Sørensen) entre biomas utilizando sólo las especies que se consideran funcionalmente similares y extendidas. Cuanto más clara es la celda, mayor es la disimilitud.
Discusión
Nuestros análisis aportan tres ideas importantes para entender los biomas terrestres a través de una lente funcional. En primer lugar, mostramos que, a pesar de los avances en la recopilación y síntesis de datos primarios sobre biodiversidad, persisten importantes carencias de conocimiento que pueden limitar nuestra capacidad para cuantificar la biodiversidad funcional de los biomas a escala continental y global. En segundo lugar, nuestros análisis de los datos disponibles muestran, sin embargo, que todos los biomas de América del Norte y del Sur comparten un notable patrón común en el que las especies más extendidas geográficamente en cualquier bioma tienden a compartir rasgos funcionales comunes, mientras que las especies funcionalmente más distintivas están invariablemente restringidas en su distribución. En tercer lugar, cuando sólo se consideran las especies más extendidas y funcionalmente comunes, los biomas pueden distinguirse más fácilmente desde el punto de vista funcional, y los patrones de disimilitud entre biomas parecen reflejar una correspondencia entre el clima y el espacio de nicho funcional de las plantas. En conjunto, nuestros resultados sugieren que, si bien el estudio de la diversidad funcional de los biomas está todavía en sus etapas formativas, un mayor desarrollo del campo probablemente producirá conocimientos que vinculen la evolución, la biogeografía, el ensamblaje de la comunidad y la función del ecosistema.
Carencias de conocimiento
La base de datos BIEN está específicamente diseñada para cerrar las brechas en nuestro conocimiento de la biodiversidad de las plantas, sin embargo, como Hortal et al. (2015) señalan, las carencias de conocimiento que interactúan conducen a la incertidumbre en la cuantificación de la biodiversidad en las escalas más grandes. Por ejemplo, no solo menos del 10% de nuestras especies cartografiadas disponían tanto de datos de rasgos como de información filogenética, sino que los datos de rasgos que faltaban (~66% de los valores de rasgos de las especies) estaban bastante estructurados, tanto filogenética como geográficamente. Así, el déficit raunkiaeriano de datos de rasgos funcionales (sensu Hortal et al., 2015) interactúa con el déficit wallaceano de información distributiva y el déficit darwiniano de comprensión filogenética. Y aunque podemos utilizar el conocimiento filogenético para imputar razonablemente esos valores perdidos (Swenson et al., 2017), varios aspectos de los patrones resultantes que son importantes para la clasificación de los biomas siguen siendo inciertos. Por ejemplo, los datos existentes sobre la forma de crecimiento sugieren que las especies leñosas dominan en todos los biomas tropicales, mientras que la diversidad proporcional de las formas de crecimiento herbáceas es mucho mayor en los biomas templados y polares (véase también Engemann et al., 2016; Zanne et al., 2018). Este aumento latitudinal en la diversidad relativa de las plantas herbáceas, ¿refleja los sesgos de muestreo y la falta de conocimiento taxonómico sobre las plantas herbáceas tropicales, o refleja las diferentes historias evolutivas y biogeográficas en los reinos neárticos y neotropicales? Las formas de crecimiento dominantes son uno de los rasgos distintivos clave de los biomas, por lo que los cambios sistemáticos en las formas de crecimiento más diversas (ya sean dominantes o no) influirán necesariamente en nuestras predicciones sobre cómo podría cambiar la diversidad funcional a través de los biomas, y cómo esos cambios afectarán a la función y los servicios de los ecosistemas.
Utilizamos mapas de distribución de especies como datos de entrada principalmente para superar el innegable problema del sesgo de muestreo que es característico de los conjuntos de datos compilados a partir de múltiples fuentes (véase la Figura Suplementaria 1). Sin embargo, los mapas de áreas de distribución extraídos de modelos de distribución de especies podrían representar un elemento adicional de incertidumbre en nuestros resultados. Por ejemplo, dada la resolución geográfica de este estudio y la complejidad espacial de ciertos biomas, estos modelos podrían haber sobreestimado la extensión geográfica de algunas especies desde las celdas de un único bioma hasta las celdas de otros cercanos e interdigitados. El uso de los datos de ocurrencia no cambió los resultados generales de este estudio (véanse las figuras suplementarias 2-6); sin embargo, una ligera disminución del solapamiento funcional entre biomas podría revelar una sobreestimación de las áreas de distribución de algunas especies (véanse las figuras suplementarias 2, 5 y 6). El uso de la información sobre la presencia también cambió las relaciones generales entre el carácter distintivo funcional y la extensión en nuestros resultados, debido al sobremuestreo relativo de las regiones templadas frente a las tropicales (véase la Figura Suplementaria 4). En este caso, nuestra medida de difusión está limitada por el muestreo extremadamente limitado de la mayoría de las especies en los biomas tropicales. A medida que los conjuntos de datos y el muestreo mejoren, es probable que haya margen para reducir estas incertidumbres en el futuro.
La otra laguna de datos que debe abordarse para comprender la diversidad funcional de los biomas es el déficit prestoniano de información sobre la abundancia. La abundancia es especialmente importante en los estudios de diversidad funcional porque los rasgos que más importan para el ensamblaje de la comunidad, el funcionamiento del ecosistema y el ciclo biogeoquímico son los de las especies más dominantes. Debido a que basamos nuestros ensamblajes en mapas de rango derivados de modelos de distribución de especies, solo pudimos abordar el componente geográfico de la abundancia, pero la relación positiva entre la abundancia local y el rango geográfico, la llamada relación ocupación-abundancia, sugiere que las especies más extendidas en cada bioma pueden estar frecuentemente también entre las más abundantes (Borregaard y Rahbek, 2010; Novosolov et al., 2017). Dado que los biomas se caracterizan generalmente por las formas de crecimiento dominantes en la región, la integración de la información sobre la abundancia podría dar lugar a que los biomas muestren un menor solapamiento funcional. Sin embargo, aunque BIEN ha recopilado voluminosos datos de parcelas que permiten estimar la abundancia local, hacer comparaciones razonables entre diferentes regiones y formas de crecimiento se ve obstaculizado por el muestreo desigual, las diferencias regionales en la diversidad gamma y los métodos inconmensurables de cuantificación de la abundancia.
Patrones comunes dentro de los biomas
A pesar de las persistentes lagunas en los datos disponibles, nuestros análisis descubrieron una relación previamente no documentada y común a todos los biomas del hemisferio occidental: en cualquier bioma, las especies más extendidas también tienden a mostrar una baja distintividad funcional, mientras que las especies funcionalmente más distintivas están casi invariablemente restringidas en su distribución (Figura 3). Esta relación “ocupación-redundancia” puede sugerir que las condiciones climáticas predominantes en un bioma seleccionan un conjunto de características comunes, y que las especies funcionalmente más distintivas están restringidas a un subconjunto más raro de hábitats dentro del bioma. La prevalencia general de especies funcionalmente similares en todos los biomas y la relación “ocupación-redundancia” son coherentes con un reciente análisis global de la diversidad funcional a nivel de comunidad que sugiere que el filtrado del hábitat conduce a la coexistencia de especies funcionalmente similares (Li et al., 2018), así como con los estudios que muestran que las redundancias funcionales aumentan la estabilidad de la comunidad (por ejemplo, Walker et al., 1999; Pillar et al., 2013). Además, junto con el alto grado de solapamiento tanto taxonómico como funcional entre biomas (Figuras 1, 5), el hecho de que las especies comunes y extendidas sean funcionalmente similares refuerza la noción de que las plantas terrestres en una amplia gama de condiciones ambientales comparten características comunes cerca del núcleo del espectro de rasgos funcionales (Wright et al., 2004; Díaz et al., 2016). A diferencia de Umaña et al. (2017), nuestros resultados muestran que las especies raras y geográficamente restringidas pueden o no ser funcionalmente distintas de las especies más extendidas y comunes. Por lo tanto, sigue abierta la cuestión de si las especies más funcionalmente distintivas son especialistas en determinados entornos o si sus combinaciones de rasgos dan lugar a compensaciones demográficas o fisiológicas que limitan su distribución geográfica.
Comparaciones entre biomas
Nuestra comparación de las distribuciones de hipervolumen de rasgos entre biomas (Figura 2B) es coherente con la observación de que los entornos más ricos en especies son también más diversos funcionalmente (Swenson et al, 2012; Lamanna et al., 2014; Li et al., 2018; Šímová et al., 2018). Nuestros resultados son más equívocos en cuanto a la hipótesis de que los entornos climáticos estacionales y extremos limitan sistemáticamente la diversidad funcional de las especies (de la Riva et al., 2018). Todos los biomas tropicales muestran una mayor diversidad funcional media que todos los biomas templados, y los biomas polares sí muestran los hipervolúmenes más pequeños. Sin embargo, dentro de cada grupo, los biomas más secos o más variables estacionalmente no siempre muestran hipervolúmenes más pequeños (por ejemplo, bosques secos, bosques xéricos), como habríamos esperado siguiendo la hipótesis de tolerancia de Currie et al. (2004), mientras que las condiciones climáticas óptimas soportan más combinaciones de parámetros fisiológicos. Sólo a partir de estos resultados no podemos determinar si los biomas templados y polares son menos diversos desde el punto de vista taxonómico debido a los límites del espacio de nicho funcional, o si sus hipervolúmenes funcionales son pequeños porque no son taxonómicamente diversos. Los enfoques de modelos nulos podrían ayudar potencialmente a desentrañar la diversidad taxonómica y funcional (Swenson et al., 2012; Lamanna et al., 2014; Šímová et al., 2018), pero tal análisis estaba fuera del alcance de este estudio. Más importante aún, nuestros resultados refuerzan la importancia de comprender cómo la historia evolutiva y biogeográfica da forma a la diversidad funcional de los biomas (Woodward et al., 2004; Pennington et al., 2006; Donoghue y Edwards, 2014; Moncrieff et al., 2016). El amplio intercambio de especies (y linajes superiores) entre biomas dentro de diferentes reinos biogeográficos, pero en gran medida no entre ellos, podría servir tanto para homogeneizar la diversidad funcional dentro de los reinos como para proporcionar pistas sobre los rasgos característicos que se seleccionan a favor o en contra de los diferentes entornos (Douma et al., 2012; Zanne et al., 2014, 2018).
A pesar del sustancial solapamiento de hipervolúmenes entre todos los biomas (Figura Suplementaria 2), los biomas tropicales, templados y fríos parecen ocupar regiones distinguibles del espacio funcional (Figuras 5B,C). Los principales rasgos que diferencian a los biomas parecen ser rasgos relacionados con el tamaño total de la planta, incluyendo tanto la altura madura como la masa de las semillas (Figuras suplementarias 7-10), en lugar de rasgos económicos de las hojas, como se observó en análisis más locales, basados en parcelas (por ejemplo, Douma et al., 2012). La excepción es el P de la hoja, que mostró diferencias sustanciales entre los biomas tropicales y templados/polares (Figuras Suplementarias 7-10), un patrón que se ha observado en otros análisis basados tanto en valores específicos de la especie como en mediciones de todo el ecosistema (Kerkhoff et al., 2005; Swenson et al., 2012). Debido a que el P de la hoja fue nuestro rasgo más escasamente muestreado, las diferencias entre los reinos tropical y templado/polar podrían estar sujetas a sesgos del procedimiento de imputación. Sin embargo, el P de la hoja muestra una señal filogenética significativa (Kerkhoff et al., 2006), lo que sugiere que las imputaciones no deberían estar sesgadas (Swenson et al., 2017). El P de la hoja también es significativamente mayor en las formas de crecimiento herbáceas (Kerkhoff et al., 2006), por lo que el cambio latitudinal de la diversidad predominantemente leñosa a la herbácea (Figura 4) también puede influir en este patrón.
Cuando limitamos los análisis de hipervolumen a solo las especies más extendidas y funcionalmente comunes en cada bioma, los biomas individuales dentro de cada reino biogeográfico se superpusieron menos en el espacio de rasgos funcionales (compare las Figuras 5B,C), lo que sugiere que estas especies pueden reflejar fenotipos mejor adaptados a entornos particulares. En este contexto, el bioma del bosque xérico es especialmente interesante. En parte debido a la inclusión de la ecorregión del Chaco, los bosques xéricos se agrupan con los biomas tropicales taxonómicamente (Figura 5A). Pero cuando se consideran los hipervolúmenes funcionales de todas las especies, muestran una similitud mucho mayor con los biomas templados (Figura 5B). Por último, cuando sólo se analizan las especies más extendidas y funcionalmente comunes, los bosques xéricos vuelven a mostrar una mayor similitud con los biomas tropicales, pero también mantienen una alta similitud con los biomas templados de pastizales y mediterráneos (Figura 5C). Las transiciones de ambientes cálidos y mésicos a ambientes más fríos, secos y estacionales se ven facilitadas por rasgos similares, por ejemplo, el hábito herbáceo (Douma et al., 2012; Zanne et al., 2014, 2018), y al igual que los ambientes más fríos, las comunidades de los ambientes secos también tienden a estar más agrupadas filogenéticamente (Qian y Sandel, 2017). Además, la posición de las zonas xéricas en el límite de la zona de convergencia intertropical las convierte en una transición geográfica entre los reinos tropical y templado. El hecho de que los bosques xéricos sean intermedios entre los reinos tropical y templado tanto funcional como biogeográficamente refuerza aún más la idea de que para entender mejor la diversidad funcional de los biomas debemos tener en cuenta sus historias biogeográficas y filogenéticas (Pennington et al., 2006; Donoghue y Edwards, 2014; Moncrieff et al., 2016).
Conclusiones
Cualquier clasificación de los biomas terrestres impone un pequeño número de categorías discretas sobre gradientes continuos en el clima y la distribución de las especies, y por lo tanto representa una burda simplificación del complejo paisaje ecológico (Moncrieff et al., 2016, pero véase Silva de Miranda et al., 2018). Sin embargo, a pesar de su potencial para la simplificación excesiva, los biomas son construcciones útiles para organizar y comprender la biodiversidad y el funcionamiento de los principales ecosistemas terrestres de la Tierra, y los enfoques basados en los rasgos tienen un alto potencial para ayudar a modelar dinámicamente las distribuciones de la vegetación global.
En este estudio hemos demostrado que gran parte de la diversidad taxonómica de todos los biomas representa especies que están estrechamente distribuidas y funcionalmente similares. Además, dentro de los biomas, las especies funcionalmente más distintivas de cada bioma también tienden a ser geográficamente raras, mientras que las especies extendidas muestran uniformemente una baja distintividad funcional. A pesar del amplio solapamiento taxonómico y funcional entre los biomas, éstos se agrupan en unidades distinguibles, biogeográficas y climáticamente distintas, especialmente cuando la agrupación funcional se basa en las especies más extendidas y funcionalmente comunes en cada bioma. Sin embargo, avanzar en la comprensión funcional de los biomas requerirá no solo una mejor caracterización de la variación de rasgos dentro y entre los tipos de vegetación, sino también información sobre la historia biogeográfica y filogenética de los conjuntos de especies y la abundancia relativa de las especies dentro de los biomas.
Disponibilidad de los datos
Los conjuntos de datos de rasgos y los mapas de rango de especies analizados para este estudio se pueden descargar a través del paquete R BIEN (Maitner et al., 2018). Ver http://bien.nceas.ucsb.edu/bien/ para más detalles sobre la base de datos BIEN.
Contribuciones de los autores
SE-L, AK, BJE, DMN y CV diseñaron el estudio; SE-L y AK analizaron los datos; SE-L y AK escribieron la primera versión del manuscrito; CV, BB, NK, BSM, BM, RKP, BS, SS, J-CS y SKW contribuyeron a la recopilación y creación de la base de datos de rasgos y mapas de rango. Todos los autores contribuyeron al desarrollo y redacción del manuscrito.
Financiación
SE-L, DMN, y AK fueron apoyados por una beca de investigación en colaboración de la Fundación Nacional de Ciencias de los Estados Unidos (DEB-1556651). BJE recibió el apoyo de la Fundación Nacional de Ciencias DEB-1457812 y Macrosystems-1065861. CV recibió el apoyo del Consejo Europeo de Investigación (Grant ERC-StG-2014-639706-CONSTRAINTS) y de la Fundación Francesa para la Investigación de la Biodiversidad (FRB; www.fondationbiodiversite.fr) en el contexto del proyecto CESAB Causas y consecuencias de la rareza funcional desde la escala local a la global. J-CS considera este trabajo una contribución a su proyecto VILLUM Investigator Biodiversity Dynamics in a Changing World, financiado por VILLUM FONDEN (subvención 16549). SKW recibió el apoyo del Fondo de Inversión Científica Estratégica del Grupo de Ciencia e Innovación del Ministerio de Negocios, Innovación y Empleo de Nueva Zelanda.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Damos las gracias a Dan Griffith y a dos revisores por sus críticas constructivas que mejoraron considerablemente este manuscrito. También agradecemos a todos los contribuyentes de datos de BIEN (ver http://bien.nceas.ucsb.edu/bien/contribuidores de datos/ para una lista completa).
Material suplementario
El material suplementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fevo.2018.00219/full#supplementary-material
Banda, R.K., Delgado-Salinas, A., Dexter, K. G., Linares-Palomino, R., Oliveira-Filho, A., Prado, D., et al. (2016). Patrones de diversidad de plantas en los bosques secos neotropicales y sus implicaciones de conservación. Science 353, 1383-1387. doi: 10.1126/science.aaf5080
PubMed Abstract | CrossRef Full Text | Google Scholar
Blonder, B., Lamanna, C., Violle, C., and Enquist, B. J. (2014). El hipervolumen n-dimensional. Glob. Ecol. Biogeogr. 23, 595-609. doi: 10.1111/geb.12146
CrossRef Full Text | Google Scholar
Blonder, B., Morrow, C. B., Maitner, B., Harris, D. J., Lamanna, C., Violle, C., et al. (2018). Nuevos enfoques para delinear hipervolúmenes n-dimensionales. Methods Ecol. Evol. 9, 305-319. doi: 10.1111/2041-210X.12865
CrossRef Full Text | Google Scholar
Bonan, G. B., Oleson, K. W., Fisher, R. A., Lasslop, G., y Reichstein, M. (2012). Reconciliar los rasgos fisiológicos de la hoja y los datos de flujo del dosel: uso de las bases de datos TRY y FLUXNET en el Modelo Comunitario de la Tierra versión 4. J. Geophys. Res. Biogeosci. 117:G02026. doi: 10.1029/2011JG001913
CrossRef Full Text | Google Scholar
Borregaard, M. K., y Rahbek, C. (2010). Causalidad de la relación entre la distribución geográfica y la abundancia de especies. Q. Rev. Biol. 85, 3-25. doi: 10.1086/650265
PubMed Abstract | CrossRef Full Text | Google Scholar
Bruggeman, J., Heringa, J., y Brandt, B. W. (2009). PhyloPars: estimación de los valores de los parámetros que faltan utilizando la filogenia. Nucleic Acids Res. 37, W179-W184. doi: 10.1093/nar/gkp370
PubMed Abstract | CrossRef Full Text | Google Scholar
Cadotte, M. W., Carscadden, K., y Mirotchnick, N. (2011). Más allá de las especies: la diversidad funcional y el mantenimiento de los procesos y servicios ecológicos. J. Appl. Ecol. 48, 1079-1087. doi: 10.1111/j.1365-2664.2011.02048.x
CrossRef Full Text | Google Scholar
Cornwell, W. K., Cornelissen, J. H., Amatangelo, K., Dorrepaal, E., Eviner, V. T., Godoy, O., et al. (2008). Los rasgos de las especies vegetales son el control predominante de las tasas de descomposición de la hojarasca en los biomas de todo el mundo. Ecol. Lett. 11, 1065-1071. doi: 10.1111/j.1461-0248.2008.01219.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Craine, J. M. (2009). Resource Strategies of Wild Plants. New Jersey, NJ: Princeton University Press. doi: 10.1515/9781400830640
CrossRef Full Text | Google Scholar
Currie, D. J., Mittelbach, G. G., Cornell, H. V., Field, R., Guégan, J. F., Hawkins, B. A., et al. (2004). Predictions and tests of climate-based hypotheses of broad-scale variation in taxonomic richness. Ecol. Lett. 12, 1121-1134. doi: 10.1111/j.1461-0248.2004.00671.x
CrossRef Full Text | Google Scholar
de la Riva, E. G., Violle, C., Pérez-Ramos, I. M., Marañón, T., Navarro-Fernández, C. M., Olmo, M., et al. (2018). Un enfoque de rasgos funcionales multidimensionales revela la huella del estrés ambiental en Comunidades leñosas mediterráneas. Ecosystems 21, 248-262. doi: 10.1007/s10021-017-0147-7
CrossRef Full Text | Google Scholar
Díaz, S., Kattge, J., Cornelissen, J. H., Wright, I. J., Lavorel, S., Dray, S., et al. (2016). El espectro global de la forma y la función de las plantas. Nature 529, 167-171. doi: 10.1038/nature16489
PubMed Abstract | CrossRef Full Text | Google Scholar
Díaz, S., Lavorel, S., de Bello, F., Quétier, F., Grigulis, K., y Robson, T. M. (2007). Incorporación de los efectos de la diversidad funcional de las plantas en las evaluaciones de los servicios de los ecosistemas. Proc. Natl. Acad. Sci. U.S.A 104, 20684-20689. doi: 10.1073/pnas.0704716104
PubMed Abstract | CrossRef Full Text | Google Scholar
Donoghue, M. J., and Edwards, E. J. (2014). Cambios de bioma y evolución del nicho en las plantas. Annu. Rev. Ecol. Evol. Syst. 45, 547-572. doi: 10.1146/annurev-ecolsys-120213-091905
CrossRef Full Text | Google Scholar
Douma, J. C., Aerts, R., Witte, J. P. M., Bekker, R. M., Kunzmann, D., Metselaar, K., et al. (2012). A combination of functionally different plant traits provides a means to quantitatively predict a broad range of species assemblages in NW Europe. Ecography 35, 364-373. doi: 10.1111/j.1600-0587.2011.07068.x
CrossRef Full Text | Google Scholar
Engemann, K., Sandel, B., Enquist, B. J., Jørgensen, P. M., Kraft, N., Marcuse-Kubitza, A., et al. (2016). Patrones y conductores de la dominancia de grupos funcionales de plantas a través del hemisferio occidental: una reevaluación macroecológica basada en un conjunto de datos botánicos masivos. Bot. J. Linn. Soc. 180, 141-160. doi: 10.1111/boj.12362
CrossRef Full Text | Google Scholar
Enquist, B. J., Condit, R., Peet, R., Thiers, B., and Schildhauer, M. (2016). La red de información botánica y ecología (BIEN): ciberinfraestructura para una red de información botánica integrada para investigar los impactos ecológicos del cambio climático global en la biodiversidad vegetal. PeerJ Prepr. 4:e2615v2. doi: 10.7287/peerj.preprints.2615v2
CrossRef Full Text | Google Scholar
Garnier, E., Cortez, J., Billès, G., Navas, M. L., Roumet, C., Debussche, M., et al. (2004). Plant functional markers capture ecosystem properties during secondary succession. Ecology 85, 2630-2637. doi: 10.1890/03-0799
CrossRef Full Text | Google Scholar
Goldsmith, G. R., Morueta-Holme, N., Sandel, B., Fitz, E. D., Fitz, S. D., Boyle, B., et al. (2016). Plant-O-Matic: una guía dinámica y móvil de todas las plantas de América. Methods Ecol. Evol. 7, 960-965. doi: 10.1111/2041-210X.12548
CrossRef Full Text | Google Scholar
Goolsby, E. W., Bruggeman, J., y Ané, C. (2017). Rphylopars: métodos comparativos filogenéticos multivariados rápidos para datos faltantes y variación dentro de las especies. Methods Ecol. Evol. 8, 22-27. doi: 10.1111/2041-210X.12612
CrossRef Full Text | Google Scholar
Grenié, M., Denelle, P., Tucker, C. M., Munoz, F., and Violle, C. (2017). funrar: an R package to characterize functional rarity. Divers. Distrib. 23, 1365-1371. doi: 10.1111/ddi.12629
CrossRef Full Text | Google Scholar
Hortal, J., de Bello, F., Diniz-Filho, J. A. F., Lewinsohn, T. M., Lobo, J. M., and Ladle, R. J. (2015). Siete carencias que aquejan al conocimiento de la biodiversidad a gran escala. Annu. Rev. Ecol. Evol. Syst. 46, 523-549. doi: 10.1146/annurev-ecolsys-112414-054400
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Enquist, B. J., Elser, J. J., y Fagan, W. F. (2005). Plant allometry, stoichiometry and the temperature-dependence of primary productivity. Glob. Ecol. Biogeogr. 14, 585-598. doi: 10.1111/j.1466-822X.2005.00187.x
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Fagan, W. F., Elser, J. J., y Enquist, B. J. (2006). Variación filogenética y de forma de crecimiento en la escala de nitrógeno y fósforo en las plantas de semilla. Am. Nat. 168, E103-E122. doi: 10.1086/507879
PubMed Abstract | CrossRef Full Text | Google Scholar
Kraft, N. J., Valencia, R., y Ackerly, D. D. (2008). Functional traits and niche-based tree community assembly in an Amazonian forest. Science 322, 580-582. doi: 10.1126/science.1160662
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamanna, C., Blonder, B., Violle, C., Kraft, N. J., Sandel, B., et al. (2014). Espacio de rasgos funcionales y el gradiente de diversidad latitudinal. Proc. Natl. Acad. Sci. U.S.A. 111, 13745-13750. doi: 10.1073/pnas.1317722111
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavorel, S., y Garnier, E. (2002). Predicción de cambios en la composición de la comunidad y el funcionamiento del ecosistema a partir de los rasgos de las plantas: revisando el Santo Grial. Funct. Ecol. 16, 545-556. doi: 10.1046/j.1365-2435.2002.00664.x
CrossRef Full Text | Google Scholar
Lavorel, S., Grigulis, K., Lamarque, P., Colace, M.-P., Garden, D., Girel, J., et al. (2011). Using plant functional traits to understand the landscape distribution of multiple ecosystem services. J. Ecol. 99, 135-147. doi: 10.1111/j.1365-2745.2010.01753.x
CrossRef Full Text | Google Scholar
Li, Y., Shipley, B., Price, J. N., Dantas, V. de L., Tamme, R., Westoby, M., et al. (2018). El filtrado del hábitat determina la ocupación del nicho funcional de las comunidades de plantas en todo el mundo. J. Ecol. 106, 1001-1009. doi: 10.1111/1365-2745.12802
CrossRef Full Text | Google Scholar
Magallón, S., Gómez-Acevedo, S., Sánchez-Reyes, L. L., y Hernández-Hernández, T. (2015). Un árbol temporal metacalibrado documenta el aumento temprano de la diversidad filogenética de las plantas con flores. New Phytol. 207, 437-453. doi: 10.1111/nph.13264
PubMed Abstract | CrossRef Full Text | Google Scholar
Maitner, B. S., Boyle, B., Casler, N., Condit, R., Donoghue, J., Durán, S. M., et al. (2018). El paquete BIEN R: una herramienta para acceder a la base de datos de la red de información botánica y ecología (BIEN). Methods Ecol. Evol. 9, 373-379. doi: 10.1111/2041-210X.12861
CrossRef Full Text | Google Scholar
Moncrieff, G. R., Bond, W. J., y Higgins, S. I. (2016). Revisando el concepto de bioma para entender y predecir los impactos del cambio global. J. Biogeogr. 43, 863-873. doi: 10.1111/jbi.12701
CrossRef Full Text | Google Scholar
Novosolov, M., Rodda, G. H., North, A. C., Butchart, S. H. M., Tallowin, O. J. S., Gainsbury, A. M., et al. (2017). Relación densidad-rango de población revisada. Glob. Ecol. Biogeogr. 26, 1088-1097. doi: 10.1111/geb.12617
CrossRef Full Text | Google Scholar
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C., et al. (2001). Terrestrial Ecoregions of the world: a new map of life on earth: a new global map of terrestrial ecoregions provides an innovative tool for conserving biodiversity. Bioscience 51, 933-938.doi: 10.1641/0006-3568(2001)0512.0.CO;2
CrossRef Full Text | Google Scholar
Pennington, R. T., Prado, D. E., and Pendry, C. A. (2000). Neotropical seasonally dry forests and quaternary vegetation changes. J. Biogeogr. 27, 261-273. doi: 10.1046/j.1365-2699.2000.00397.x
CrossRef Full Text | Google Scholar
Pennington, R. T., Richardson, J. E., y Lavin, M. (2006). Insights into the historical construction of species-rich biomes from dated plant phylogenies, neutral ecological theory and phylogenetic community structure. New Phytol. 172, 605-616. doi: 10.1111/j.1469-8137.2006.01902.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Penone, C., Davidson, A. D., Shoemaker, K. T., Di Marco, M., Rondinini, C., Brooks, T. M., et al. (2014). Imputación de datos faltantes en conjuntos de datos de rasgos del ciclo vital: ¿qué enfoque es el mejor? Methods Ecol. Evol. 5, 961-970. doi: 10.1111/2041-210X.12232
CrossRef Full Text | Google Scholar
Pillar, V. D., Blanco, C. C., Müller, S. C., Sosinski, E. E., Joner, F., and Duarte, L. D. S. (2013). Redundancia funcional y estabilidad en comunidades vegetales. J. Veg. Sci. 24, 963-974. doi: 10.1111/jvs.12047
CrossRef Full Text | Google Scholar
Prado, D. E., y Gibbs, P. E. (1993). Patrones de distribución de especies en los bosques estacionales secos de Sudamérica. Ann. Mo. Bot. Gard. 80, 902-927. doi: 10.2307/2399937
CrossRef Full Text | Google Scholar
Qian, H., y Sandel, B. (2017). Estructura filogenética de los conjuntos regionales de angiospermas a través de gradientes latitudinales y climáticos en América del Norte. Glob. Ecol. Biogeogr. 26, 1258-1269. doi: 10.1111/geb.12634
CrossRef Full Text | Google Scholar
Reich, P. B., Wright, I. J., Cavender-Bares, J., Craine, J. M., Oleksyn, J., Westoby, M., et al. (2003). The evolution of plant functional variation: traits, spectra, and strategies. Int. J. Plant Sci. 164, S143-S164. doi: 10.1086/374368
CrossRef Full Text | Google Scholar
Silva de Miranda, P. L., Oliveira-Filho, A., Pennington, R. T., Neves, D. M., Baker, T. R., and Dexter, K. G. (2018). Uso de inventarios de especies arbóreas para mapear biomas y evaluar sus solapamientos climáticos en las tierras bajas tropicales de América del Sur. Glob. Ecol. Biogeogr. 27, 899-912. doi: 10.1111/geb.12749
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Kraft, N. J. B., Storch, D., Svenning, J.-C., Boyle, B., et al. (2015). Shifts in trait mean and variances in North American tree assemblages: species richness patterns are loosely related to the functional space. Ecography 38, 649-658. doi: 10.1111/ecog.00867
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Svenning, J.-C., Kattge, J., Engemann, K., Sandel, B., et al. (2018). Los patrones espaciales y las relaciones climáticas de los principales rasgos vegetales en el Nuevo Mundo difieren entre las especies leñosas y herbáceas. J. Biogeogr. 45, 895-916. doi: 10.1111/jbi.13171
CrossRef Full Text | Google Scholar
Smith, S. A., y Beaulieu, J. M. (2009). La historia de vida influye en las tasas de evolución del nicho climático en las plantas con flores. Proc. Biol. Sci. 276, 4345-4352. doi: 10.1098/rspb.2009.1176
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., y Brown, J. W. (2018). Construyendo una filogenia de plantas de semillas ampliamente inclusiva. Am. J. Bot. 105, 302-314. doi: 10.1002/ajb2.1019
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., y Donoghue, M. J. (2008). Las tasas de evolución molecular están vinculadas a la historia de la vida en las plantas con flores. Science 322, 86-89. doi: 10.1126/science.1163197
PubMed Abstract | CrossRef Full Text | Google Scholar
Swenson, N. G. (2014). Phylogenetic imputation of plant functional trait databases.Ecography 37, 105-110. doi: 10.1111/j.1600-0587.2013.00528.x
CrossRef Full Text
Swenson, N. G., Enquist, B. J., Pither, J., Kerkhoff, A. J., Boyle, B., Weiser, M. D., et al. (2012). La biogeografía y el filtrado de la diversidad funcional de las plantas leñosas en América del Norte y del Sur. Glob. Ecol. Biogeogr. 21, 798-808. doi: 10.1111/j.1466-8238.2011.00727.x
CrossRef Full Text | Google Scholar
Swenson, N. G., Weiser, M. D., Mao, L., Araújo, M. B., Diniz-Filho, J. A. F., Kollmann, J., et al. (2017). La filogenia y la predicción de la diversidad funcional de los árboles a través de nuevos escenarios continentales. Glob. Ecol. Biogeogr. 26, 553-562. doi: 10.1111/geb.12559
CrossRef Full Text | Google Scholar
Umaña, M. N., Mi, X., Cao, M., Enquist, B. J., Hao, Z., Howe, R., et al. (2017). El papel de la singularidad funcional y la agregación espacial en la explicación de la rareza en los árboles. Glob. Ecol. Biogeogr. 26, 777-786. doi: 10.1111/geb.12583
CrossRef Full Text | Google Scholar
van Bodegom, P. M., Douma, J. C., and Verheijen, L. M. (2014). Un enfoque totalmente basado en los rasgos para modelar la distribución global de la vegetación. Proc. Natl. Acad. Sci. U.S.A. 111, 13733-13738. doi: 10.1073/pnas.1304551110
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Reich, P. B., Pacala, S. W., Enquist, B. J., y Kattge, J. (2014). El surgimiento y la promesa de la biogeografía funcional. Proc. Natl. Acad. Sci. U.S.A. 111, 13690-13696. doi: 10.1073/pnas.1415442111
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Thuiller, W., Mouquet, N., Munoz, F., Kraft, N. J. B., Cadotte, M. W., et al. (2017). Rareza funcional: la ecología de los valores atípicos. Trends Ecol. Evol. 32, 356-367. doi: 10.1016/j.tree.2017.02.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, B., Kinzig, A., y Langridge, J. (1999). Diversidad de atributos de las plantas, resiliencia y función de los ecosistemas: la naturaleza y el significado de las especies dominantes y menores. Ecosystems 2, 95-113. doi: 10.1007/s100219900062
CrossRef Full Text | Google Scholar
Westoby, M. (1998). Un esquema de estrategia de ecología vegetal de altura de la hoja (LHS). Plant Soil 199, 213-227. doi: 10.1023/A:1004327224729
CrossRef Full Text | Google Scholar
Woodward, F. I., Lomas, M. R., y Kelly, C. K. (2004). Global climate and the distribution of plant biomes. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 359, 1465-1476. doi: 10.1098/rstb.2004.1525
PubMed Abstract | CrossRef Full Text | Google Scholar
Wright, I. J., Reich, P. B., Westoby, M., Ackerly, D. D., Baruch, Z., Bongers, F., et al. (2004). El espectro económico mundial de las hojas. Nature 428, 821-827. doi: 10.1038/nature02403
PubMed Abstract | CrossRef Full Text | Google Scholar
Xia, J., Niu, S., Ciais, P., Janssens, I. A., Chen, J., Ammann, C., et al. (2015). Control conjunto de la productividad primaria bruta terrestre por la fenología y la fisiología de las plantas. Proc. Natl. Acad. Sci. U.S.A. 112, 2788-2793. doi: 10.1073/pnas.1413090112
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Pearse, W. D., Cornwell, W. K., McGlinn, D. J., Wright, I. J., y Uyeda, J. C. (2018). Biogeografía funcional de las angiospermas: la vida en los extremos. New Phytol. 218, 1697-1709. doi: 10.1111/nph.15114
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Tank, D. C., Cornwell, W. K., Eastman, J. M., Smith, S. A., FitzJohn, R. G., et al. (2014). Tres claves de la radiación de las angiospermas en ambientes helados. Nature 506, 89-92. doi: 10.1038/nature12872
PubMed Abstract | CrossRef Full Text | Google Scholar