Introducción
La esclerosis lateral amiotrófica (ELA) es un trastorno progresivo caracterizado por la afectación de las motoneuronas superiores e inferiores (UMNs y LMNs). En la ELA, el desgaste muscular afecta preferentemente al abductor pollicis brevis (APB) y al primer interóseo dorsal, con una preservación relativa del abductor digiti minimi (ADM). Esta característica específica de la ELA se ha denominado signo de la “mano dividida” (Wilbourn, 2000). En general, la extensión de la pérdida de unidades motoras es significativamente mayor en el APB que en el ADM en pacientes con ELA (Kuwabara et al., 1999). Se ha propuesto que tanto los mecanismos corticales como los periféricos subyacen a los diferentes niveles de atrofia entre los músculos pequeños de la mano en la ELA (Weber et al., 2000; Shibuya et al., 2013). Los resultados de los estudios de estimulación magnética transcraneal han demostrado que la entrada corticomotoneuronal a las motoneuronas espinales que inervan el complejo thenar es más extensa en los participantes normales (Macdonell et al., 1999; Menon et al., 2014). Tal diferencia en las entradas podría causar que estas motoneuronas espinales degeneren preferentemente en la ELA a través de un mecanismo excitotóxico anterógrado transsináptico. Las proyecciones corticomotoneuronales al complejo thenar están afectadas preferentemente en la ELA, lo que sugiere que la disfunción corticomotoneuronal contribuye al signo de la mano partida en la ELA (Weber et al., 2000). Los estudios sobre la excitabilidad de los nervios periféricos han sugerido que los axones de las motoneuronas que inervan la APB son hiperexcitables y propensos a la degeneración en la ELA (Vucic y Kiernan, 2010; Shibuya et al., 2013). Sin embargo, hasta la fecha, hay pocos estudios que hayan comparado directamente la disfunción o la excitabilidad de las motoneuronas que inervan la APB y la ADM. La onda F es una respuesta tardía y de baja amplitud que refleja la activación antidrómica de las motoneuronas (Pastore-Olmedo et al., 2009). Las ondas F pueden proporcionar una medida independiente de la excitabilidad de las motoneuronas segmentarias (Fisher, 1992; Milanov, 1992; Hachisuka et al., 2015). El objetivo principal de este estudio fue examinar las diferencias en la disfunción entre las motoneuronas espinales que inervan la APB y la ADM en la ELA utilizando las ondas F.
Materiales y métodos
Participantes
Estudiamos a 40 pacientes con ELA esporádica y a 20 participantes normales de la misma edad y sexo. Todos los pacientes fueron atendidos en el Departamento de Neurología del Peking Union Medical College Hospital entre agosto de 2013 y junio de 2014. Los pacientes con ELA que cumplían los criterios modificados de El Escorial para una ELA definitiva, probable o con apoyo de laboratorio (Brooks et al., 2000) se inscribieron consecutivamente en el estudio. En estos pacientes se analizaron varios exámenes electrofisiológicos y características clínicas, como la edad en el momento de la inscripción y el tiempo desde el inicio de los síntomas. No se identificó ninguna mutación genética en ninguno de los pacientes con ELA. La afectación de la UMN en las extremidades superiores fue sugerida por la presencia de clonus, aumento del tono, reflejos tendinosos rápidos y signos de Hoffman positivos. Los pacientes con ELA fueron asignados a dos grupos en función de sus síntomas físicos. Los pacientes del grupo 1 (20 pacientes con ELA) tenían desgaste y debilidad de los músculos intrínsecos de la mano. Los pacientes del grupo 2 (20 pacientes con ELA) no presentaban desgaste ni debilidad de los músculos intrínsecos de la mano y mostraban un deterioro nulo o leve de los movimientos discretos de los dedos. Los datos de la mano más afectada se analizaron para los pacientes con ELA del grupo 1, mientras que los datos de la mano más intacta se analizaron para los pacientes con ELA del grupo 2. Los datos de la mano izquierda se analizaron para los controles normales (NC). Los pacientes con ELA se clasificaron clínicamente utilizando la escala de clasificación funcional de la ELA revisada (ALSFRS-R; Cedarbaum et al., 1999) y se clasificaron según el lugar de inicio de la enfermedad. Las características electrodiagnósticas de todos los pacientes con ELA eran consistentes con una degeneración difusa y progresiva de las células del asta anterior. En el momento de la investigación, ninguno de los pacientes estaba tomando riluzol u otros fármacos antiespásticos. Se excluyeron los participantes con síndrome del túnel carpiano o cubital coincidente según el examen clínico y los estudios de conducción nerviosa. Todos los sujetos dieron su consentimiento informado por escrito para participar en la investigación. El estudio fue aprobado por el Comité de Ética de Investigación Clínica del Hospital del Colegio Médico de la Unión de Pekín (Pekín, China), y todos los procedimientos se llevaron a cabo de acuerdo con la Declaración de Helsinki.
Estudio de conducción nerviosa
Las pruebas electrofisiológicas se realizaron utilizando un sistema de electromiografía (EEG) Viking IV (Nicolet Biomedical, Madison, WI, EE.UU.). Se registraron los potenciales de acción muscular compuestos (CMAP) de los músculos APB y ADM tras la estimulación del nervio mediano o cubital en la muñeca. La temperatura de la piel de las extremidades estudiadas se mantuvo a >32°C. Se midieron la latencia motora distal (LMD), la amplitud CMAP pico a pico, la velocidad de conducción motora (VCM) y la relación de amplitud CMAP ADM/APB.
Estudio de las ondas F
Todos los sujetos estuvieron en posición supina y relajados durante los experimentos. Las ondas F de los nervios mediano y cubital se registraron con electrodos de superficie fijados a la piel sobre los músculos APB y ADM. Los nervios estudiados se estimularon mediante la entrega de 100 estímulos supramaximales con una frecuencia de 1 Hz en un sitio que estaba 7 cm proximal al electrodo de registro activo con el cátodo proximal al ánodo. Se consideró que un total de 100 estímulos era apropiado para explorar todo el potencial de las ondas F (Fisher et al., 1994). Los ajustes del filtro fueron de 20 Hz a 10 kHz, la velocidad de barrido fue de 5 ms por división y la ganancia del amplificador fue de 0,5 mV por división. Las ondas A, que se definieron como respuestas tardías idénticas con latencias constantes que ocurrían en al menos 8 de 20 trazos, se excluyeron del estudio de las ondas F (Puksa et al., 2003). Se analizaron los siguientes parámetros de las ondas F: latencia mínima, latencia media, latencia máxima, persistencia de las ondas F, amplitud media, relación media de amplitud F/M y número de ondas F repetidas. La amplitud pico a pico de una onda F se midió si la amplitud era de al menos 40 μV. La relación de amplitud media F/M se calculó dividiendo la amplitud media de la onda F por la correspondiente amplitud máxima CMAP. Una neurona repetidora (RN) era una neurona que daba lugar a una serie de ondas F con latencias, amplitudes y formas idénticas, y estas ondas F se definían como ondas F repetidoras. Los RN y las ondas F repetidoras se detectaron mediante inspección visual y se superpusieron manualmente a las demás ondas F repetidoras. Las ondas F repetidoras se midieron utilizando los siguientes índices: índice RN = 100 × número de RN/número de trazos con diferentes formas de ondas F en una serie de 100 estímulos; índice de ondas F repetidoras (Freps) = 100 × número de ondas F repetidoras/número total de trazos con ondas F en el mismo nervio (Chroni et al., 2012).
Análisis estadísticos
Se utilizó la prueba de Shapiro-Wilk para evaluar la normalidad de los datos. Cuando el valor P en el análisis de la varianza alcanzó la significación, se realizó la prueba de Student-Newman-Keuls. Para evaluar las diferencias entre dos grupos se utilizó la prueba t de muestras independientes. En el caso de los datos no paramétricos, las comparaciones entre grupos se realizaron mediante la prueba H de Kruskal-Wallis. Una vez rechazada la hipótesis nula, las comparaciones por pares de los grupos se probaron mediante la prueba U de Mann-Whitney y la corrección de Bonferroni con un nivel de significación de P < 0,017. Las diferencias en las variables categóricas se examinaron mediante la prueba de Chi-cuadrado. La significación estadística se fijó en P < 0,05. Se utilizó SPSS para Windows, versión 21.0 (SPSS, Inc., Chicago, IL, EE.UU.), para realizar los análisis estadísticos.
Resultados
Los perfiles clínicos de los pacientes con ELA y de los participantes con NC se resumen en la Tabla 1. Todos los pacientes con ELA tenían predominio clínico del LMN. La edad en el momento del examen, la proporción de sexos y la altura eran comparables en los tres grupos. Entre los pacientes con ELA, la enfermedad de inicio en las extremidades superiores representaba el 70% de los pacientes del grupo 1 y el 25% de los pacientes del grupo 2. Había 11 pacientes con ELA en el grupo 1 y 10 en el grupo 2 con dos regiones corporales afectadas, y había 9 pacientes generalizados en el grupo 1 y 10 en el grupo 2. La duración de la enfermedad y las puntuaciones de la ALSFRS-R no diferían significativamente entre los pacientes con ELA de los grupos 1 y 2.

Tabla 1. Perfiles clínicos de los participantes.
La tabla 2 muestra los resultados del estudio de conducción nerviosa para los pacientes con ELA y los CN. La relación de amplitud ADM/APB CMAP estaba significativamente aumentada en los pacientes con ELA del grupo 1 en comparación con el grupo NC, lo que se observó de forma coherente con el signo de la mano partida en los pacientes con ELA (Kuwabara et al., 2008). Los resultados del estudio de la onda F para los pacientes con ELA y los NC se muestran en la Tabla 3. La amplitud media de las ondas F para la APB fue significativamente menor en el grupo 1 que en el grupo 2, que fueron comparables entre el grupo 2 y los NC. Las amplitudes medias de las ondas F de la ADM en los grupos 1 y 2 fueron significativamente mayores en comparación con las de los NC. Las relaciones de amplitud F/M de la APB y la ADM en el grupo 1 fueron significativamente mayores que las del grupo 2 y las NC, mientras que el grupo 2 y las NC mostraron relaciones de amplitud F/M similares. La persistencia de la onda F de la APB, que fue significativamente menor en los pacientes con ELA que en los NC, fue comparable entre los grupos 1 y 2. La persistencia de la onda F de la ADM fue significativamente menor en el grupo 1 que en el grupo 2 y los NC, mientras que la persistencia de la onda F de la ADM fue similar entre el grupo 2 y los NC. El índice RN y el índice Freps de la APB aumentaron significativamente en los grupos 1 y 2 en comparación con los NC, pero estos índices fueron comparables entre los grupos 1 y 2. El índice RN y el índice Freps de la ADM fueron significativamente mayores en el grupo 1 que en el grupo 2 y los NC, mientras que el grupo 2 y los NC mostraron valores similares para estos índices. La figura 1 presenta ejemplos representativos de trazados de ondas F para los nervios mediano y cubital registrados en pacientes con ELA de los grupos 1, 2 y NCs.

Tabla 2. Resultados del estudio de conducción nerviosa.

Tabla 3. Estudio de las ondas F en los pacientes con ELA y en los controles normales.

Figura 1. Ejemplos representativos de las ondas F registradas en los pacientes con esclerosis lateral amiotrófica (ELA) y en los controles normales (NC). (A) Ondas F registradas en la mano de un paciente con ELA que presenta desgaste y debilidad. Se observó una reducción de la persistencia de las ondas F y un aumento del número de ondas F repetidoras en las ondas F registradas de los nervios mediano y cubital. (B) Ondas F registradas a partir de una mano de un paciente con ELA que carece de desgaste o debilidad detectables. La persistencia de las ondas F se redujo y el número de ondas F repetidas aumentó en el nervio mediano, mientras que los parámetros de las ondas F registradas en el nervio cubital fueron relativamente normales. (C) Ondas F registradas en un sujeto sano en la extremidad superior izquierda. Las amplitudes, latencias y formas de onda de las ondas F eran variables, y la persistencia de las ondas F era normal tanto en el nervio mediano como en el cubital. Las letras a la derecha del registro identifican las ondas F repetidas en función de la amplitud, la latencia y la forma de onda. Las calibraciones son de 0,5 mV y 5 ms para el registro de la onda F.
La tabla 4 muestra el rendimiento diagnóstico de la onda F en la ELA frente a las CN. La onda F podría utilizarse para ayudar a diferenciar a los pacientes con ELA de los NC. El índice RN y el índice Freps de la APB parecieron ser variables fiables para diferenciar a los pacientes con ELA de los CN, ya que el área bajo la curva (AUC) para el índice RN (0,998, intervalo de confianza (IC) del 95%: 0,937-1,000) y el índice Freps (1,000, IC del 95%: 0,940-1,000) mostraron una utilidad diagnóstica “muy buena”. El resto de las variables de las ondas F tuvieron valores AUC más bajos que el RN índice y los Freps índice de la APB y, por tanto, mostraron una menor utilidad diagnóstica. El cociente de amplitud ADM/APB CMAP mostró un AUC de 0,766 (IC del 95%: 0,638-0,865, P < 0,001) y pudo diferenciar moderadamente a los pacientes con ELA de los NC. El uso de un valor de corte de ADM/APB > 1,7 (Kim et al., 2015) para diagnosticar la ELA arrojó una sensibilidad moderada (52,5%) y una especificidad alta (85,0%) en comparación con los controles. La persistencia de la onda F (P = 0,002), el índice RN (P < 0,001) y el índice Freps (P < 0,001) en la APB parecieron diferenciar a los pacientes con ELA de los NC de forma más sólida que la relación de amplitud CMAP ADM/APB.
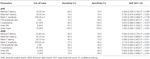
Tabla 4. Rendimiento diagnóstico de la onda F en la esclerosis lateral amiotrófica (ELA) frente a los controles normales (NC).
Discusión
El objetivo principal de este estudio era utilizar las medidas de la onda F para determinar las diferencias de disfunción entre las motoneuronas APB y ADM en pacientes con ELA. Según un sistema de estadificación propuesto para la ELA (Roche et al., 2012), los estadios de la enfermedad eran comparables entre los grupos 1 y 2. La diferencia en el porcentaje de aparición de las extremidades superiores entre los grupos 1 y 2 puede subyacer a un patrón diferente de progresión de la enfermedad entre los dos grupos. El número estimado de unidades motoras y las amplitudes CMAP son parámetros útiles para evaluar la pérdida de motoneuronas, mientras que la onda F puede ser una sonda directa de disfunción o inestabilidad en las células del asta anterior (Hachisuka et al., 2015). La persistencia de la onda F está relacionada con el número de NML y la excitabilidad de las motoneuronas (Schiller y Stalberg, 1978; de Carvalho et al., 2002; Argyriou et al., 2006). Los mecanismos propuestos que subyacen a las ondas F repetitivas son el aumento de la excitabilidad en determinadas células del asta anterior, la disminución de la excitabilidad en algunas motoneuronas o la pérdida de motoneuronas (Schiller y Stalberg, 1978; Petajan, 1985; Peioglou-Harmoussi et al., 1987; Hachisuka et al., 2015). A medida que se pierden las motoneuronas, las ondas F de repetición de las motoneuronas individuales pueden ser reconocidas más fácilmente; sin embargo, se ha argumentado que la baja frecuencia de backfiring de las motoneuronas individuales hace que el mecanismo sea bastante improbable (Chroni et al., 2012). Desde el punto de vista fisiológico, hubo diferencias significativas en la persistencia de las ondas F y en el número de ondas F repetidas entre la APB y la ADM. Estos hallazgos pueden estar asociados a un menor número de motoneuronas funcionales que inervan la APB (Gooch et al., 2014), o a una mayor modulación inhibitoria cortical de la APB (Menon et al., 2014).
En la ELA, la disfunción de las motoneuronas espinales se desarrolla gradualmente antes de la aparición de los síntomas manifiestos (Bradley, 1987). En el presente estudio, los pacientes con ELA que carecían de desgaste o debilidad detectables en las manos mostraron una persistencia de la onda F significativamente reducida y valores de índice RN e índice Freps más altos para la APB en comparación con los de los NC. Además, estos pacientes con ELA mostraron valores de ondas F relativamente normales en la ADM. Estos datos son consistentes con una disfunción preferente de las motoneuronas espinales que inervan la APB en la ELA (Baumann et al., 2012). En la ELA, sin embargo, las motoneuronas espinales que inervan la APB pueden ser más activas que las que inervan la ADM, y la amplitud de la CMAP puede no tener suficiente sensibilidad para detectar la pérdida de motoneuronas porque las motoneuronas restantes pueden proporcionar una reinervación colateral compensatoria de las fibras musculares denervadas (van Dijk et al., 2010). El análisis de las ondas F, especialmente de las ondas F en los nervios medianos, podría ayudar a detectar alteraciones sutiles de las células del asta anterior incluso en pacientes con ELA sin síntomas clínicos y, por lo tanto, puede proporcionar un enfoque útil para evaluar la progresión de la enfermedad.
Se ha demostrado que el daño en el NMN reduce la amplitud de las ondas F (Fisher, 1992). La atrofia muscular puede conducir a una respuesta muscular más débil al neutralizar parcialmente la hiperexcitabilidad del conjunto de motoneuronas (Drory et al., 1993). En el presente estudio, los pacientes con ELA que presentaron el signo de la mano dividida mostraron amplitudes de ondas F significativamente reducidas, persistencia de ondas F reducida y un mayor número de ondas F repetidas en la APB en comparación con la ADM, lo que probablemente refleja un daño más grave en las motoneuronas espinales que inervan la APB. La formación de grandes unidades motoras post-reinervación podría contribuir al aumento de la amplitud de las ondas F (Drory et al., 2001). Una amplitud de onda F significativamente mayor en la ADM en comparación con la APB en los pacientes con ELA es consistente con una pérdida más lenta de motoneuronas en el grupo de motoneuronas de la ADM (Baumann et al., 2012). La relación de amplitud F/M cuantifica la proporción del conjunto de motoneuronas que se activa durante una serie de ondas F (Drory et al., 2001). La relación de amplitud F/M significativamente mayor en la APB comparada con la de la ADM de los pacientes con ELA refleja una mayor tendencia de las motoneuronas que inervan la APB a generar ondas F. Por el contrario, la combinación de la disminución de la amplitud media de las ondas F y el aumento de la relación de amplitud F/M en la APB enfatiza la implicación preferente de la APB en la ELA. Las ondas F repetitivas indican cambios patológicos en las unidades motoras (Hachisuka et al., 2015). El aumento significativo en el número de ondas F repetidoras en la APB puede implicar un mayor grado de hiperexcitabilidad dentro de las motoneuronas espinales que inervan la APB (Fang et al., 2015).
Intrigantemente, los pacientes con ELA que carecían de atrofia muscular detectable en la mano mostraron una amplitud media de ondas F para la APB que fue significativamente mayor que la de los pacientes con ELA que presentaron el signo de la mano dividida. Sin embargo, la amplitud media de la onda F para la ADM fue comparable entre los dos grupos de pacientes con ELA, independientemente de la atrofia muscular de la mano, pero fue significativamente más alta en los pacientes con ELA que en los NC. Las diferencias en las características de las ondas F entre la APB y la ADM pueden atribuirse a los efectos contrapuestos de la degeneración y la regeneración dentro de la unidad motora. Con la degeneración de las motoneuronas, las motoneuronas supervivientes compensan reinervando las fibras musculares denervadas a través del brote axonal (Ibrahim y el-Abd, 1997). En la ELA, el proceso de denervación puede comenzar antes y progresar más rápidamente en la región thenar. La tasa de degeneración fue más lenta en las motoneuronas que inervan la ADM que en las que inervan la APB. Son necesarios más estudios para dilucidar los mecanismos en la ELA que contribuyen a las diferencias en la disfunción de las motoneuronas entre las que inervan la APB y la ADM. Sospechamos que los mecanismos corticales, los mecanismos axonales periféricos o la disfunción segmentaria espinal, particularmente en los circuitos inhibitorios espinales, podrían contribuir a la degeneración preferencial de las motoneuronas espinales que inervan la APB (Turner y Kiernan, 2012; Ramírez-Jarquín et al., 2014).
Investigaciones anteriores demostraron que el signo de la mano dividida se observa con mayor frecuencia en la ELA, y el aumento de la relación de amplitud de la ADM/APB CMAP es casi específico de la ELA. El presente estudio demostró que el criterio neurofisiológico para la ADM/APB de una relación de amplitud CMAP >1,7 (Kuwabara et al., 2008) tiene una sensibilidad moderada y una especificidad alta para diferenciar la ELA de las CN, lo que coincide con estudios anteriores (Kim et al., 2015). En este estudio, los parámetros de las ondas F podrían ayudar a diferenciar de forma fiable a los pacientes con ELA de los participantes normales. Además, la persistencia de la onda F, el índice RN y el índice Freps en la APB podrían diferenciar de forma fiable a los pacientes con ELA de los NC, ya que estas medidas mostraron valores AUC más grandes que la relación de amplitud ADM/APB CMAP.
Nuestro análisis tiene varias limitaciones. Se trata de un estudio transversal, y se incluyó un número relativamente pequeño de participantes. Es necesario un estudio de seguimiento con una población más grande para determinar específicamente el alcance de la disfunción espinal asociada al signo de la mano partida en la ELA. Otra limitación potencial es la falta de un grupo de control de pacientes que consiste en pacientes con síndromes que imitan la ELA. Dicho grupo sería útil para evaluar el valor clínico de la onda F para discriminar la ELA de los trastornos que imitan la ELA. Además, deberían realizarse más estudios electrofisiológicos que utilicen los métodos para evaluar la disfunción de la UMN, así como la excitabilidad de los axones motores, en los mismos grupos de pacientes para arrojar más luz sobre la fisiopatología de este fenómeno.
En conclusión, nuestros hallazgos demuestran diferencias en las características de las ondas F entre la APB y la ADM en pacientes con ELA. Estas alteraciones en las ondas F son características de los pacientes con ELA y pueden ser útiles para diferenciar la ELA de ciertos trastornos que imitan la ELA. La elucidación de los mecanismos fisiopatológicos que subyacen a los diferentes niveles de atrofia en los músculos pequeños de la mano arrojaría luz sobre la patogénesis de la ELA.
Contribuciones de los autores
JF y LC: concibieron, realizaron y diseñaron los experimentos. JF, LC, ML e YG: analizaron los datos. ML, YG, XL, DL, BC, DS y QD: aportaron reactivos/materiales/herramientas de análisis. JF y LC: contribuyeron a la redacción del manuscrito.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Deseamos dar las gracias a los pacientes con ELA y a los voluntarios sanos que participaron en este estudio.
Argyriou, A. A., Polychronopoulos, P., Talelli, P., y Chroni, E. (2006). F-wave study in amyotrophic lateral sclerosis: assessment of balance between upper and lower motor neuron involvement. Clin. Neurophysiol. 117, 1260-1265. doi: 10.1016/j.clinph.2006.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Baumann, F., Henderson, R. D., Gareth Ridall, P., Pettitt, A. N., y McCombe, P. A. (2012). Estudios cuantitativos de la degeneración de las neuronas motoras inferiores en la esclerosis lateral amiotrófica: evidencia de la decadencia exponencial del número de unidades motoras y la mayor tasa de pérdida en el sitio de inicio. Clin. Neurophysiol. 123, 2092-2098. doi: 10.1016/j.clinph.2012.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bradley, W. G. (1987). Puntos de vista recientes sobre la esclerosis lateral amiotrófica con énfasis en los estudios electrofisiológicos. Muscle Nerve 10, 490-502. doi: 10.1002/mus.880100603
PubMed Abstract | CrossRef Full Text | Google Scholar
Brooks, B. R., Miller, R. G., Swash, M., y Munsat, T. L. (2000). El escorial revisado criterios para el diagnóstico de la esclerosis lateral amiotrófica. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 1, 293-299. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedarbaum, J. M., Stambler, N., Malta, E., Fuller, C., Hilt, D., Thurmond, B., et al. (1999). The ALSFRS-R a revised ALS functional rating scale that incorporates assessments of respiratory function. J. Neurol. Sci. 169, 13-21. doi: 10.1016/s0022-510x(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Chroni, E., Tendero, I. S., Punga, A. R., and Stålberg, E. (2012). Utilidad de la evaluación de las ondas F de repetición en los estudios de rutina. Muscle Nerve 45, 477-485. doi: 10.1002/mus.22333
PubMed Abstract | CrossRef Full Text | Google Scholar
de Carvalho, M., Scotto, M., Lopes, A., y Swash, M. (2002). F-waves and the corticospinal lesion in amyotrophic lateral sclerosis. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 3, 131-136. doi: 10.1080/146608202760834139
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Kovach, I., and Groozman, G. B. (2001). Electrophysiologic evaluation of upper motor neuron involvement in amyotrophic lateral sclerosis. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 2, 147-152. doi: 10.1080/146608201753275616
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Neufeld, M. Y., y Korczyn, A. D. (1993). F-wave characteristics following acute and chronic upper motor neuron leisions. Electromyogr. Clin. Neurophysiol. 33, 441-446.
PubMed Abstract | Google Scholar
Fang, J., Cui, L.-Y., Liu, M.-S., Guan, Y.-Z., Li, X.-G., Cui, B., et al. (2015). Estudio de las ondas F en la esclerosis lateral amiotrófica: evaluación de la disfunción motoneuronal segmentaria. Chin. Med. J. 128, 1738-1742. doi: 10.4103/0366-6999.159346
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A. (1992). Reflejos H y ondas F: fisiología e indicaciones clínicas. Muscle Nerve 15, 1223-1233. doi: 10.1002/mus.880151102
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A., Hoffen, B., y Hultman, C. (1994). Valores normativos de las ondas F y el número de ondas F registradas. Muscle Nerve 17, 1185-1189. doi: 10.1002/mus.880171009
PubMed Abstract | CrossRef Full Text | Google Scholar
Gooch, C. L., Doherty, T. J., Chan, K. M., Bromberg, M. B., Lewis, R. A., Stashuk, D. W., et al. (2014). Estimación del número de unidades motoras: una tecnología y revisión de la literatura. Muscle Nerve 50, 884-893. doi: 10.1002/mus.24442
PubMed Abstract | CrossRef Full Text | Google Scholar
Hachisuka, A., Komori, T., Abe, T., y Hachisuka, K. (2015). Las ondas F repetitivas son signos de patología de la unidad motora en los supervivientes de la poliomielitis. Muscle Nerve 51, 680-685. doi: 10.1002/mus.24428
PubMed Abstract | CrossRef Full Text | Google Scholar
Ibrahim, I. K., y el-Abd, M. A. (1997). Onda F de repetición gigante en pacientes con trastornos de las células del cuerno anterior. Role of motor unit size. Am. J. Phys. Med. Rehabil. 76, 281-287. doi: 10.1097/00002060-199707000-00006
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J.-E., Hong, Y.-H., Lee, J.-H., Ahn, S.-W., Kim, S.-M., Park, K.-S., et al. (2015). Diferencia de patrón de atrofia muscular disociada de la mano en la esclerosis lateral amiotrófica y variantes. Muscle Nerve 51, 333-337. doi: 10.1002/mus.24323
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Mizobuchi, K., Ogawara, K., y Hattori, T. (1999). Afectación disociada de los músculos pequeños de la mano en la esclerosis lateral amiotrófica detectada por estimaciones del número de unidades motoras. Muscle Nerve 22, 870-873. doi: 10.1002/(sici)1097-4598(199907)22:7<870::aid-mus9>3.0.co;2-o
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Sonoo, M., Komori, T., Shimizu, T., Hirashima, F., Inaba, A., et al. (2008). Dissociated small hand muscle atrophy in amyotrophic lateral sclerosis: frequency, extent and specificity. Muscle Nerve 37, 426-430. doi: 10.1002/mus.20949
PubMed Abstract | CrossRef Full Text | Google Scholar
Macdonell, R. A. L., Jackson, G. D., Curatolo, J. M., Abbott, D. F., Berkovic, S. F., Carey, L. M., et al. (1999). Motor cortex localization using functional MRI and transcranial magnetic stimulation. Neurology 53, 1462-1467. doi: 10.1212/wnl.53.7.1462
PubMed Abstract | CrossRef Full Text | Google Scholar
Menon, P., Kiernan, M. C., and Vucic, S. (2014). Las diferencias de excitabilidad cortical en los músculos de la mano siguen un patrón de mano dividida en controles sanos. Muscle Nerve 49, 836-844. doi: 10.1002/mus.24072
PubMed Abstract | CrossRef Full Text | Google Scholar
Milanov, I. G. (1992). F-wave for assessment of segmental motoneurone excitability. Electromyogr. Clin. Neurophysiol. 32, 11-15.
PubMed Abstract | Google Scholar
Pastore-Olmedo, C., Gonzáez, O., y Geijo-Barrientosc, E. (2009). Estudio de las ondas F en pacientes con radiculopatía lumbosacra unilateral. Eur. J. Neurol. 16, 1233-1239. doi: 10.1111/j.1468-1331.2009.02764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Peioglou-Harmoussi, S., Fawcett, P. R. W., Howel, D., and Barwick, D. D. (1987). F-response frequency in motor neuron disease and cervical spondylosis. J. Neurol. Neurosurg. Psychiatry 50, 593-599. doi: 10.1136/jnnp.50.5.593
PubMed Abstract | CrossRef Full Text | Google Scholar
Petajan, J. H. (1985). F-waves in neurogenic atrophy. Muscle Nerve 8, 690-696. doi: 10.1002/mus.880080811
PubMed Abstract | CrossRef Full Text | Google Scholar
Puksa, L., Stålberg, E., y Falck, B. (2003). Ocurrencia de ondas A en estudios de ondas F de nervios sanos. Muscle Nerve 28, 626-629. doi: 10.1002/mus.10448
PubMed Abstract | CrossRef Full Text | Google Scholar
Ramírez-Jarquín, U. N., Lazo-Gómez, R., Tovar-y-Romo, L. B., and Tapia, R. (2014). Circuitos inhibitorios espinales y su papel en la degeneración de la motoneurona. Neuropharmacology 82, 101-107. doi: 10.1016/j.neuropharm.2013.10.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Roche, J. C., Rojas-Garcia, R., Scott, K. M., Scotton, W., Ellis, C. E., Burman, R., et al. (2012). Una propuesta de sistema de estadificación para la esclerosis lateral amiotrófica. Brain 135, 847-852. doi: 10.1093/brain/awr351
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, H. H., y Stalberg, E. (1978). Respuestas F estudiadas con EMG de fibra única en sujetos normales y pacientes espásticos. J. Neurol. Neurosurg. Psychiatry 41, 45-53. doi: 10.1136/jnnp.41.1.45
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibuya, K., Misawa, S., Nasu, S., Sekiguchi, Y., Mitsuma, S., Beppu, M., et al. (2013). Split hand syndrome in amyotrophic lateral sclerosis: different excitability changes in the thenar and hypothenar motor axons. J. Neurol. Neurosurg. Psychiatry 84, 969-972. doi: 10.1136/jnnp-2012-304109
PubMed Abstract | CrossRef Full Text | Google Scholar
Turner, M. R., and Kiernan, M. C. (2012). Contribuye la disfunción interneuronal a la neurodegeneración en la esclerosis lateral amiotrófica. Amyotroph. Lateral Scler. 13, 245-250. doi: 10.3109/17482968.2011.636050
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dijk, J. P., Schelhaas, H. J., Van Schaik, I. N., Janssen, H. M. H. A., Stegeman, D. F., and Zwarts, M. J. (2010). Monitoring disease progression using high-density motor unit number estimation in amyotrophic lateral sclerosis. Muscle Nerve 42, 239-244. doi: 10.1002/mus.21680
PubMed Abstract | CrossRef Full Text | Google Scholar
Vucic, S., and Kiernan, M. C. (2010). La regulación de las conductancias de sodio persistentes en la ELA familiar. J. Neurol. Neurosurg. Psychiatry 81, 222-227. doi: 10.1136/jnnp.2009.183079
PubMed Abstract | CrossRef Full Text | Google Scholar
Weber, M., Eisen, A., Stewart, H., and Hirota, N. (2000). La mano dividida en la ELA tiene una base cortical. J. Neurol. Sci. 180, 66-70. doi: 10.1016/s0022-510x(00)00430-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilbourn, A. J. (2000). El síndrome de la mano dividida. Muscle Nerve 23:138. doi: 10.1002/(sici)1097-4598(200001)23:1<138::aid-mus22>3.0.co;2-7
PubMed Abstract | CrossRef Full Text | Google Scholar