Evaluación |Biopsicología |Comparativa |Cognitiva |Desarrollo |Lenguaje |Diferencias individuales |Personalidad |Filosofía |Social |
Métodos |Estadística |Clínica |Educativa |Industrial |Política mundial |
Biológica:Genética del comportamiento – Psicología evolutiva – Neuroanatomía – Neuroquímica – Neuroendocrinología – Neurociencia – Psiconeuroinmunología – Psicología fisiológica – Psicofarmacología(Índice, Esquema)
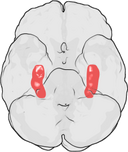
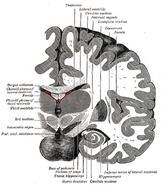
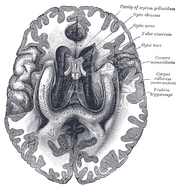
La ubicación del hipocampo en el cerebro humano.
Para la revista del mismo nombre, véase Hippocampus (revista)
El hipocampo es una parte del cerebro anterior, situada en el lóbulo temporal medial. Pertenece al sistema límbico y desempeña un papel importante en la memoria a largo plazo y la navegación espacial. Los humanos y otros mamíferos tienen dos hipocampos, uno en cada lado del cerebro. En los roedores, que es donde más se ha estudiado, el hipocampo tiene forma de plátano. En los humanos, tiene una forma curvada y enrevesada que a los primeros anatomistas les recordaba a un caballito de mar. El nombre, de hecho, deriva de la palabra griega para caballito de mar (griego: hippos = caballo, campos = mar).
En la enfermedad de Alzheimer, el hipocampo es una de las primeras regiones del cerebro que sufre daños; los problemas de memoria y la desorientación aparecen entre los primeros síntomas. Los daños en el hipocampo también pueden ser consecuencia de la falta de oxígeno (anoxia), la encefalitis o la epilepsia del lóbulo temporal mesial. Las personas con daños extensos en el hipocampo pueden experimentar amnesia, es decir, incapacidad para formar o retener nuevos recuerdos.
Funciones del hipocampo
Tal vez la primera idea fue que el hipocampo está implicado en el olfato: esto parece haber sido sugerido principalmente por su ubicación en el cerebro, junto a la corteza olfativa. Sigue habiendo cierto interés en las respuestas olfativas del hipocampo, pero ahora casi nadie cree que la función principal del hipocampo sea la olfativa.
A lo largo de los años, tres ideas principales sobre la función del hipocampo han dominado la literatura: inhibición, memoria y espacio. La teoría de la inhibición conductual (caricaturizada por O’Keefe y Nadel como “¡pisa el freno!”) fue muy popular hasta la década de 1960. Derivó gran parte de su fuerza de dos observaciones: en primer lugar, los animales con daños en el hipocampo tienden a ser hiperactivos; en segundo lugar, los animales con daños en el hipocampo suelen tener dificultades para aprender a inhibir respuestas que se les han enseñado previamente. Jeffrey Gray desarrolló esta línea de pensamiento hasta convertirla en una teoría completa sobre el papel del hipocampo en la ansiedad. Sin embargo, la teoría de la inhibición no es muy popular en la actualidad.
La segunda línea de pensamiento importante relaciona el hipocampo con la memoria. Aunque tuvo precursores, esta idea derivó su principal fuerza de un informe muy conocido de Scoville y Milner sobre los resultados de la destrucción quirúrgica del hipocampo (en un intento de aliviar los ataques epilépticos), en un paciente conocido como H.M. El resultado inesperado fue una amnesia severa: H.M. fue incapaz de recordar conscientemente los eventos que ocurrieron después de su cirugía o durante varios años antes de ella. Este caso suscitó un interés tan enorme que se dice que H.M. es el caso médico más estudiado de la historia. En los años siguientes, también se han estudiado otros pacientes con niveles similares de daño en el hipocampo y amnesia (causada por accidente o enfermedad), y se han realizado literalmente miles de experimentos para estudiar la fisiología de la plasticidad neuronal en el hipocampo. En la actualidad existe un acuerdo casi universal de que el hipocampo desempeña algún tipo de papel importante en la memoria; sin embargo, la naturaleza precisa de este papel sigue siendo ampliamente debatida.
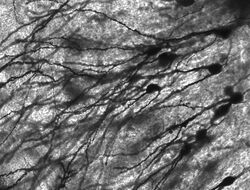
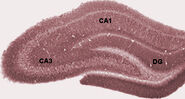
Neuronas teñidas de goli en el hipocampo de los roedores.
Papel en la memoria
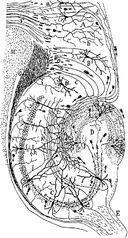
Dibujo del circuito neuronal del hipocampo de los roedores. S. Ramón y Cajal, 1911.
Los psicólogos y neurocientíficos discuten el papel exacto del hipocampo, pero en general están de acuerdo en que tiene un papel esencial en la formación de nuevos recuerdos sobre acontecimientos experimentados personalmente (memoria episódica o autobiográfica). Algunos investigadores prefieren considerar el hipocampo como parte de un sistema de memoria más amplio del lóbulo temporal medial, responsable de la memoria declarativa general (recuerdos que pueden ser verbalizados explícitamente; esto incluiría, por ejemplo, la memoria de hechos además de la memoria episódica).
Artículo principal: Función del hipocampo en la memoria
Algunas pruebas implican al hipocampo en el almacenamiento y procesamiento de la información espacial. Los estudios en ratas han demostrado que las neuronas del hipocampo tienen campos de disparo espaciales. Estas células se denominan células de lugar. Algunas células se disparan cuando el animal se encuentra en un lugar concreto, independientemente de la dirección del viaje, mientras que la mayoría son sensibles, al menos parcialmente, a la dirección de la cabeza y a la dirección del viaje.
Artículo principal: Papel del hipocampo en la memoria espacial y la navegación
Hipocampo y depresión
- Se ha identificado una pérdida de volumen del hipocampo, que tal vez refleje los efectos del exceso de glucocorticoides en
la neurogénesis en grupos de personas deprimidas en comparación con los controles.
Artículo principal: La depresión y el hipocampo
Historia
El anatomista Giulio Cesare Aranzi (hacia 1564) utilizó por primera vez el término hipocampo para describir el órgano cerebral por su parecido visual con un caballito de mar. Este órgano se relacionó inicialmente con el sentido del olfato, más que con su conocida función de adquisición de la memoria. El ruso Vladimir Bekhterev señaló el papel del hipocampo en la memoria hacia 1900, basándose en las observaciones de un paciente con profundas alteraciones de la memoria. Sin embargo, durante muchos años, la visión convencional del hipocampo era que, al igual que el resto del sistema límbico, era responsable de la emoción.
La importancia del hipocampo en la memoria fue señalada a los investigadores por el paciente HM. HM sufría una serie de alteraciones de la memoria anterógrada y retrógrada de grado temporal (dichas alteraciones son el tema de la película Memento) tras la extirpación bilateral de varias estructuras del lóbulo medio-temporal (incluyendo la ablación bilateral de su hipocampo) para aliviar los frecuentes ataques epilépticos. Es especialmente importante que HM siguiera siendo capaz de aprender tareas procedimentales (asociadas al estriado) y tuviera un coeficiente intelectual superior a la media. HM demostró una sorprendente disociación entre la inteligencia y la memoria declarativa. El tamaño relativo de la formación del hipocampo en relación con el volumen total del cerebro suele conservarse en la mayoría de las especies de mamíferos. Sin embargo, se ha encontrado que estas áreas son relativamente hipotróficas en los cetáceos.
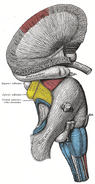
Anatomía
Artículo principal: Anatomía del hipocampo
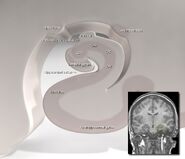
Hipocampo humano.
Sección coronal teñida con Nissl del cerebro de un mono macaco, mostrando el hipocampo (rodeado). Fuente: brainmaps.org
Anatómicamente, el hipocampo es una elaboración del borde del córtex. Puede distinguirse como una zona en la que la corteza se estrecha en una sola capa de neuronas muy densas, que se enrosca en forma de S apretada. Las estructuras que se alinean en el borde del córtex constituyen el llamado sistema límbico (latín limbus = borde): incluyen el hipocampo, el córtex cingulado, el córtex olfativo y la amígdala. Paul MacLean sugirió una vez, como parte de su teoría del cerebro triuno, que las estructuras límbicas comprenden la base neural de la emoción. Sin embargo, la mayoría de los neurocientíficos ya no creen que el concepto de un “sistema límbico” unificado sea válido.
El hipocampo, en su conjunto, acaba pareciéndose a un tubo curvado, que ha sido analizado de diversas maneras como un caballito de mar, o un cuerno de carnero (Cornu Ammonis), o un plátano.Esta disposición general se mantiene en toda la gama de especies de mamíferos, desde el erizo hasta el ser humano, aunque los detalles varían. En la rata, los dos hipocampos se parecen sorprendentemente a un par de plátanos, unidos por el tallo. En los cerebros de los humanos o de los monos, la parte del hipocampo situada en la parte inferior, cerca de la base del lóbulo temporal, es mucho más ancha que la parte superior. Una de las consecuencias de esta compleja geometría es que los cortes transversales del hipocampo pueden mostrar una desconcertante variedad de formas, dependiendo del ángulo y la ubicación del corte.
Las conexiones más fuertes del hipocampo son con la corteza entorrinal (CE), que se encuentra junto a él en el lóbulo temporal. Las capas superficiales del CE proporcionan las entradas más numerosas al hipocampo, y las capas profundas del CE reciben las salidas más numerosas. El CE, a su vez, está fuertemente conectado, y de forma recíproca, con muchas otras partes del córtex. El hipocampo también recibe una proyección muy importante del área septal medial. La destrucción del área septal suprime el ritmo theta del hipocampo y deteriora gravemente ciertos tipos de memoria. (Se cree que las llamadas drogas de “violación” ejercen sus efectos amnésicos, al menos en parte, al antagonizar la proyección colinérgica del septo medial al hipocampo.)
Fisiología
Muestras del EEG del hipocampo de rata y de la actividad neural de la CA1 en los modos theta (despierto/comportamiento) y LIA (sueño de onda lenta). Cada gráfico muestra 20 segundos de datos, con un trazado de EEG del hipocampo en la parte superior, trazados de picos de 40 células piramidales CA1 registradas simultáneamente en el centro (cada línea de trazado representa una célula diferente), y un gráfico de la velocidad de carrera en la parte inferior. El gráfico superior representa un periodo de tiempo durante el cual la rata buscaba activamente las bolitas de comida dispersas. Para el gráfico inferior, la rata estaba dormida.
El hipocampo muestra dos “modos” principales de actividad, cada uno de ellos asociado a un patrón distinto de ondas de EEG y de actividad de la población neural.Estos modos reciben el nombre de los patrones de EEG asociados a ellos: theta y actividad irregular grande (LIA). Estas son algunas de sus principales características en la rata, el animal que más se ha estudiado:
El modo theta aparece durante los estados de comportamiento activo y alerta (especialmente la locomoción), y también durante el sueño REM (sueño). En el modotheta, el EEG está dominado por grandes ondas regulares con un rango de frecuencia de 6-9 Hz, y los principales grupos de neuronas del hipocampo (células piramidales y células granulares) muestran una actividad poblacional dispersa, lo que significa que en cualquier intervalo de tiempo corto, la gran mayoría de las células están en silencio, mientras que la pequeña fracción restante se dispara a tasas relativamente altas, hasta 50 picos en un segundo para las más activas. Una célula activa suele permanecer activa entre medio segundo y varios segundos. A medida que la rata se comporta, las células activas se silencian y nuevas células se activan, pero el porcentaje global de células activas permanece más o menos constante. En muchas situaciones, la actividad celular viene determinada en gran medida por la ubicación espacial del animal, pero también influyen claramente otras variables de comportamiento.
El modo LIA aparece durante el sueño de ondas lentas (sin soñar) y también durante estados de inmovilidad de la vigilia, como el descanso o la alimentación. En el modo LIA, el EEG está dominado por ondas agudas, que son grandes desviaciones aleatorias de la señal del EEG que duran entre 200 y 300 segundos. Estas ondas agudas también determinan los patrones de actividad neuronal de la población. Entre ellas, las células piramidales y las células granulares son muy tranquilas (pero no silenciosas). Durante una onda aguda, hasta el 5-10% de la población puede emitir potenciales de acción durante un período de 50 mseg; muchas de estas células no emiten uno, sino una ráfaga de picos.
Estos dos modos de actividad del hipocampo pueden observarse tanto en primates como en ratas, con la importante excepción de que ha sido difícil ver una robusta ritmicidad theta en el hipocampo de los primates. Sin embargo, existen ondas agudas cualitativamente similares y cambios similares dependientes del estado en la actividad de la población neuronal.
El ritmo theta
Debido a sus densas capas neuronales, el hipocampo genera algunas de las señales EEG más grandes de cualquier estructura cerebral. En algunas situaciones, el EEG está dominado por ondas regulares, que a menudo se prolongan durante varios segundos. Este patrón del EEG se conoce como ritmo theta. Fue uno de los primeros fenómenos del EEG que se descubrió: la primera descripción la hicieron Jung y Kornmuller en 1938. Sin embargo, no fue hasta 1954, con la publicación por parte de Green y Arduini de un largo y exhaustivo estudio sobre el ritmo theta en conejos, gatos y monos, cuando el interés se disparó realmente. Tal vez en gran medida porque relacionaron el ritmo theta con la excitación, que era el tema de moda en ese momento, su artículo provocó una avalancha de estudios de seguimiento, lo que dio lugar a la publicación de literalmente cientos de estudios sobre la fisiología y la farmacología de theta durante las décadas de 1950 y 1960. A pesar de este enorme conjunto de trabajos, muchas preguntas quedaron sin respuesta, especialmente la cuestión de la función. Incluso en la actualidad, esta cuestión, la más crítica, aún no ha recibido una respuesta convincente.
La ritmicidad theta es muy evidente en conejos y roedores, y también está claramente presente en gatos y perros. La cuestión de si Theta puede observarse en los primates es una cuestión controvertida. Green y Arduini sólo informaron de ráfagas muy cortas de ritmos irregulares en monos, y la mayoría de los estudios posteriores han observado poco más. Sin embargo, las variaciones en la metodología han dificultado la extracción de conclusiones sólidas.
En las ratas (los animales que han sido, con diferencia, los más estudiados), theta se observa principalmente en dos condiciones: en primer lugar, cuando un animal está caminando o interactuando activamente con su entorno; en segundo lugar, durante el sueño REM. La frecuencia aumenta en función de la velocidad de la marcha, empezando por unos 6,5 Hz en el extremo inferior y aumentando hasta unos 9 Hz en el extremo superior, aunque a veces se observan frecuencias más altas en movimientos espectaculares, como saltos a través de grandes espacios. En otras especies de animales más grandes, las frecuencias theta suelen ser un poco más bajas. La dependencia del comportamiento también parece variar según la especie: en gatos y conejos, theta se observa a menudo durante estados de alerta inmóvil. Esto también se ha observado en ratas, pero sólo cuando están muy asustadas.
Theta no se limita al hipocampo. En las ratas, puede observarse en muchas partes del cerebro, incluyendo casi todas las que interactúan fuertemente con el hipocampo. Se cree que el marcapasos del ritmo se encuentra en el área septal medial: esta área se proyecta a todas las regiones que muestran la ritmicidad theta, y su destrucción elimina el theta en todo el cerebro. (Puede haber una excepción, una pequeña zona en el hipotálamo llamada núcleo supramamario, que parece ser capaz de mantener theta independientemente del septo en algunas situaciones.)
La función de theta, suponiendo que tenga una, aún no se ha explicado de forma convincente, aunque se han propuesto numerosas teorías.La tendencia más popular ha sido relacionarla con el aprendizaje y la memoria.Está bien establecido que las lesiones del septo medio–el nodo central del sistema theta–causan graves trastornos de la memoria.Sin embargo, el septo medio es algo más que el controlador de theta, también es la principal fuente de proyecciones colinérgicas al hipocampo. No se ha establecido que las lesiones septales ejerzan sus efectos específicamente eliminando theta.
Ondas agudas
Durante el sueño, o durante los estados de vigilia cuando un animal está descansando o no está comprometido con su entorno, el EEG del hipocampo muestra un patrón de ondas lentas irregulares, algo más grandes en amplitud que las ondas theta. Este patrón se ve interrumpido ocasionalmente por grandes oleadas denominadas ondas agudas. Estos eventos se asocian con ráfagas de actividad de picos, que duran entre 50 y 100 mseg, en las células piramidales de CA3 y CA1. También se asocian con oscilaciones EEG de alta frecuencia y corta duración denominadas “ripples”. Las ondulaciones, con frecuencias en el rango de 150-200 Hz en las ratas, normalmente sólo pueden ser detectadas por electrodos situados dentro, o muy cerca, de la capa del cuerpo celular de CA1. Por el contrario, los electrodos situados en cualquier parte del hipocampo, o incluso en estructuras cerebrales vecinas, suelen captar las ondas agudas como grandes desviaciones lentas del EEG, que duran entre 200 y 400 mseg.
En las ratas, las ondas agudas son más robustas durante el sueño, cuando se producen a un ritmo medio de alrededor de 1 por segundo, pero en un patrón temporal muy irregular. Las ondas agudas también se producen durante los estados de vigilia inactivos, pero son menos frecuentes y suelen ser más pequeñas. Las ondas agudas también se han observado en el lóbulo temporal humano y en el hipocampo de los monos, donde son bastante robustas, pero no se producen con tanta frecuencia como en las ratas.
Uno de los aspectos más interesantes de las ondas agudas es que parecen estar asociadas a la memoria. Wilson y McNaughton 1994, y numerosos estudios posteriores, informaron de que cuando las células de lugar del hipocampo tienen campos de disparo espaciales superpuestos (y, por lo tanto, a menudo se disparan de forma casi simultánea), tienden a mostrar una actividad correlacionada durante el sueño que sigue a la sesión de comportamiento. Este aumento de la correlación, comúnmente conocido como reactivación, se ha encontrado confinado principalmente a las ondas agudas. Se ha propuesto que las ondas agudas son, de hecho, reactivaciones de patrones de actividad neural que fueron memorizados durante el comportamiento, impulsados por el fortalecimiento de las conexiones sinápticas dentro del hipocampo. Esta idea constituye un componente clave de la teoría de la “memoria en dos fases”, defendida por Buzsaki y otros, que propone que los recuerdos se almacenan en el hipocampo durante el comportamiento y que posteriormente se transfieren al neocórtex durante el sueño: se sugiere que las ondas agudas impulsan cambios sinápticos hebbianos en las dianas neocorticales de las vías de salida del hipocampo.
Evolución
El hipocampo tiene un aspecto generalmente similar en toda la gama de especies de mamíferos, desde las basales, como el erizo, hasta las más “avanzadas”, como el ser humano. Sin embargo, no aumenta al mismo ritmo que la relación entre el tamaño del neocórtex y el cuerpo, por lo que el hipocampo ocupa un volumen mucho mayor del manto cortical en los roedores que en los primates.
También existe una relación general entre el tamaño del hipocampo y la memoria espacial: cuando se hacen comparaciones entre especies similares, las que tienen una mayor capacidad de memoria espacial tienden a tener mayores volúmenes de hipocampo. Esta relación también se extiende a las diferencias de sexo: en las especies en las que los machos y las hembras muestran fuertes diferencias en la capacidad de memoria espacial, también tienden a mostrar diferencias correspondientes en el volumen del hipocampo
Las especies no mamíferas no tienen una estructura cerebral que se parezca al hipocampo de los mamíferos, pero tienen una que se considera homóloga a él. El hipocampo, como se ha señalado anteriormente, es esencialmente el borde medial de la corteza. Sólo los mamíferos tienen una corteza completamente desarrollada, pero la estructura de la que evolucionó, llamada palio, está presente en todos los vertebrados, incluso en los más primitivos, como la lamprea o el mixino. El palio suele dividirse en tres zonas: medial, lateral y dorsal. El palio medial forma el precursor del hipocampo. No se asemeja al hipocampo visualmente, porque las capas no están deformadas en forma de S ni envueltas por el giro dentado, pero la homología está indicada por fuertes afinidades químicas y funcionales. Actualmente existen pruebas de que estas estructuras similares al hipocampo están implicadas en la cognición espacial en aves, reptiles y peces.
En las aves, la correspondencia está lo suficientemente bien establecida como para que la mayoría de los anatomistas se refieran a la zona palial medial como el “hipocampo aviar”. Numerosas especies de aves tienen una gran capacidad espacial, sobre todo las que almacenan comida. Hay pruebas de que las aves que almacenan comida tienen un hipocampo más grande que otros tipos de aves, y de que los daños en el hipocampo provocan trastornos en la memoria espacial.
La historia de los peces es más compleja. En los peces teleósteos (que constituyen la gran mayoría de las especies existentes), el cerebro anterior está extrañamente distorsionado en comparación con otros tipos de vertebrados. La mayoría de los neuroanatomistas creen que el cerebro anterior de los teleósteos está esencialmente invertido, como un calcetín vuelto del revés, de modo que las estructuras que se encuentran en el interior, junto a los ventrículos, en la mayoría de los vertebrados, se encuentran en el exterior en los peces teleósteos, y viceversa. Una de las consecuencias de esto es que se cree que el pallium medial (zona del “hipocampo”) de un vertebrado típico corresponde al pallium lateral de un pez típico. Se ha demostrado experimentalmente que varios tipos de peces (sobre todo los peces dorados) tienen una gran capacidad de memoria espacial, llegando a formar “mapas cognitivos” de las zonas que habitan. Hay pruebas de que los daños en el pallium lateral afectan a la memoria espacial (sin embargo, la navegación a larga distancia, como la que realizan los salmones, parece depender de mecanismos diferentes).
Por lo tanto, el papel de la región del hipocampo en la navegación parece comenzar muy atrás en la evolución de los vertebrados, antes de las divisiones que se produjeron hace cientos de millones de años. Todavía no se sabe si el pallium medial desempeña un papel similar en vertebrados aún más primitivos, como los tiburones y las rayas, o incluso las lampreas y los mixinos. Algunos tipos de insectos, y moluscos como el pulpo, también tienen una gran capacidad de aprendizaje espacial y de navegación, pero parecen funcionar de forma diferente al sistema espacial de los mamíferos, por lo que todavía no hay una buena razón para pensar que tienen un origen evolutivo común; tampoco hay suficiente similitud en la estructura del cerebro para poder identificar algo parecido a un “hipocampo” en estas especies.
Véase también
- Amígdalohipocampectomía
- Hermano anterior del cerebro
- Núcleos septales núcleos
Referencias &Bibliografía
Textos clave
Libros
- Aboitiz, F, Morales D, Montiel J (2003). El origen evolutivo del isocórtex de los mamíferos: Hacia un enfoque integrado de desarrollo y funcional. Behav. Brain Sciences 26: 535-552.
- Amaral, D; Lavenex P (2006). “Ch 3. Hippocampal Neuroanatomy” Andersen P, Morris R, Amaral D, Bliss T, O’Keefe J The Hippocampus Book, Oxford University Press.
- Broglio, C, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C (2002). Rasgos distintivos de un plan común del cerebro anterior de los vertebrados: Áreas paliales especializadas para la memoria espacial, temporal y emocional en peces actinopterigios. Brain Res. Bull. 57: 397-399.
- Buzsáki, G (2002). Theta oscillations in the hippocampus. Neuron 33: 325-340.
- Buzsáki, G (2006). Rhythms of the Brain.
- Cantero, JL, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B (2003). Oscilaciones theta dependientes del sueño en el hipocampo y el neocórtex humanos. J. Neurosci. 23: 10897-10903.
- Colombo, M, Broadbent N (2000). ¿Es el hipocampo aviar un homólogo funcional del hipocampo de los mamíferos? Neurosci. Biobehav. Rev. 24: 465-484.
- Eichnbaum, H; Cohen NJ (1993). Memory, Amnesia, and the Hippocampal System, MIT Press.
- Ekstrom, AD, Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, Fried I (2003). Redes celulares subyacentes a la navegación espacial humana. Nature 425: 184-188.
- Gray, JA; McNaughton N (2000). The Neuropsychology of Anxiety: An Enquiry into the Functions of the Septo-Hippocampal System, Oxford University Press.
- Green, JD, Arduini AA (1954). Hippocampal electrical activity in arousal. J. Neurophysiol. 17: 533-557.
- Jacobs, LF, Gaulin SJ, Sherry DF, Hoffman GE (1990). Evolución de la cognición espacial: los patrones de comportamiento espacial específicos del sexo predicen el tamaño del hipocampo. PNAS 87: 6349-6352.
- Jacobs, LF (2003). La evolución del mapa cognitivo. Brain Behav. Evol. 62: 128-139.
- Kirk, IJ, McNaughton N (1991). Disparo de células supramamarias y actividad rítmica lenta del hipocampo. Neuroreport 11: 723-725.
- Maguire, EA, Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, Frith CD (2000). Cambio estructural relacionado con la navegación en el hipocampo de los taxistas. PNAS 97: 4398-4403.
- McNaughton, BL, Battaglia FP, Jensen O, Moser EI, Moser MB (2006). La integración de trayectorias y la base neural del ‘mapa cognitivo’. Nat. Rev. Neurosci. 7: 663-678.
- Moser, EI, Kropf E, Moser M-B (2008). Place Cells, Grid Cells, and the Brain’s Spatial Representation System. Ann. Rev. Neurosci. 31.
- Nieuwenhuys, R (1982). An Overview of the Organization of the Brain of Actinopterygian Fishes. Am. Zool. 22: 287-310.
- O’Kane, G, Kensinger EA, Corkin S (2004). Evidencia del aprendizaje semántico en la amnesia profunda: Una investigación con el paciente H.M.. Hippocampus 14: 417-425.
- O’Keefe, J; Nadel L (1978). The Hippocampus as a Cognitive Map, Oxford University Press.
- Portavella, M, Vargas JP, Torres B, Salas C (2002). Los efectos de las lesiones paliales telencefálicas sobre el aprendizaje espacial, temporal y emocional en peces de colores. Brain Res. Bull. 57: 397-399.
- Rodríguez, F, Lópeza JC, Vargasa JP, Broglioa C, Gómeza Y, Salas C (2002). La memoria espacial y el palio del hipocampo a través de la evolución de los vertebrados: conocimientos de los reptiles y los peces teleósteos. Brain Res. Bull. 57: 499-503.
- Sainsbury, RS, Heynen A, Montoya CP (1987). Correlatos conductuales de la theta de tipo 2 del hipocampo en la rata. Physiol. Behav. 39: 513-519.
- Scoville, WB, Milner B (1957). Pérdida de la memoria reciente tras lesiones bilaterales del hipocampo. J. Neurol. Neurosurg. Psych. 20: 11-21.
- Shettleworth, SJ (2003). Memoria y especialización del hipocampo en las aves que almacenan alimentos: Challenges for Research on Comparative Cognition. Brain Behav. Evol. 62: 108-116.
- Skaggs, WE, McNaughton BL, Wilson MA, Barnes CA (1996). La precesión de la fase Theta en las poblaciones neuronales del hipocampo y la compresión de las secuencias temporales. Hippocampus 6: 149-176.
- Squire, LR (1992). La memoria y el hipocampo: una síntesis de los hallazgos con ratas, monos y humanos. Psych. Rev. 99: 195-231.
- Squire, LR; Schacter DL (2002). The Neuropsychology of Memory, Guilford Press.
- Vanderwolf, CH (1969). Actividad eléctrica del hipocampo y movimiento voluntario en la rata. EEG & Clin. Neurophysiol. 26: 407-418.
- Vargas, JP, Bingman VP, Portavella M, López JC (2006). Telencéfalo y espacio geométrico en peces de colores. Eur. J. Neurosci. 24: 2870-2878.
- West, MJ (1990). Estudios estereológicos del hipocampo: una comparación de las subdivisiones del hipocampo de diversas especies incluyendo erizos, roedores de laboratorio, ratones salvajes y hombres. Prog. Brain Res. 83: 13-36.
Papeles
- Amaral DG y Cowan WM. 1980. Aferentes subcorticales a la formación del hipocampo en el mono. Journal of Comparative Neurology. Feb 15; 189(4):573-91.
- Duvernoy, H. (2005) The Human Hippocampus, 3rd ed. Berlin: Springer-Verlag.
Material adicional
Papers
- Google Scholar
- http://www.psycheducation.org/emotion/hippocampus.htm¡Grandes recorridos cerebrales!!!
- Mapas cerebrales en el hipocampo de UCDavis
- Hipocampo artificial
- BrainInfo en la Universidad de Washington hier-164
- John O’Keefe & Lynn Nadel (1978) The Hippocampus as a Cognitive Map , Oxford University Press. Texto completo
Imágenes adicionales
Añadir una foto a esta galería
Cerebro humano: Sistema límbico
Amígdala – Giro cingulado – Giro fornicario – Hipocampo – Hipotálamo – Cuerpo mamario – Núcleo accumbens – Corteza orbitofrontal – Giro parahipocampal
|
v-d-e
Cerebro humano: cerebro anterior (cerebro – corteza cerebral – hemisferios cerebrales, materia gris) (TA A14.1.09.002-240, 301-320, GA 9.818-826) |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Lóbulo frontal |
|
||||||||||||||||
| Lóbulo parietal |
|
Superolateral
|
Medial/inferior
|
Ambos
|
|||||||||||||
| Lóbulo occipital |
|
Superolateral
|
Medial/inferior
|
||||||||||||||
| Lóbulo temporal |
|
Superolateral
|
Medial/inferior
|
||||||||||||||
| Surco interlobar |
|
Superolateral
|
Medial/inferior
|
||||||||||||||
| Lóbulo límbico |
|
Otros
|
|||||||||||||||
| Lóbulo insular |
Giro largo de la ínsula – Giros cortos de la ínsula – Surco circular de la ínsula |
||||||||||||||||
| General |
Operculum – Polos de los hemisferios cerebrales |
||||||||||||||||
Algunas categorizaciones son aproximaciones, y algunas áreas de Brodmann abarcan giroscopios.
|
|||||||||||||||||
Esta página utiliza contenido con licencia Creative Commons de Wikipedia (ver autores).