Előszó
Ez a tanulmány egy személyes víziót nyújt arról, hogy mi szükséges ahhoz, hogy a fágterápia végre áttörjön, mint a mainstream antibakteriális eszköz. A fágterápia történeti és közelmúltbeli kudarcai és bizonytalanságai befolyásolják, és a jövő és a feltörekvő technológiákon alapuló megoldások keresésére törekszik, amelyek a holnap tudományát és társadalmát hivatottak modellezni.
Fágterápia
A bakteriofágok (fágok) a baktériumok vírusai. Ősidők óta szabályozzák baktériumgazdáik növekedését és terjedését. A bakteriális vírusok a bioszféránkban mindenütt jelenlévő élőlények. Becslések szerint 10 milliószor több vírus van az óceánokban, mint ahány csillag van a világegyetemben, és ha a Földön található összes fágot egymásra raknánk, ez a torony messzebbre nyúlna, mint a legközelebbi 60 galaxis (Suttle, 2013). Könnyen megtalálhatók ott, ahol a baktériumok szaporodnak: a csatornákban, folyókban vagy a betegek vizeletében és székletében. Az emberi baktériumok kórokozóinak fágjai leggyakrabban egy ikozaéderes fejből, egy 20 lapos felületű, fehérjékből álló, nukleinsav genomot tartalmazó gömbből állnak, amelyhez egy fehérjefarok kapcsolódik. Amikor egy szigorúan lítikus fág a farokrostjaival és tüskéivel a célbaktérium felszínéhez tapad, a fecskendőszerű farokhüvely összehúzódik, és a farokmag áthalad a baktérium sejtfalán, befecskendezve a fág genomját a baktériumsejt periplazmájába. A bakteriális DNS- és fehérjeszintézis gépezet azonnal eltérül, hogy a fág másolatait felépítse. Egyes fágok darabokra vágják a bakteriális DNS-t. Egy percekből vagy órákból álló látens időszak után az újonnan képződött fágok kitörnek a bakteriális gazdaszervezetükből, amelyek eközben elpusztulnak. A fág utódok, amelyek száma baktériumonként több százra tehető, ezután új gazdabaktériumokat keresnek, hogy megfertőzzék őket. Így a fágok önreprodukáló antimikrobás szereknek tekinthetők. Fontos, hogy a fágok úgy fejlődtek ki, hogy csak bizonyos célbaktériumokat fertőzzenek meg, és ártalmatlanok az emlősök sejtjeire.
Az antibakteriális hatású vírusszerű ágensek korai bizonyítékairól Frederick Twort angol bakteriológus és Felix d’Hérelle francia-kanadai mikrobiológus számolt be 1915-ben, illetve 1917-ben (Sulakvelidze et al., 2001). 1919-ben d’Hérelle használta ki először a fágok terápiás potenciálját, amikor Párizsban egy vérhasban szenvedő fiú gyógyítására használta őket. A fágterápiát azonnal felismerték, mint a bakteriális fertőzések kezelésének terápiás megközelítését, és a fágterápiás készítmények kereskedelmi forgalomba hozatalára több vállalat is vállalkozott, például a L’Oréal Európában és az Eli Lilly Company az Egyesült Államokban (Sulakvelidze et al., 2001). 1923-ban Giorgi Eliava grúz mikrobiológus megalapította a grúziai Tbilisziben az Eliava Intézetet, amely a fágterápiás kutatásoknak szentelte magát. Ez volt a kezdete a kiterjedt fágterápiás kutatásnak és fejlesztésnek az egykori Szovjetunióban. A fágterápia korai alkalmazásai azonban gyakran megbízhatatlanok voltak, és az antibiotikumokkal kapcsolatos kutatások is folytak. A penicillin második világháború alatti sikeres alkalmazása és az azt követő világméretű forgalmazása miatt a nyugati tudósok elvesztették érdeklődésüket a fágterápia iránt. A szovjet kutatók ezzel szemben tovább fejlesztették a fágterápiát és publikálták eredményeiket, de a vasfüggöny miatt tudásuk és tapasztalataik nem terjedtek el világszerte (Sulakvelidze és mtsai., 2001). A harmadik évezred hajnalán az antibiotikum-rezisztens baktériumok okozta fertőzések növekvő egészségügyi terhei (Cassini és mtsai., 2019) világszerte megújult érdeklődést szítottak a fágterápia, mint a bakteriális fertőzések klinikai kezelésének életképes kiegészítő eszköze iránt (Thiel, 2004). Világszerte fágterápiás központokat hoznak létre, az Eliava Intézet és a lengyelországi Wrocławban található Hirszfeld Intézet fágterápiás részlege nyomdokain haladva (Miêdzybrodzki et al., 2012).
A 2035-ös év
Előrelépés a jövő 2035-ös Földjére, egy komor világba, amelyet az emberi túlnépesedés, az ökoszisztéma jelentős zavarai, a globális felmelegedés és az idegengyűlölet jellemez.
Miközben a fürdőjében áztatta magát, Dr. John Iverian, nyugdíjas mikrobiológus hirtelen rendkívül fájdalmas szúrást érzett a tarkóján, amit egy kis repülőgép propelleréhez hasonló hang követett. Átvizsgálta a környezetét, és a szeme sarkából meglátott egy furcsa, nagy, hosszú, hátborzongató lábakkal és antennákkal rendelkező rovart, amely a dizájnos fürdőkádja melletti falon ült. Az Osuri, Iverian Antwerpen központjában található tetőtéri lakásának otthonkezelő rendszere azonosította a rovart, mint a barna marmoros bűzbogarat, a Halyomorpha halys-t, amely világszerte elterjedt. Az Osuri jelentése, amelyet a fürdőszoba egyik videoképernyőjén vetítettek ki, megemlítette, hogy az emberek, akiket megcsípett, kezdetben egy kis piros sebet tapasztaltak a bőrük csípési helyén. Ha nem foglalkoztak vele, a harapott seb megduzzadt és gennyes lett. Fáradtan és nyálasan, nemtörődöm Iverian kilépett a fürdőből, és lefeküdt aludni. Úgy döntött, hogy nem végzi el a bonyolult sebkezelési eljárást, amit Osuri erősen tanácsolt. Másnap kora reggel azonban a harapás nekrotikus sebbé vált, amely a fertőzés egyértelmű jeleit mutatta.
Iverian szorongva aktiválta a Phage-BEAM készülékét. A BEAM a “Bedside Energized Anti-Microbial” rövidítése volt. A készülék mérete és alakja egy cipősdobozé volt, de elegánsabb és csiszoltabb megjelenéssel. A készülék neve és gyártója színes betűkkel volt feltüntetve a zökkenőmentes, fehér zománcozott doboz oldalán. Iverian kivett egy tampont a steril csomagolásból, és óvatosan végigsimította vele a seb teljes területét, ügyelve arra, hogy a sebváladék alaposan benedvesítse a tampon vattahegyét. Amikor a tampon a doboz “minta behelyezése” területéhez ért, egy aprócska ajtó mintegy varázsütésre kinyílt, és kiszabadította egy Marcia nevű laboráns 10 hüvelyk magas hologramját. Megmutatta Iverian-nak, hova kell bedokkolni a mintát. Marciát arra fejlesztették ki, hogy végigvezesse az ügyfeleket a vizsgálati eljáráson. “A legjobb eredmény érdekében, kérem, helyezzen be egy új fág biofestékkazettát, Dr. Iverian” – mondta Marcia. Akárcsak a tegnapi 2D nyomtatók esetében, a bio-tintapatronok ára majdnem olyan magas volt, mint magának a Phage-BEAM készüléknek az ára. A “Business Insider” szerint a fág bio-tinta a Chanel No. 8 után a második legdrágább folyadék volt a Földön. Szerencsére Iverian, mint az egyik feltaláló, megszerezte a jogot, hogy mindig a készülék legfrissebb változata álljon rendelkezésére, beleértve a reagensek folyamatos ellátását, ingyenesen.
Iverian tökéletesen tudta, hogyan működik a készülék, így nem volt szüksége Marcia segítségére. Először DNS-t vontak ki a tampon hegyéből, és meghatározták a metagenomot – a mintában lévő összes genetikai anyagot, beleértve a fertőző baktériumokat is. Ezután ezeket a genetikai adatokat elküldték egy biztonságos “Phage XChange” szerverre, ahol egy összetett, mesterséges intelligencia által vezérelt algoritmus megjósolta annak a fágnak a genomszekvenciáját, amelyik a legnagyobb valószínűséggel lítizálja a metagenomban azonosított fertőző baktériumot, és amelyiknek a leggyengébb immunreakciót kellett kiváltania a betegben. A fággenom-adatokat elküldték a Phage-BEAM készüléknek, amely először a fággenomot, majd a fágot szintetizálta egy szabadalmaztatott, baktériummentes fággyártó rendszer segítségével.
A készülék a mintavételt követő 1 órán belül kész terápiás fágkészítményt állított elő. A lépésről-lépésre történő eljárás eredményeit az Iverian nappalijában lévő hatalmas otthoni videoképernyőre közvetítenék. LC2-es karosszékében ülve, Mozart c-moll nagymiséjét hallgatva Iverian izgatottan várta az eredményeket. Rossz előérzete volt ezzel kapcsolatban. Az eredménytől Iverian hátán végigfutott a hideg. Bakteriális kórokozót azonosítottak: Streptococcus pyogenes FE-2033 törzs! Osuri azonnal aktiválta a fertőzésriasztási protokollt, üzenetet küldött a Betegségellenőrző Világközpontnak, és aggasztó háttérinformációkat vetített előre a halálos húsevő baktériumtörzsről, amely 2033 óta közvetlen közegészségügyi veszélynek számított. Egy pillanatra Iverian fontolóra vette, hogy egy konyhakéssel kimetszi a fertőzött sebet és néhány környező egészséges szövetet, de megnyugodott, és úgy döntött, hogy vár és alkalmazza a küszöbön álló Phage-BEAM terméket. Egy órával később a Phage-BEAM készülék szintetikus fágokat állított elő. Ezeket a fágokat ezután egy validációs modulban összekeverték az izolált baktériumokkal, hogy teszteljék in vitro hatékonyságukat. Tizenöt perccel később az Iverian zöld utat kapott a kezelés megkezdéséhez. Az Iverian a fágokat egy lassan felszabaduló hidrogél alapú sebkötszerben alkalmazta, amelyet először összekevertek a Phage-BEAM készülék által előállított koncentrált fágszuszpenzióval, és amely szinergista antibiotikumokat is tartalmazott. A hidrogél átmenetileg enyhítette a fájdalmat, ami tovább nyugtatta. Iverian naponta egyszer megismételte a fággal és antibiotikummal töltött hidrogél alkalmazását. A sebfertőzés 24 órán belül javult, és 7 nap múlva a seb szinte teljesen begyógyult. Iverian potenciálisan életveszélyes fertőzését sikeresen kezelték, méghozzá időben és anélkül, hogy el kellett volna hagynia az otthonát. Sok évtizeddel korábban azonban még nem volt biztos, hogy a fágterápia áttörést fog elérni, hogy széles körben alkalmazott és klinikailag hasznos antibakteriális eszközzé váljon. Az orvosi világnak időbe telt, mire felismerte, hogy a fágterápiának nem kell azonosnak lennie az antibiotikumterápiával, és ez főként a hatóanyagok, a fágok sajátosságai miatt volt így.
A fágok néhány lényeges sajátossága
A fágok számos olyan tulajdonsággal rendelkeznek, amelyek eltérnek az antibiotikumtól, és akadályozták gyógyszeripari termékként való kifejlesztésüket és terápiás alkalmazásukat. Először is, hajlamosak arra, hogy specifikusak legyenek az általuk megfertőzött baktériumok tekintetében. Legjobb esetben egyetlen baktériumfaj jelentős részét veszik célba, legrosszabb esetben azonban egy fajon belül csak néhány törzset fertőznek meg. A terápiás fágokat tehát úgy lehet kiválasztani, hogy elsősorban egy baktériumfajt vagy annak egy klinikailag releváns alcsoportját pusztítsák el, és kíméljék meg a beteg jótékony baktériumait (pl. a bél, a bőr vagy a szájüregi komensális flórát). A legtöbb rutinszerűen alkalmazott antibiotikum ezzel szemben széles hatásspektrummal rendelkezik, ami “járulékos károkat” okozhat a beteg komensális mikrobiomjában, ami viszont olyan káros hatásokhoz vezethet, mint az antibiotikumoknak ellenálló baktériumfajok (pl. Clostridium difficile) vagy az antibiotikummal összefüggő hasmenés (Jernberg et al., 2010). A fágspecificitás hátránya, hogy a fágterápia megkezdése előtt azonosítani kell a fertőző baktériumokat. Az empirikus antibiotikum-terápiában ezzel szemben jellemzően széles spektrumú antibiotikum-koktélokat alkalmaznak, amelyek számos Gram-pozitív és Gram-negatív baktériumra, valamint különféle gombákra hatnak. Ha több információ ismert (pl. baktériumtenyészetből), a kezelés szűk spektrumú antibiotikumokból állhat, amelyek specifikusabban célozzák meg a betegséget okozó, azonosított baktériumokat vagy gombákat.
Második, a baktériumok és a fágok gazdatest-parazita kapcsolatban állnak egymással. A szigorúan litikus fágok mindenütt jelen vannak a környezetben, és életciklusuk befejezéséhez szükségük van bakteriális gazdájuk halálára. Gazdatestek nélkül a fágok nem létezhetnek. A fágok szelekciót indítanak el a rezisztens gazdaszervezetek számára, amelyek viszont szelekciót indítanak el a hatékony fágok számára. Ez az úgynevezett “antagonisztikus koevolúciót” eredményez, a baktériumok és a fágok közötti fegyverkezési versenyt, amelyet a baktériumok ellenállóképességének és a fágok fertőzőképességének kölcsönös fejlődése jellemez (Buckling és Rainey, 2002). A legtöbb antimikrobiális szerhez hasonlóan tehát a baktériumok is rezisztenssé válnak a fágokkal szemben (Luria és Delbrück, 1943; Schooley és mtsai., 2017), de a statikus antibiotikumokkal ellentétben a fágok képesek legyőzni a baktériumok rezisztenciáját (Buckling és Rainey, 2002). Mindazonáltal vannak arra utaló jelek, hogy a baktériumok és a fágok nem fogják a végtelenségig növelni egymás ellenállóképességét és fertőzőképességét (Fortuna és mtsai., 2019).
Fágterápiás megközelítések
A fágterápia újjáéledésének idején, a 2000-es évek elején két különböző fágterápiás megközelítést dolgoztak ki (Pirnay és mtsai., 2011). Az úgynevezett “one-size-fits-all” megközelítésben meghatározott, széles spektrumú fágkoktélokat alkalmaztak, amelyek a feltételezések szerint az egyes fertőző betegségeket feltételezhetően okozó baktériumok többségét célba vették. Ezeket az előre meghatározott széles spektrumú fágkoktélokat a jelenlegi farmakoökonómiai modellek keretében fejlesztették ki, állították elő és tesztelték, amelyeket a “statikus” gyógyszerek, például az antibiotikumok számára terveztek. A valóban széles spektrumú, a fertőző betegségekben gyakran előforduló Gram-pozitív és/vagy Gram-negatív baktériumok többségével szemben aktív fágkoktéloknak azonban nagy mennyiségű fágot kellett tartalmazniuk, és ezek kifejlesztése nagyon nehéznek bizonyult. Megvalósítható volt szűkebb spektrumú, egy vagy néhány baktériumfaj ellen aktív fágkoktélok kifejlesztése, amelyeket bizonyos indikációkban lehetett használni, és amelyeknél a fertőző baktériumfajok előre ismertek voltak. Egyes baktériumfajok, például a Staphylococcus aureus esetében kivételesen széles gazdaszervezeti tartományt mutató fágokat izoláltak és jellemeztek (Vandersteegen és mtsai., 2011). A PhagoBurn randomizált, kontrollált vizsgálatban az égési sebek Pseudomonas aeruginosa terheltségének tartós csökkentésében elért siker összefüggött a fágkoktélra való kezdeti érzékenységgel (Jault és mtsai., 2019). A bevont betegek egyharmadánál azonban kimutatták, hogy már meglévő P. aeruginosa törzsek voltak jelen, amelyek ellenálltak a fágkoktélnak, amely nem kevesebb, mint 12 lítiás P. aeruginosa-fágból állt. Ezenkívül a kezdetben hatásosnak tervezett fágkoktélokat rendszeresen frissíteni kellett (pl. új fágokkal kiegészíteni) a fágrezisztencia kialakulása vagy az újonnan keringő, klinikailag releváns törzsek bevonása miatt. Végezetül nem volt ismert, hogy a baktériumok nagy koncentrációjú, rögzített fágkoktélokkal való szembesítése a kórházakban és a környezetben a bakteriális fágrezisztencia kialakulásához, elterjedéséhez és fennmaradásához vezet-e, hasonlóan ahhoz, ami az antibiotikumok tömeges alkalmazásakor történt.
A személyre szabott fágterápiás koncepciókban egy vagy több fágot választottak ki egy fágbankból vagy a környezetből, és esetleg adaptálták őket (fokozott fertőzőképességet mutató fágmutánsok in vitro szelekciója), hogy hatékonyabban fertőzzék meg a beteg fertőzési helyéről izolált baktériumokat (Friman et al, 2016). Egyes fágterápiás központok nagy terápiás fágbankokat hoztak létre és tartottak fenn, amelyeket rendszeresen frissítettek új fágokkal, kiszélesítve és adaptálva a bank gazdaspektrumát a folyamatosan változó baktériumpopulációkhoz. A személyre szabott fágterápiás megközelítések potenciálisan fenntarthatóbbak voltak, mivel csak a fertőző baktériumot veszik célba, ami kisebb szelekciós nyomást eredményez a bakteriális fágrezisztencia irányába. Ugyanakkor bonyolultabbak és logisztikailag összetettebbek is voltak, mint az egyformán alkalmazható megközelítések, mivel a baktériumtörzseket és a hozzájuk illeszkedő fágokat a világ minden tájára el kellett küldeni (1. ábra). Ráadásul a precíziós gyógyászati koncepciók általában nem voltak összeegyeztethetők a legtöbb gyógyszer (az Egyesült Államokban gyógyszerek) fejlesztési és engedélyezési útvonalával, amely több évet és több millió eurót (dollárt) igényelt, és mindezt a bankban lévő minden egyes fágra vonatkozóan (Verbeken és mtsai., 2012).
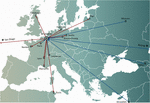
1. ábra. A fágok nemzetközi átadása a brüsszeli Asztrik királyné Katonai Kórházból (QAMH) (piros nyilak) és a brüsszeli Asztrik királyné Katonai Kórházba (QAMH) (kék nyilak) a klinikai alkalmazások szempontjából a 2015-2020 közötti időszakban. Nemzeti szinten a QAMH-ból öt egyetemi kórházba küldtek fágokat (nem látható). Ezenkívül a megfelelő fágok kiválasztása gyakran magában foglalta a betegek bakteriális izolátumainak átadását is, és öt nemzetközi beteget (kettőt Franciaországból, kettőt Hollandiából és egyet Tunéziából) szállítottak Brüsszelbe fágterápia céljából.
Belépés a szintetikus biológiába
A harmadik évezred kezdetével a szintetikus biológiai megközelítéseket egyre inkább a fágok specifitásának és a bakteriális fágrezisztencia kialakulásának csökkentésére fejlesztették ki (pl, szerkezetvezérelt tervezés) (Pires és mtsai., 2016; Dunne és mtsai., 2019). Például élesztőalapú platformokat dolgoztak ki a fágok farokrostfehérje-váltására, hogy kiszámíthatóbb és kiterjesztett gazdaszervezeti tartományú hibrid fágokat tervezzenek (Ando et al., 2015; Yosef et al., 2017), és géntechnológiai stratégiákat (pl., CRISPR-Cas szerkesztési eszközöket) fejlesztettek ki más szempontok, például a negatív beteg-fág kölcsönhatások (pl. fágellenes immunválasz) (Brown és mtsai., 2017), a bakteriális fág rezisztencia mechanizmusok lehetséges megjelenése és terjedése, valamint a káros bakteriális tartalmak, például endotoxinok felszabadulása érdekében (Hwang és mtsai., 2018). A szintetikus fággenomokat újra kellett indítani a fág utódok előállításához (Barbu et al., 2016; Pires et al., 2016), Escherichia coli vagy Listeria monocytogenes L-formák transzformációjával (Kilcher et al., 2018) vagy sejtmentes transzkripciós-transzlációs (TXTL) rendszerek segítségével (Rustad et al., 2018). A nyugati szabályozási keretek fokozatosan elkezdték figyelembe venni a precíziós és személyre szabott fágterápiás megközelítéseket, amelyek természetes fágokat (Pirnay et al., 2018), mesterséges fágokat (Dedrick et al., 2019) és szintetikus fágokat használnak.
A Phage-BEAM-hez hasonló ad hoc és helyszíni terápiás fággyártó eszközök fejlesztése nem ment zökkenőmentesen, emlékeztetett Iverian. Kezdetben mesterséges intelligencia (AI) alapú in silico fágillesztésre és tervezésre volt szükség. A mélytanulást (Martorell-Marugán et al., 2019), a gépi tanulás egy részhalmazát választották a baktériumgenomok és a fertőző fággenomok közötti kapcsolatok keresésére, mert könnyebben skálázható volt nagyobb számú mintára. A mélytanulási módszerek például nem igényeltek úgynevezett feature extractiont, ami a fág- és baktériumgenomok gén/fehérje szintű annotációját igényelné, és a predikciókat a baktérium- és fágjellemzők közötti bizonyos ismert kapcsolatokra korlátozná, mint például a fág farokroststruktúrák kötődése a specifikus bakteriális sejtfalreceptorokhoz. Hátulütője, hogy folyamatos, hatalmas mennyiségű adatra volt szükség, amely összekapcsolja a litikus fág genomokat a gazdabaktériumok genomjaival, és itt szorult be a cipő. A teljes genomszekvenálás lassan beszivárgott a klinikai mikrobiológia gyakorlatába (American Academy of Microbiology, 2016), de a kutatóintézetek és a gyógyszeripari vállalatok nem voltak hajlandóak egyetlen központi adatbázisba benyújtani adataikat, és nem találtak olyan befektetőt, aki hajlandó és képes lett volna a rendelkezésre álló adatok megszerzésére és/vagy megfelelő mennyiségű új adat előállítására. A második leküzdendő akadály a nagy DNS-molekulák gyors, megbízható és megfizethető szintézisének elérhetetlensége volt. A kezdeti DNS-szintézis technikák a szerves kémián alapultak, és viszonylag kis DNS-molekulákat állítottak elő. A fággenomok de novo szintéziséhez több genomtöredék összeállítására volt szükség (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) a Saccharomyces cerevisiae élesztőben, élesztő mesterséges kromoszómák (Ando et al., 2015) vagy kémiai összeállítás (Gibson et al., 2009) segítségével. Az immunrendszer sejtjeiben található DNS-szintetizáló enzimeken alapuló új DNS-szintetizáló technika kifejlesztése (Palluk et al., 2018) megkönnyítette a fág genomszintézist. Végül néhány akadályt kellett leküzdeni ahhoz, hogy olyan generikus, sejtmentes fágtermelő rendszereket fejlesszenek ki, amelyek képesek magas titerben és a természetes analógjaikkal azonos szintű bakteriális fertőzőképességgel rendelkező fágokat előállítani.
Az áttörés
A fő probléma az volt, hogy nagyon nehéznek bizonyult összegyűjteni azt a hatalmas mennyiségű összekapcsolt fág- és bakteriális genomszekvenciát, amely a mélytanuló AI-algoritmusoknak a fágszekvenciák terápiásan elfogadható pontosságú előrejelzéséhez és/vagy tervezéséhez szükséges. Iverian felidézte, hogy az igazi áttörést az hozta meg, amikor a “Phage XChange” nevű nonprofit szervezet elindította az azonos nevű globális fágirányítási platformját, hogy hatékony, szabványosított, fenntartható és etikus fágellátási láncot hozzon létre (2. ábra). A Phage XChange főként egy AI modulból és egy elosztott főkönyvből (Distributed Ledger, DL) állt (Thiebes et al., 2020). A platform AI-modulja összekapcsolt fág- és baktériumgenomokat elemzett, hogy megjósolja és megtervezze a hatékony fágokat az ügyfelek számára. Azt is megjósolta, hogy mely bakteriális kórokozókra kell a legsürgősebb figyelmet fordítani, a tárgyak internete (IoT) és a Big Data, valamint a nemzetközi közegészségügyi szervezetek, például az Egészségügyi Világszervezet (WHO) és a nemzeti járványügyi központok által szolgáltatott információk alapján. Ezek az adatok a legsürgősebben szükséges fágok izolálása és jellemzése felé irányították a rendszert.
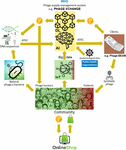
2. ábra. Elképzelés arról, hogyan szerveződhet a fágellátási lánc 2035-ben. AI, mesterséges intelligencia; ATGC, DNS-szekvencia; BEAM, bedside energized anti-microbial; DL, distributed ledger; IoT, Internet of Things; P, PhageCoin; WHO, World Health Organization.
A platform DL-modulja biztosította a kapcsolt fág/baktérium genomszekvenciák elegendő, minőségi és nyilvántartott bevitelét az AI-modulba, és dettó a fágszekvenciák ellátását az ügyfelek számára, a Nagoya protokoll rendelkezéseinek megfelelően (Expert round table on acceptance and re-implementation of bacteriophage therapy et al., 2018). A DL megváltoztathatatlanul rögzítette az összes érdekelt felet (pl. adatszolgáltatók, szekvenálási szolgáltatások és ügyfelek), tranzakciót és szerződéses részleteket. Emellett rögzítette a szállított anyag pontos minőségét, specifikációit és súlyát is. Egy algoritmus meghatározta a nem redundanciát, és megbecsülte a benyújtott anyag súlyát (pl. a fágok virulenciáját és gazdanövénytartományát) és kívánatosságát. Természetesen az újonnan megjelenő bakteriális kórokozókat célzó fágok voltak a legkeresettebbek. A legtöbb szabadalmi kérdést elhárították. A DL fizetési főkönyvként működött, biztosítva, hogy minden fél időben és tisztességesen kapjon fizetést. Számos PhageCoint (a platform kriptopénzét) juttattak a szállítóknak a szállított anyag minőségének, súlyának és kívánatosságának függvényében. A DL-en keresztül előrejelzési eredményeket (fágszekvenciákat) kinyerő ügyfelek a fágok becsült értékével arányos mennyiségű PhageCoint fizettek. Ezeket a PhageCoinokat a DL fenntartására, az elegendő és folyamatos anyag beáramlásának biztosítására, valamint a fágok virulencia- és gazdanövekedési adatainak bővítésére (a fágok baktériumokhoz való illesztése) használták. További pénzinjekciót és ösztönzést az anyagszállításra mindenféle áruk termelőiben és beszállítóiban találtak. Az azonnal megszerzett PhageCoins-okkal a fágszállítók mindenféle terméket erősen csökkentett áron vásárolhattak online, a laboratóriumi és iskolai felszerelésektől kezdve a sportcikkekig. Ezeket az árukat vállalati szponzoráció révén biztosították. Számos ismert vállalat szponzorálta a PhageXchange-t adókedvezményekért, reklámért és a társadalmilag felelős márka imázsáért cserébe. A szállított anyag súlyát és így értékét is kezdetben alulértékelték, de rendszeres időközönként újraértékelték (iteráció), és a szállítóknak több PhageCoint tulajdonítottak, ha indokolt volt. Bár a platform a bevezetésétől kezdve hasznos volt, igazán sikeressé csak akkor vált, amikor a WHO védelme alá helyezték, az emberi eredetű gyógyszerek nyomon követhetőségének, átláthatóságának, éberségének és felügyeletének világméretű rendszerével analóg módon (Warwick et al., 2013). A Phage XChange és a WHO közötti hivatalos megállapodás növelte a nemzetközi bizalmat a platform hosszú távú fenntarthatósága és az etikátlan kereskedelmi hasznosítással szembeni védelem iránt. A hatékony terápiás célú fágok keresése hamarosan az antibiotikum-rezisztencia-válság megoldását célzó közösségi erőfeszítéssé vált: független “fágvadászok”, iskolák, cserkészcsoportok, Amazonas-parti falvak stb. izoláltak és küldtek be fágokat a Phage XChange-nek, PhageCoinsért cserébe. Ennek margójára különböző cégek és intézmények perifériás berendezéseket és szolgáltatásokat fejlesztettek ki, például fágizolációs készleteket és szekvenáló és fágszintetizáló platformokat (pl. a Phage-BEAM készüléket). Ezeket az eszközöket megelőzve olyan köztes megoldásokat kínáltak, amelyek révén magukat a fágokat a DL-en keresztül szerezték be.
Epilog
A fágterápia jövőjét illetően ez a nézet optimista befejezést kínál az antibiotikum-rezisztencia válságára. A szintetikus fágok ad hoc és helyszíni előállítása, amely egy globális, közösségi alapú, fágkezelő rendszerhez kapcsolódik, üdvözlendő és megfizethető (a társadalombiztosítási rendszerek számára) extra fegyvernek bizonyult az antibiotikum-rezisztens bakteriális fertőzések elleni küzdelemben. Ez azonban nem csodafegyver, hanem a bevált antimikrobiális szerek szinergikus kiegészítése. A szintetikus fágok azonnali és sejtmentes előállítása – akár tervezték, akár nem – jelentős előnyökkel járt a klasszikus módon (bakteriális gazdaszervezetben) előállított természetes fágokkal szemben:
(i) Nem volt szükség fizikai terápiás fágbankok fenntartására és a beteg baktériumizolátumainak és a megfelelő terápiás fágoknak a világ minden tájára történő szétküldésére.
(ii) Szintetikus fágok a kiemelkedő közegészségügyi veszélyt okozó baktériumok ellen, mint például a 2011-es németországi E. coli O104:H4 járvány (Merabishvili et al, 2012), vagy bioterrorizmusra (feltételezhetően) használt baktériumok ellen (Joñczyk-Matysiak et al., 2014) időben előállíthatók a helyszínen.
(iii) A potenciálisan halálos betegségeket okozó olyan baktériumok elleni fágokat, amelyekhez nem álltak rendelkezésre nem halálos termelési gazdatörzsek, és amelyek szaporítása korábban a biológiai biztonsági szint 3 (bsl-3) biológiai óvintézkedéseket igényelt, bsl-1 körülmények között lehetett szintetizálni.
(iv) Ha a mintavételi helyekről nem lehetett fágokat izolálni, például azért, mert az izolációs technikákhoz használt bakteriális gazdatörzsek nem voltak fogékonyak a kívánt fágokra, a metagenomikai adatokból kinyert (prediktált) fág genomi szekvenciákat (Reyes et al, 2010; Amgarten et al., 2018), felhasználhatók szintetikus fágok előállítására.
(v) A szintetikus fágkészítmények nem (vagy csak kisebb mennyiségben) tartalmaztak olyan molekulákat, amelyek negatív hatással lehetnek a betegekre (pl. endotoxinok).
(vi) A szintetikus fágok előállítására alkalmas eszközöket a hosszabb űrutazás és űrkolonizáció során adaptálták (Taylor és Sommer, 2005).
Az előrejelzések megvalósulásának kicsi az esélye. Valószínűleg túl rövidlátó azt gondolni, hogy egy közösségi alapú, közegészségügyi szervezetek által támogatott és egy globális, fenntartható és etikus platform által irányított erőfeszítés lehet a jelenlegi világméretű antibiotikum-rezisztencia-válság megoldásának középpontjában. A javasolt rendszer egyes részei, mint például a szintetikus fágok sejtmentes előállítása egy ágy melletti eszközzel, ésszerű eséllyel megvalósulhatnak, míg más elemek, mint például a vállalati szponzoráció, valószínűleg a sci-fi birodalmában maradnak. Mondhatják, hogy álmodozó vagyok, úgyhogy nyugodtan ébresszenek fel 2035-ben, hogy szembesítsenek a valósággal!
A szerzők hozzájárulása
J-PP fogalmazta meg az elképzelést és fogalmazta meg a kéziratot.
Finanszírozás
A kiadás költségeit a “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst” fedezte.
Érdekellentét
A szerző kijelenti, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezte, amelyek potenciális összeférhetetlenségként értelmezhetők.
A kezelőszerkesztő a szerzővel való korábbi társszerzőségről nyilatkozott.
Köszönet
A jelen kéziratban kifejtett személyes elképzelés, vagy álom az elmúlt 15 év számos kutatótársával való interakciók eredményeként jött létre. Lehetetlen mindannyiukat megnevezni, de nem lenne tisztességes, ha az összes elismerést egyedül venném át. Ezért úgy döntöttem, hogy néhányukat itt (ábécé sorrendben) megemlítem, azzal a kockázattal – vagy inkább bizonyossággal -, hogy néhány fontos befolyásolóról megfeledkezem: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili, Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bossche, Mario Vaneechoutte, Gilbert Verbeken és Kilian Vogele.
American Academy of Microbiology (2016). A klinikai mikrobiális újgenerációs szekvenálás alkalmazásai: Report on an American Academy of Microbiology Colloquium Held in Washington, DC, in April 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P., da Silva, A. M., and Setubal, J. C. (2018). MARVEL, egy eszköz a bakteriofág szekvenciák előrejelzésére metagenomikai tárolókban. Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., and Loessner, M. J. (2018). Egyedi, szintetikus bakteriofág genomok L-formájú baktériumokban történő, genusokon átívelő újraindítása. Proc. Natl. Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., and Lu, T. K. (2018). Fágalapú alkalmazások a szintetikus biológiában. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., and Delbrück, M. (1943). Baktériumok mutációi a vírusérzékenységtől a vírusrezisztenciáig. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine,” in Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019..ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). A 2011-es németországi járványból származó Escherichia coli O104:H4 törzset lizáló terápiás bakteriofág jelölt kiválasztása és jellemzése. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). A fágterápia klinikai vonatkozásai. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., et al. (2018). De novo DNS-szintézis polimeráz-nukleotid konjugátumokkal. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., and Lu, T. K. (2016). Genetikailag módosított fágok: az elmúlt évtizedben elért eredmények áttekintése. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). A fágterápiás paradigma: prêt-à-porter vagy sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). A magisztrális fág. Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Vírusok az egypetéjű ikrek és anyáik székletmikrobiótájában. Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P., and Noireaux, V. (2018). Fertőző T4 bakteriofág sejtmentes TXTL-szintézise egyetlen kémcsőreakcióban. Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Személyre szabott bakteriofág-alapú terápiás koktélok kifejlesztése és alkalmazása egy disszeminált rezisztens Acinetobacter baumannii fertőzésben szenvedő beteg kezelésére. Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z., and Morris, J. G. Jr. (2001). Bakteriofág terápia. Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Vírusok: a Föld legnagyobb biodiverzitásának feltárása. Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., and Sommer, A. P. (2005). A bakteriális fertőzések racionális kezelése felé a hosszabb űrutazások során. Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B., and Sunyaev, A. (2020). Elosztott főkönyvi technológia a genomikában: felhívás Európának. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). Régi dogma, új trükkök – 21. századi fágterápia. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Az ISP bakteriofág mikrobiológiai és molekuláris értékelése a Staphylococcus aureus elleni küzdelemben. PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J. P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Az európai szabályozási keret optimalizálása a fenntartható bakteriofágterápia számára a humán gyógyászatban. Arch. Immunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L., and Wang, H. (2013). Az emberi eredetű gyógyászati termékek globálisan egységes kódolási rendszerei. Bull. World Health Organ. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., and Qimron, U. (2017). A bakteriofág részecskék gazdatest-tartományának kiterjesztése a DNS-transzdukcióhoz. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar