Mi a lutetium
A lutetium (ejtsd: loo-TEE-shee-em) egy ezüstös, kemény, sűrű ritkaföldfém, melyet a lantanidák közé sorolnak és a Lu kémiai szimbólummal jelölnek. A lantanidák sorozatába tartozó utolsó kémiai elem, amelynek a természetben legnagyobb mennyiségben előforduló, stabil izotópja a 175Lu (97,4%-os gyakorisággal). Egy másik hosszú élettartamú radioaktív izotóp, a 176Lu felezési ideje 3,78 X 1010 év .

Lutétium Jelkép
Hol található a lutétium
A lutétiumot a többi lantanidához hasonlóan a kereskedelemben a monazit ásványból nyerik . Mivel a monazitban kis mennyiségben fordul elő (kb. 0,003%) , kivonása nehézkes lehet, és vízmentes fluorid redukciójával történik kalciumfém felhasználásával. Bár az elem nyomokban szinte minden ittriumot tartalmazó ásványban megtalálható, ezek a lutécium természetes forrásainak tekinthetők. A 3 legnagyobb lutéciumtermelő ország Kína, Oroszország és Malajzia, míg a 3 legnagyobb tartalékkal rendelkező ország Kína, a FÁK-országok és az USA .

Lutécium
Története
A név eredete:
Az elem neve a római “Lutetia” szóból származik, amely a franciaországi Párizs városának ókori neve.
Ki fedezte fel: Bár Georges Urbain francia kémikus, Charles James amerikai kémikus és Carl Auer von Welsbach osztrák tudós egymástól függetlenül fedezte fel az elemet, a felfedezés érdeme Urbain-t illeti, mivel ő számolt be legkorábban az eredményekről .
Mikor és hogyan fedezték fel
Az 1794-ben felfedezett gadolinit vagy ittrium ásványból származik az ittrium, terbia, erbia és más ritkaföldfémek . A svájci kémikus Jean Charles Marignac elválasztotta az erbia két összetevőre, köztük az ytterbiára és az erbia-ra, amelyből az ytterbiát az ytterbium vegyületének hitték .
1907-ben Georges Urbain a párizsi Sorbonne-on végzett kísérletek során sikeresen izolálta az ytterbiát két elemre, amelyeket luteciumnak és neoytterbiumnak nevezett el . Ezeket az elemeket azonban később a kémikusok átnevezték lutetiumnak, illetve ytterbiumnak . Carl Auer von Welsbach elválasztotta az elemet az ytterbiumtól, és a Cassiopeia cirkumpoláris csillagkép után cassipoiumnak nevezte el . Charles James is sikeresen kivonta az elemet a New Hampshire-i Egyetemen .
Bár nehéz előállítani, 1953-ban sikerült tiszta lutécium fémet előállítani .
Lutécium azonosítása |
|||
| Atomiaszám | 71 | ||
| CAS szám | 7439-94-.3 | ||
| Pozíció a periódusos rendszerben | csoport | periódus | blokk |
| Lantanidák | 6 | f | |

Helyszín A lutécium helye a periódusos rendszerben
A lutécium tulajdonságai és jellemzői
Általános tulajdonságok |
||||||||||||||||
| Atomi tömeg | 174.967 amu | |||||||||||||||
| Relatív atomtömeg | 174.967 | |||||||||||||||
Fizikai tulajdonságok |
||||||||||||||||
| Szín | ezüstfehér | |||||||||||||||
| olvadáspont/fagyáspont | 1663 °C, 3025 °F | |||||||||||||||
| Fűtőpont | 3402 °C, 6156 °F | |||||||||||||||
| Sűrűség | 9.84 g cm-3 | |||||||||||||||
| Az anyag állapota szobahőmérsékleten (szilárd/folyékony/gáz) | Szilárd | |||||||||||||||
| Keménység | ||||||||||||||||
| – Brinell | 893 MPa | |||||||||||||||
| – Mohs | 2.6 | |||||||||||||||
| – Vickers | 1160 MPa | |||||||||||||||
| Elektromos vezetőképesség | 1.8X106 S/m | |||||||||||||||
| Thermikus (hő)vezetőképesség | 16 W/(m K) | |||||||||||||||
| Specifikus hő | 154 J kg-1 K-1 | |||||||||||||||
| Ömlesztő modulus | 47.6 GPa | |||||||||||||||
| Nyírási modulus | 27,2 GPa | |||||||||||||||
| Young modulus | 68.6 GPa | |||||||||||||||
| Gőznyomás | ||||||||||||||||
| – Hőmérséklet (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Nyomás (Pa) | – | – | – | 3.28X 10-11 | 1.59X 10-7 | 6.79X 10-5 | 6.28X 10-3 | 0.211 | 3.18 | 26.7 | – | |||||
Kémiai tulajdonságok |
||||||||||||||||
| Oxidációs állapotok | 3 | |||||||||||||||
| Izotópok | Izotóp | tömeg | Sűrűség | Hal-élettartam | Bomlási mód | |||||||||||
| 175Lu | 174.941 | 97.40 | – | – | ||||||||||||
| 176Lu | 175.943 | 2.60 | 3.73 X 1010 év | β-
β+ EC |
||||||||||||
A lutécium (71. elem)
| Valencia. elektronok | 3 | |||||||
| Kvantumszámok | 2D3/2 | |||||||
| Elektronkonfiguráció (nemesgázkonfiguráció) | 4f145d16s2 | |||||||
| Atomszerkezet | ||||||||
| – Az elektronok száma | 71 | |||||||
| – A neutronok száma | 104 | |||||||
| – Protonok száma | 71 | |||||||
| Atomsugár | ||||||||
| – Atomsugár | 2.24 Å | |||||||
| – Kovalens sugár | 1,74 Å | |||||||
| Elektronegativitás (Pauling-skála) | 1,0 | |||||||
| Elektronaffinitás | 32.81 kJ mol-1 | |||||||
| Ionizációs energia (kJ mol-1) | 1. | 2. | 3. | 4. | 5. | 6. | 7. | 8. |
| 523.516 | 1341.1 | 2022.275 | 4365.96 | 6445.2 | – | – | – | |
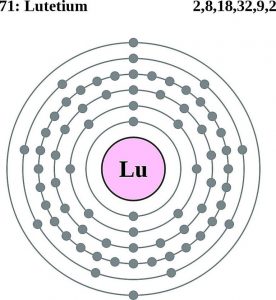
Lutécium elektronkonfiguráció (Bohr modell)
Mire használják
A tudományos kutatáson kívül kevés gyakorlati haszna van . A lutécium néhány kereskedelmi felhasználása az alábbiakban szerepel:
- Az olajfinomítókban kőolajtermékek krakkolásának katalizátoraként használható .
- A lutécium-177-dotatáttal végzett radioimmunoterápiát a rák kezelésének egyik formájaként használják, míg a lutécium-176-ot meteoritok radiometrikus kormeghatározására használják .
- A lutécium-oxi-ortoszilikátot PET (pozitron emissziós tomográfia) detektorokban használják orvosi vizsgálat elvégzésére, hogy 3D képet készítsenek a testben lévő sejtek aktivitásáról .
lehetséges egészségügyi hatások
A lutécium alacsony toxicitású és nincs ismert biológiai funkciója az emberi szervezetben ; bár úgy gondolják, hogy képes az anyagcsere fokozására. Úgy vélik, hogy robbanásveszélyes is .
Érdekes tények
- A lítium a lantanidák csoportjának legkeményebb és legsűrűbb eleme .
- Vegyületekben általában háromértékű állapotában, Lu3+ -ban fordul elő .
- Az elemet néha Párizs címerén alapuló képpel ábrázolják vizuálisan .
A lutécium ára
A lutécium tiszta formája grammonként körülbelül 350 dollárba kerül , de ömlesztve 100 grammonként körülbelül 7000 dollárba kerül .
- http://www.rsc.org/periodic-table/element/71/lutetium
- https://education.jlab.org/itselemental/ele071.html
- https://www.livescience.com/38425-lutetium.html
- https://www.webelements.com/lutetium/isotopes.html
- https://www.chemicool.com/elements/lutetium.html
- http://periodictable.com/Elements/071/data.html
- http://web.newworldencyclopedia.org/entry/Lutetium
- https://hobart.k12.in.us/ksms/PeriodicTable/lutetium.htm