はじめに
この論文は、ファージ療法が抗菌剤の主流としてついにブレイクするために何が必要であろうかという私見を提供するものである。 この論文は、ファージ療法の分野における歴史的、最近の失敗や不確実性に影響され、明日の科学と社会のモデルとなるような、未来と新興の技術に基づく解決策を見出すことを目的としています。 太古の昔から、ファージは宿主である細菌の増殖や拡散を制御してきました。 細菌ウイルスは、我々の生物圏で最も普遍的な生命体である。 海には、宇宙の星の数よりも1000万倍も多いウイルスが存在すると推定され、地球上のすべてのファージを積み重ねると、この塔は最も近い60個の銀河よりも遠くまで伸びることになる(Suttle, 2013)。 ファージは、下水道や河川、患者の尿や便など、細菌が繁殖する場所ならどこでも簡単に見つけることができる。 ヒトの細菌性病原体のファージは、多くの場合、タンパク質でできた20個の平らな面を持つ球体である正20面体の頭部と、核酸ゲノムを含むタンパク質尾部で構成されている。 厳密に溶菌するファージが尾部の繊維とトゲで標的細菌の表面に付着すると、注射器状の尾部鞘が収縮して尾部芯が細菌細胞壁を貫通し、ファージゲノムが細菌細胞のペリプラズムに注入される。 すぐに、細菌のDNAとタンパク質合成機構が乗っ取られ、ファージのコピーが作られる。 ファージによっては、細菌のDNAを断片的に切断するものもある。 数分から数時間の潜伏期間の後、新たに形成されたファージは宿主である細菌から飛び出し、その過程で細菌は死滅する。 ファージの子孫は、細菌1匹につき数百匹になることもあり、その後、感染する新しい宿主細菌を見つけに行く。 このように、ファージは自己複製する抗菌剤と考えることができる。 重要なことは、ファージは特定の標的細菌にのみ感染するように進化しており、哺乳類の細胞には無害であることです。
抗菌作用を持つウイルス様物質の初期の証拠は、イギリスの細菌学者フレデリック・トウォートとフランス・カナダの微生物学者フェリックス・デレルによって、それぞれ1915年と1917年に報告されました (Sulakvelidze et al., 2001)。 1919年、d’Hérelleは、パリで赤痢に苦しむ少年を治療するためにファージを使用し、初めてファージの治療能力を活用した。 ファージ療法は直ちに細菌感染症の治療法として認識され、ヨーロッパのL’Oréalや米国のEli Lilly Companyなど複数の企業によってファージ療法製剤の商品化が行われました(Sulakvelidze et al.、2001年)。 1923年、グルジアの微生物学者Giorgi Eliavaは、グルジアのトビリシにファージ療法研究に専念するEliava研究所を設立しました。 これが旧ソ連邦における大規模なファージ療法の研究開発の始まりとなった。 しかし、初期のファージ療法は信頼性に欠けることが多く、また、抗生物質の研究も進んでいた。 第二次世界大戦中にペニシリンの使用が成功し、その後世界的に販売されたため、西側の科学者はファージ療法への関心を失ってしまった。 一方、ソ連の研究者たちはファージ療法の開発を続け、その成果を発表していましたが、鉄のカーテンのために彼らの知識や経験が世界に広まることはありませんでした(Sulakvelidze et al.、2001)。 第3のミレニアムの幕開けに、抗生物質耐性菌による感染症の健康への負担の増加(Cassini et al, 2019)は、細菌感染症の臨床管理への実行可能な追加ツールとして、ファージ療法への新たな世界的関心を煽りました(Thiel, 2004)。 世界中でファージ療法センターが設立され、エリアバ研究所やポーランド、ヴロツワフのヒルシュフェルド研究所のファージ療法ユニットに続いています(Miêdzybrodzki et al.)。 589>
2035年
未来の地球は、人間の過剰人口、大きな生態系の破壊、地球温暖化、外国人嫌いを特徴とする陰鬱な世界です。
お風呂に浸かっているとき、退職した微生物学者であるジョン・イヴェリアン博士は、突然、首の後ろに非常に痛い刺痛を感じ、その後小型飛行機のプロペラのような音が聞こえました。 彼は環境をスクリーニングし、視線の先には、長い不気味な脚とアンテナを持つ奇妙な大型昆虫が、彼のデザイナーズ・バスタブの横の壁に座っているのを見たのである。 アントワープ中心部にあるイヴェリアンのロフトの住宅管理システム「Osuri」が、この虫を世界中に広がっているヒメカメムシHalyomorpha halysと特定したのである。 バスルームのビデオスクリーンに映し出されたオスリの報告によると、噛まれた人は、まず噛まれた部分に小さな赤い痛みを感じるとのことだった。 放置しておくと、その傷口が腫れて膿が出る。 疲れてムカムカしていたイヴェリアンは、風呂から上がってベッドに入った。 大栗から強く勧められた手の込んだ傷の処置はしないことにしていた。 しかし翌朝、噛まれた傷口は壊死しており、明らかに感染の兆候があった。 BEAMは「Bedside Energized Anti-Microbial (ベッドサイド・エネルギー化抗菌剤)」の略である。 その装置は、靴箱のような大きさと形をしていたが、よりエレガントで洗練された外観をしていた。 継ぎ目のない白いホーローの箱の側面には、カラフルな文字で機器名とメーカー名がデザインされている。 イヴェリアンは、滅菌包装された綿棒を取り出し、傷口全体にそっと当てて、傷口の滲出液が綿棒の綿毛の先を十分に濡らすのを確認した。 綿棒が箱の「サンプル投入口」に近づくと、魔法のように小さな扉が開き、マーシャという名の検査技師の高さ10インチのホログラムが現れました。 彼女は、イヴェリアンにサンプルを入れる場所を教えた。 マーシャは、クライアントの検査手順を案内するために開発された。 「最高の結果を得るために、新しいファージ・バイオインクカートリッジを挿入してください、イヴェリアン博士」とマーシャは言った。 往年の2Dプリンターがそうであったように、バイオインクカートリッジのコストは、Phage-BEAM装置本体のコストとほぼ同じであった。 Business Insider」によると、ファージ・バイオインクは、シャネルNo.8に次いで地球上で2番目に高価な液体だったそうだ。 幸運なことに、発明者の一人であるイヴェリアンは、試薬の継続的な供給を含め、この装置の最新版を常に無料で手に入れる権利を得ていた
イヴェリアンは装置の仕組みを完全に理解していたので、マーシャの助けは必要なかった。 まず、綿棒の先端からDNAを抽出し、メタゲノム(感染した細菌を含む、サンプルに存在するすべての遺伝物質)を決定する。 次に、これらの遺伝子データを安全な「Phage XChange」サーバーに送り、複雑なAI駆動のアルゴリズムによって、メタゲノムで特定された感染細菌を溶解する可能性が最も高く、患者の免疫反応を最も弱めるはずのファージのゲノム配列が予測されます。 ファージゲノムデータはPhage-BEAM装置に送られ、装置はまずファージゲノムを合成し、次に独自の無菌ファージ生産システムを用いてファージを合成した。
サンプリングから1時間以内に、装置はすぐに使える治療用ファージ製品を生産する。 その結果は、イヴェリアンのリビングルームにある巨大なホームビデオに映し出される。 LC2のアームチェアーに座り、モーツァルトのハ短調ミサ曲を聴きながら、イヴェリアンは結果が出るのを心待ちにした。 嫌な予感がした。 結果は、イヴェリアンの背筋をゾクゾクとさせた。 病原体の細菌が特定されました。 Streptococcus pyogenes(ストレプトコッカス・ピオゲネス)FE-2033株!」。 オスリはすぐに感染警戒プロトコルを発動し、世界疾病管理センターにメッセージを送り、2033年以降、公衆衛生に対する差し迫った脅威とされる致死性の肉食バクテリア株に関する気になる背景情報を映し出した。 イヴェリアンは一瞬、感染した傷口と周囲の健康な組織を包丁で切除することを考えたが、落ち着いて、差し迫ったPhage-BEAM製品を塗布して待つことにした。 1時間後、Phage-BEAM装置は合成ファージを生成していた。 このファージを検証用モジュールで、分離した細菌と混合し、試験管内でその効果を検証した。 15分後、Iverianに治療開始の指示が出された。 Iverianは、Phage-BEAM装置で生成された濃縮ファージ懸濁液と最初に混合し、相乗効果のある抗生物質を含んだ徐放性ハイドロゲルベースの創傷被覆材にファージを塗布しました。 ハイドロゲルは一時的に痛みを和らげ、それがさらに彼を落ち着かせた。 Iverianは、ファージと抗生物質入りのハイドロゲルを1日1回繰り返し塗布した。 傷口の感染は24時間以内に改善され、7日後には傷口はほぼ完全に治癒した。 イヴェリアンの生命を脅かす可能性のあった感染症は、タイムリーに、しかも自宅を離れることなく治療に成功したのです。 しかし、これまで何十年もの間、ファージ療法が広く応用され、臨床的に有用な抗菌ツールになるかどうかは定かでなかった。 ファージ療法が抗生物質療法と同じである必要はなく、活性物質であるファージの特殊性によるものだと理解するまでに、医学界はしばらく時間を要したのです。 まず、感染する細菌が特異的である傾向がある。 よくて1つの細菌種のかなりの部分をターゲットにするが、悪くても1つの細菌種の中の少数の株だけに感染する。 したがって、治療用ファージは、主に1つの細菌種または臨床的に関連するそのサブグループを死滅させ、患者の有益な細菌(例えば、腸、皮膚、口腔内の常在菌叢)を残すように選択することが可能である。 これに対し、日常的に使用されるほとんどの抗生物質は、幅広い活性スペクトルを有するため、患者の常在細菌叢に「付随的なダメージ」を与え、その結果、抗生物質耐性菌種(例えば、Clostridium difficile)の選択または抗生物質関連下痢などの副作用が生じる可能性がある(Jernberg et al.、2010)。 ファージ特異性の欠点は、ファージ療法を開始する前に感染する細菌を特定する必要があることである。 一方、経験的抗生物質療法では、一般的に、多数のグラム陽性菌、グラム陰性菌、および多様な真菌に作用する広域スペクトル抗生物質カクテルが使用されています。 より多くの情報が得られた場合(たとえば、細菌培養から)、病気の原因として同定された細菌または真菌をより具体的に標的とする狭スペクトルの抗生物質による治療が行われることもあります
第二に、細菌とファージは宿主-寄生関係に関与しています。 厳格な溶菌性ファージは環境中に遍在しており、そのライフサイクルを完了するためには、細菌を宿主として死亡する必要がある。 宿主がいなければ、ファージは存在できない。 ファージは耐性宿主を選択し、耐性宿主は有効なファージを選択する。 この結果、「拮抗的共進化」と呼ばれる、細菌とファージの間の軍拡競争が起こり、細菌の耐性とファージの感染力が相互に進化することが特徴となっている(Buckling and Rainey, 2002)。 ほとんどの抗菌薬と同様に、細菌もこのようにファージに対して耐性を持つようになるが(Luria and Delbrück, 1943; Schooley et al., 2017)、静的な抗生物質とは対照的に、ファージは細菌の耐性を克服する能力を持っている(Buckling and Rainey, 2002)。 それにもかかわらず、細菌とファージがそれぞれの耐性と感染力を無限に高めることはないという指摘がある(Fortuna et al., 2019)<589><2468>ファージ療法アプローチ<8702><2295>2000年代初頭のファージ療法復活の時点では、2種類のファージ療法アプローチが開発されていた(Pirnay et al.、2011)。 One-size-fits-all アプローチと呼ばれるものでは、特定の感染症の原因と疑われる細菌の大部分を標的とすると想定される、定義された広域スペクトルファージカクテルが適用されました。 これらの定義された広域ファージカクテルは、抗生物質のような「静的」な薬剤に対応するように設計された現行の薬理経済モデルの中で開発、製造、試験されたものである。 しかし、感染症でよく見られるグラム陽性菌やグラム陰性菌のほとんどに活性を示す真に広域スペクトルのファージカクテルは、大量のファージを含む必要があり、開発が非常に困難であることが判明しました。 しかし、感染する菌種があらかじめ分かっていれば、特定の適応症に使用するために、1種類または数種類の菌種に活性を示す、より狭いスペクトルのファージカクテルを開発することは可能であった。 黄色ブドウ球菌のような一部の細菌種については、非常に広い宿主範囲を示すファージが単離され、特性評価されています(Vandersteegen et al.、2011)。 無作為化比較試験であるPhagoBurnでは、熱傷における緑膿菌の負担の持続的減少を達成する成功は、ファージカクテルに対する初期の感受性に関連していた(Jaultら、2019年)。 しかし、含まれる患者の3分の1は、12以上の溶解性緑膿菌ファージからなるファージカクテルに耐性のある既存の緑膿菌株を保有していることが示された。 また,当初有効であると考えられたファージカクテルは,ファージ耐性の出現や新たに循環している臨床関連株の関与により,定期的に更新(新しいファージの補充など)する必要があった。 また、高濃度の固定ファージカクテルを細菌に投与すると、抗生物質の大量使用時と同様に、病院や環境中に細菌ファージ耐性が出現、拡散、定着する可能性があることも分かっていませんでした。
個別化ファージ療法の概念では、1つまたは複数のファージがファージバンク、または環境から選択され、場合によっては、患者の感染部位から分離された細菌により効率的に感染するように適応(感染力の増加を示すファージ変異体のin vitro選択)された(Friman et al, 2016). 一部のファージ療法センターでは、大規模な治療用ファージバンクを設置・維持し、定期的に新しいファージで更新し、常に変化する細菌集団にバンクの宿主範囲を広げ、適応させていました。 個別化されたファージ療法は、感染する細菌のみを対象とするため、細菌のファージ耐性に対する淘汰圧が小さく、持続可能性が高い可能性があった。 しかし、細菌株とそれに適合するファージを世界中に送る必要があるため、一人一人に合わせたアプローチに比べ、より精巧でロジスティックに複雑なものとなっていた(図1)。 さらに、精密医療の概念は、一般に、ほとんどの医薬品(米国では医薬品)の開発およびライセンス供与の経路とは相性が悪く、完了までに数年および数百万ユーロ(ドル)を必要とし、これはバンク内のすべてのファージに対して行われます(Verbeken et al.、2012)。 2015年から2020年にかけての臨床応用を視野に入れた、ブリュッセルのクイーンアストリッド軍事病院(QAMH)からのファージの国際移転(赤矢印)およびブリュッセルへのファージの移転(青矢印)である。 国内レベルでは、QAMHから5つの大学病院へファージが派遣された(図示せず)。 さらに、適合するファージの選択には、患者の分離菌の移送を伴うことが多く、5人の外国人患者(フランスから2人、オランダから2人、チュニジアから1人)がファージ療法のためにブリュッセルに移送された。 structure-guided design)(Pires et al., 2016; Dunne et al., 2019)。 例えば、ファージ尾部繊維タンパク質スイッチングのための酵母ベースのプラットフォームは、より予測可能で拡張された宿主範囲を持つハイブリッドファージを設計するために精巧に作られました(Ando et al., 2015; Yosef et al., 2017)、遺伝子工学戦略(例えば, CRISPR-Cas編集ツール)が開発され、患者-ファージ間の負の相互作用(例えば、抗ファージ免疫反応)(Brownら、2017)、細菌ファージ耐性機構の潜在的出現と拡散、およびエンドトキシンなどの有害細菌内容物の放出(Hwangら、2018)などの他の局面に対処するために開発されました。 合成ファージゲノムは、大腸菌またはリステリア菌L-フォームの形質転換(Kilcherら、2018)、または無細胞転写-翻訳(TXTL)システム(Rustadら、2018)を使用して、ファージ子孫を生成するために再起動する必要があった(Barbuら、2016、Piresら、2016)。 欧米の規制枠組みは、天然由来のファージ(Pirnayら、2018)、工学的ファージ(Dedrickら、2019)、および合成ファージを用いた精密および個別化ファージ療法アプローチに徐々に対応し始めていました
Phage-BEAMなどのアドホックおよびオンサイト治療ファージ生産装置の開発は、スムーズに行われなかったとIverianは回想しています。 そもそも、人工知能(AI)に基づくインシリコでのファージマッチングと設計が必要だったのだ。 細菌ゲノムと感染ファージゲノム間のリンクの検索には、より大きなサンプル数に拡張しやすいことから、Machine LearningのサブセットであるDeep learning(Martorell-Marugán et al.、2019)が選ばれた。 例えば、深層学習法は、ファージと細菌ゲノムの遺伝子/タンパク質レベルのアノテーションを必要とする、いわゆる特徴抽出を必要とせず、ファージの尾繊維構造が特定の細菌細胞壁受容体に結合するなど、細菌とファージの特徴間の特定の既知の関係に予測を限定することができました。 その一方で、溶解性ファージゲノムと宿主細菌ゲノムを結びつけるために、膨大な量のデータを継続的に供給する必要があり、そこで靴がつまづくことになったのです。 全ゲノムシークエンスは臨床微生物学の実践に徐々に浸透していましたが(American Academy of Microbiology, 2016)、研究機関や製薬会社は単一の集中データベースにデータを提出することに熱心ではなく、利用可能なデータを取得し、かつ/または十分な量の新しいデータを作成する意思と能力を持つ投資家は見つかりませんでした。 第二に、大きなDNA分子を迅速、確実、安価に合成する手段がなかったことである。 初期のDNA合成技術は有機化学に基づくもので、比較的小さなDNA分子を合成するものでした。 ファージゲノムのde novo合成は、酵母人工染色体(Andoら、2015)、または化学的アセンブリ(Gibsonら、2009)を使用して、酵母Saccharomyces cerevisiaeでいくつかのゲノム断片(Barbuら、2016、Piresら、2016、Lemireら、2018)を組み立てる必要がありました。 免疫系の細胞に存在するDNA合成酵素を利用した新しいDNA合成技術の開発(Palluk et al.、2018)により、ファージゲノム合成が促進された。 最後に、高力価でファージを生産し、その天然アナログと同じレベルの細菌感染性を示すことができる汎用無細胞ファージ生産システムを開発するために、いくつかのハードルを克服しなければなりませんでした
The Breakthrough
大きな問題は、治療上許容できるレベルの精度でファージ配列を予測および/または設計するために深層学習AIアルゴリズムに必要な、リンクした大量のファージおよび細菌ゲノム配列を集めることが非常に難しいことが明らかになったことでした。 イヴェリアンは、非営利団体「Phage XChange」が効率的、標準化、持続可能、倫理的なファージサプライチェーンを構築するために、同名のグローバルファージガバナンスプラットフォームを立ち上げたときに、真のブレークスルーが訪れたと回想している(図2)。 Phage XChangeは主にAIモジュールと分散型台帳(DL)で構成されている(Thiebes et al.、2020)。 プラットフォームのAIモジュールは、リンクされたファージと細菌のゲノムを解析し、クライアントのために強力なファージを予測・設計するものであった。 また、モノのインターネット(IoT)やビッグデータ、世界保健機関(WHO)や各国の疾病管理センターなどの国際的な公衆衛生機関から提供された情報に基づいて、どの細菌病原体が最も緊急な注意を要するかを予測しました。 これらのデータは、最も緊急に必要とされるファージの単離と特徴づけに向けてシステムを誘導しました。
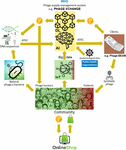
Figure 2. 2035年にファージサプライチェーンがどのように組織化されるかのビジョン。 AI、人工知能、ATGC、DNA配列、BEAM、ベッドサイド通電式抗菌剤、DL、分散型台帳、IoT、モノのインターネット、P、ファージコイン、WHO、世界保健機関。
プラットフォームのDLモジュールは、名古屋プロトコルの規定に準拠し、AIモジュールへのリンクしたファージ/細菌ゲノム配列の十分かつ定性的で記録された入力と、クライアントへのファージ配列の同上の供給を保証しました(Expert round table on acceptance and re-implementation of bacteriophage therapy et al, 2018). DLは、すべてのステークホルダー(データの供給者、配列決定サービス、クライアントなど)、取引、契約の詳細を不変に記録した。 また、供給された材料の正確な品質、仕様、重量も記録された。 アルゴリズムは、冗長性がないことを判断し、提出された材料の重み(例えば、ファージの毒性および宿主範囲)および望ましさを推定しました。 新興の細菌性病原体を標的としたファージは、もちろん最も望まれていた。 特許の問題はほとんど回避された。 DLは、すべての関係者が適時かつ公正に支払われることを保証するための支払い台帳として機能した。 多くのPhageCoin(プラットフォームの暗号通貨)が、供給された材料の品質、重量、および望ましさに関連して供給者に帰属した。 DLを通じて予測結果(ファージ配列)を抽出する顧客は、ファージの推定価値に比例した額のPhageCoinを支払った。 このPhageCoinは、DLを維持し、十分かつ継続的に材料を供給するため、また、ファージの病原性や宿主範囲データの拡張(ファージと細菌のマッチング)のために使用された。 さらに、資金を投入し、材料を供給するインセンティブとなったのは、あらゆる種類の商品の生産者と供給者であった。 ファージサプライヤーは、即座に得られるファージコインを使って、実験室や学校の備品からスポーツ用品まで、あらゆる種類の製品をオンラインで格安に購入することができた。 これらの商品は、企業のスポンサーシップによって提供された。 いくつかの企業は、減税、宣伝、社会的責任のあるブランドのイメージと引き換えに、PhageXchangeのスポンサーになった。 供給された材料の重量、したがってその価値も、当初は過小評価されていたが、一定期間ごとに再評価され(イテレーション)、供給者は正当な理由があればより多くのファージコインを帰属させることができた。 導入された瞬間から有用であったにもかかわらず、このプラットフォームが本当に成功したのは、ヒト由来医薬品のトレーサビリティ、透明性、警戒、監視に関する世界的なシステム(Warwick et al, 2013)と同様に、WHOの保護下に置かれたときです。 Phage XChangeとWHOの間の正式な合意は、プラットフォームの長期的な持続可能性と非倫理的な商業的利用からの保護に対する国際的な信頼性を高めました。 強力な治療用ファージの探索は、すぐに抗生物質耐性の危機を解決するためのコミュニティの取り組みとなり、独立した「ファージハンター」、学校、スカウトグループ、アマゾン川のほとりの村などが、ファージを分離してPhage XChangeに提出し、ファージコインと引き換えに交換するようになったのです。 その縁で、さまざまな企業や機関が、ファージ分離キットやシーケンシング、ファージ合成プラットフォーム(Phage-BEAM装置など)といった周辺機器やサービスを開発した。 これらの装置を見越して、ファージそのものをDLして入手するという中間的なソリューションが提供された。
Epilog
ファージ療法の将来についてのこの見解は、抗生物質耐性危機に対して楽観的な結末を与えるものである。 合成ファージをその場で生産し、グローバルなコミュニティベースのファージ管理システムにリンクさせることで、抗生物質耐性菌感染症との戦いにおいて、歓迎すべき、(社会保障制度にとって)手頃な追加武器となることが判明したのである。 しかし、これは魔法の弾丸ではなく、既存の抗菌剤との相乗効果による補完的なものであった。 合成ファージの即時無細胞生産は、設計されているかどうかにかかわらず、(細菌宿主で)古典的に生産された天然ファージに比べてかなりの利点を持っていました。
(ii) 2011年にドイツで発生した大腸菌O104:H4のような、公衆衛生上の脅威を顕著に引き起こす細菌に対する合成ファージ (Merabishvili et al., 2012)、またはバイオテロに使用される(と疑われる)細菌(Joñczyk-Matysiak et al, 589>
(iii) 非致死的生産宿主株が入手できず、その増殖にバイオセーフティレベル3(bsl-3)のバイオ封じ込め予防措置が必要であった、潜在的に致死的疾患を引き起こす細菌に対するファージが、bsl-1条件で合成されうる。
(iv)サンプリングサイトからファージを単離できなかった場合、例えば、単離技術に使用した細菌宿主株が所望のファージに対して感受性がないため、メタゲノムデータから抽出した(予測)ファージゲノム配列(Reyes et al, 2010; Amgarten et al., 2018)、合成ファージの生産に使用することができた。
(v)合成ファージ製剤は、患者に悪影響を及ぼす可能性のある分子(エンドトキシンなど)を含まない(または量が少ない)。
(vi) 長期宇宙旅行や宇宙植民地化の際に合成ファージを生産するためにデバイスが適応された(Taylor and Sommer, 2005)
これらの予想が実現する機会はほとんどないだろう。 公衆衛生団体の支援を受け、グローバルで持続可能かつ倫理的なプラットフォームによって管理されるコミュニティベースの取り組みが、現在の世界的な抗生物質耐性の危機に対する解決策の中心になりうると考えるのは、おそらくあまりにも近視眼的なことだろう。 このシステムの提案には、ベッドサイドの装置を使った合成ファージの無細胞生産など、実現する可能性が十分にあるものもあれば、企業のスポンサーシップなど、SFの領域にとどまる可能性のあるものもあります。 私は夢想家だと言われるかもしれませんが、2035年に私を起こして現実を突きつけてください!
Author Contributions
J-PP はビジョンを考え、原稿を書いた。
Funding
出版費用は「Societe Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst」から負担していただいた。
Conflict of Interest
著者は、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する。
担当編集者は著者との過去の共著を宣言する。
Acknowledgements
この原稿で展開した個人のビジョンまたは夢は過去15年間に多くの仲間の研究者と交流した結果もたらされた。 彼らの名前をすべて挙げることは不可能であるが、一人ですべての功績を挙げるのはフェアではないだろう。 そこで、重要な影響力を持つ研究者を忘れてしまうリスクもあるが、ここにその何人かに謝意を表したい(アルファベット順)。 Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili.各氏のお名前は、アルファベット順です。 Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bosche, Mario Vaneechoutte, Gilbert Verbeken そして Kilian Vogele。
American Academy of Microbiology (2016). 臨床微生物次世代シーケンシングの応用. 2015年4月にワシントンDCで開催された米国微生物学会のコロキウムの報告書。 ワシントンDC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P., da Silva, A. M., and Setubal, J. C. (2018). MARVEL, a tool for prediction of bacteriophage sequences in metagenomic bins.(メタゲノムビンにおけるバクテリオファージ配列予測ツール)。 Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., and Loessner, M. J. (2018). L型細菌におけるカスタムメイドの合成バクテリオファージゲノムのクロスジェナス・リブート。 Proc. Natl.Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., and Lu, T. K. (2018)(2018. 合成生物学におけるファージベースのアプリケーション。 Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., and Delbrück, M. (1943). ウイルス感受性からウイルス抵抗性への細菌の変異。 Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine,” in Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019..ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R.、他 (2012).を参照。 2011年にドイツで発生した大腸菌 O104:H4 株を溶解する治療用バクテリオファージ候補の選択と特性評価。 PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R….., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., etc. (2012). ファージ療法の臨床的側面。 Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R.、et al. (2018). ポリメラーゼ-ヌクレオチドコンジュゲートを用いたデノボDNA合成。 Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., and Lu, T. K. (2016). 遺伝子組み換えファージ:過去10年間の進歩のレビュー。 Microbiol. モル. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M.、他 (2011).。 ファージ療法のパラダイム:プレタポルテかシュールメジュールか? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C.ら(2018年). マギストラルファージ。 Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F.、他 (2010). 一卵性双生児とその母親の糞便微生物叢に含まれるウイルス。 Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P. and Noireaux, V. (2018)(2010). 単一試験管反応による感染性バクテリオファージT4の無細胞TXTL合成。 Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). 播種性耐性アシネトバクター・バウマンニ感染患者を治療するための個別化バクテリオファージベース治療カクテルの開発および使用。 Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z., and Morris, J. G. Jr. (2001). バクテリオファージ療法。 Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013)(2013). ウイルス:地球上で最大の生物多様性を解き放つ。 Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., and Sommer, A. P. (2005). 長期宇宙旅行中の細菌感染症の合理的な治療に向けて。 Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B. , and Sunyaev, A. (2020). ゲノミクスにおける分散型台帳技術:欧州への呼びかけ。 Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). 古いドグマ、新しいトリック-21世紀のファージ療法。 Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract |Ref Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P.,など (2011). 黄色ブドウ球菌の制御を目的としたバクテリオファージ ISP の微生物学的および分子生物学的評価。 PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J. P., De Vos, D., Jennes, S., Zizi, M. , Lavigne, R.,et al. (2012). ヒト医療における持続可能なバクテリオファージ療法に向けた欧州規制枠組みの最適化。 Arch. Immunol. Ther. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T.L., and Wang, H. (2013). ヒト由来医薬品のための世界的に一貫したコーディングシステム。 Bull. 世界保健機関。 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., and Qimron, U. (2017). DNA導入のためのバクテリオファージ粒子の宿主範囲を拡張する。 Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar