Preface
Este artigo oferece uma visão pessoal do que pode ser necessário para que a phage therapy finalmente se torne uma ferramenta antibacteriana. Ele é influenciado por falhas e incertezas históricas e recentes no campo da fagoterapia e visa encontrar soluções baseadas em tecnologias futuras e emergentes que supostamente modelarão a ciência e a sociedade de amanhã.
Terapia de fagos
Bacteriófagos (fagos) são os vírus das bactérias. Desde tempos imemoriais eles têm controlado o crescimento e a propagação dos seus hospedeiros bacterianos. Os vírus bacterianos são as entidades mais ubíquas da vida na nossa biosfera. Estima-se que existam 10 milhões de vezes mais vírus nos oceanos do que estrelas no universo e se todos os fagos na Terra fossem empilhados em cima de outros, esta torre se estenderia mais do que as 60 galáxias mais próximas (Suttle, 2013). Elas podem ser facilmente encontradas onde quer que as bactérias prosperem: em esgotos, rios, ou na urina e fezes dos pacientes. Fagos de patógenos bacterianos humanos são na maioria das vezes compostos por uma cabeça icosaédrica, uma esfera com 20 faces planas feitas de proteínas e contendo um genoma de ácido nucleico, ao qual está ligada uma cauda proteica. Quando um fago estritamente lítico adere com suas fibras caudas e picos à superfície de sua bactéria alvo, a bainha da cauda em forma de seringa se contrai e o núcleo da cauda é conduzido através da parede da célula bacteriana, injetando o genoma do fago no periplasma da célula bacteriana. Imediatamente, o DNA bacteriano e as máquinas de síntese de proteínas são sequestradas para construir cópias do fago. Alguns fagos cortam o ADN bacteriano em pedaços. Após um período latente de minutos a horas, os fagos recém-formados rebentam dos seus hospedeiros bacterianos, que são mortos no processo. A prole de fagos, que pode escorrer para as centenas por bactéria, então explode para encontrar novas bactérias hospedeiras para infectar. Como tal, os fagos podem ser considerados como antimicrobianos auto-replicáveis. Importante, os fagos evoluíram para infectar apenas certas bactérias alvo e são inofensivos às células de mamíferos.
Early evidence of viral-like agents with antibacterial activity was reported by the English bacteriologist Frederick Twort, and by the French-Canadian microbiologist Felix d’Hérelle in 1915 and 1917, respectively (Sulakvelidze et al., 2001). Em 1919, d’Hérelle explorou pela primeira vez o potencial terapêutico dos fagos quando os utilizou para curar um rapaz que sofria de disenteria em Paris. A fagoterapia foi imediatamente reconhecida como uma abordagem terapêutica para tratar infecções bacterianas e a comercialização de preparados de fagoterapia foi realizada por várias empresas, como a L’Oréal na Europa e a Eli Lilly Company nos Estados Unidos (Sulakvelidze et al., 2001). Em 1923, o microbiologista georgiano Giorgi Eliava fundou o Instituto Eliava em Tbilisi, Geórgia, dedicado à pesquisa de fagoterapia. Foi o início de uma extensa pesquisa e desenvolvimento da fagoterapia na antiga União Soviética. No entanto, os primeiros usos da fagoterapia muitas vezes não eram confiáveis e a pesquisa de antibióticos também estava em andamento. O uso bem sucedido da penicilina durante a Segunda Guerra Mundial e o seu subsequente marketing mundial levaram os cientistas ocidentais a perder o interesse pela fagoterapia. Os pesquisadores soviéticos, ao contrário, continuaram a desenvolver a terapia de fago e a publicar seus resultados, mas devido à Cortina de Ferro seus conhecimentos e experiência não se espalharam pelo mundo (Sulakvelidze et al., 2001). No início do terceiro milênio, a crescente carga de infecções com bactérias resistentes a antibióticos (Cassini et al., 2019) incitou um renovado interesse mundial pela fagoterapia como uma ferramenta adicional viável para o manejo clínico das infecções bacterianas (Thiel, 2004). Em todo o mundo, estão sendo criados centros de fagoterapia, seguindo os passos do Instituto Eliava e da unidade de fagoterapia do Instituto Hirszfeld em Wrocław, Polônia (Miêdzybrodzki et al.., 2012).
O Ano 2035
Adiante para a futura Terra de 2035, um mundo sombrio caracterizado pela superpopulação humana, grandes perturbações do ecossistema, aquecimento global e xenofobia.
Enquanto estava de molho no seu banho, o Dr. John Iverian, um microbiologista reformado, de repente sentiu uma picada extremamente dolorosa na parte de trás do pescoço, seguida por um som como a hélice de um pequeno avião. Ele examinou o ambiente e, no canto do olho, viu um grande e estranho inseto com longas pernas e antenas assustadoras sentadas na parede ao lado da sua banheira de design. Osuri, o sistema de gestão doméstica do loft de Iverian, no centro de Antuérpia, identificou o insecto como o insecto marrom marmoreado Halyomorpha halys, que se tinha espalhado por todo o mundo. O relatório de Osuri, projetado em uma das telas de vídeo do banheiro, mencionou que as pessoas, que foram mordidas, inicialmente experimentaram uma pequena ferida vermelha na área da mordida de sua pele. Quando deixadas sem vigilância, a ferida da mordida incharia e produziria gatinha. Cansado e confuso, o Iverian, sem preocupações, saiu do seu banho e foi para a cama. Ele tinha decidido não realizar o elaborado procedimento de tratamento da ferida, que tinha sido fortemente aconselhado por Osuri. No início da manhã seguinte, no entanto, a mordida tinha-se transformado numa ferida necrótica mostrando sinais claros de infecção.
Ansiosamente, Iverian activou o seu aparelho Phage-BEAM. BEAM significava “Bedside Energized Anti-Microbial Energized”. O dispositivo tinha o tamanho e a forma de uma caixa de sapatos, mas com um aspecto mais elegante e polido. O nome do dispositivo e o seu fabricante foram desenhados em letras coloridas na lateral da caixa esmaltada branca sem costura. Iverian removeu um cotonete da sua embalagem esterilizada e passou-o suavemente por toda a área da ferida, certificando-se de que o exsudado da ferida molhava completamente a ponta de lã de algodão do cotonete. Quando o cotonete se aproximou da área de “inserir amostra” da caixa, uma pequena porta abriu-se como que magicamente, libertando um holograma de 10 polegadas de altura de um técnico de laboratório, chamado Marcia. Ela mostrou ao Iverian onde ancorar a amostra. Marcia foi desenvolvida para guiar os clientes através do procedimento de teste. “Para melhores resultados, por favor insira um novo cartucho de tinta biológica para fagos, Dr. Iverian”, disse Marcia. Assim como costumava ser para as impressoras 2D de antigamente, o custo dos cartuchos bio-ink era quase tão alto quanto o custo do próprio dispositivo Phage-BEAM. De acordo com o “Business Insider”, o phage bio-ink era o segundo líquido mais caro da Terra, atrás do Chanel No. 8. Felizmente, como um dos inventores, Iverian tinha obtido o direito de ter sempre à sua disposição a versão mais recente deste dispositivo, incluindo um fornecimento contínuo de reagentes, gratuitamente.
Iverian sabia perfeitamente como o dispositivo funcionava, por isso não precisava da ajuda de Marcia. Primeiro, o ADN foi extraído da ponta do esfregaço e a metagenoma – todo o material genético presente na amostra, incluindo as bactérias infectantes – foi determinado. Em seguida, esses dados genéticos foram enviados para um servidor seguro “Phage XChange”, onde um algoritmo complexo, baseado na IA, previu a seqüência do genoma do fago que mais provavelmente linzaria a bactéria infectante identificada no metagenoma e que deveria provocar a reação imunológica mais fraca do paciente. Os dados do genoma do fago foram enviados para o dispositivo Phage-BEAM, que primeiro sintetizou o genoma do fago e depois o fago, usando um sistema proprietário de produção de fago livre de bactérias.
Em 1 h após a amostragem, o dispositivo produziria um produto terapêutico de fago pronto para ser usado. Os resultados do procedimento passo-a-passo seriam transmitidos para a enorme tela de vídeo doméstico na sala de estar de Iverian. Sentado em sua poltrona LC2, ouvindo a Grande Missa de Mozart em C menor, Iverian esperava ansiosamente que os resultados chegassem. Ele tinha um mau pressentimento sobre isto. O resultado mandou calafrios pela espinha do Iverian. Patógeno bacteriano identificado: Streptococcus pyogenes estirpe FE-2033! Osuri ativou imediatamente o protocolo de alerta de infecção, enviando uma mensagem para o Centro Mundial de Controle de Doenças e projetou informações preocupantes sobre a cepa bacteriana letal que come carne, considerada uma ameaça iminente à saúde pública desde 2033. Por um momento, Iverian considerou excisar a ferida infectada e alguns tecidos saudáveis ao redor com uma faca de cozinha, mas acalmou e decidiu esperar e aplicar o iminente produto Phage-BEAM. Uma hora depois, o dispositivo Phage-BEAM tinha produzido fagos sintéticos. Estes fagos foram então misturados com as bactérias isoladas, num módulo de validação, para testar a sua eficácia in vitro. Quinze minutos mais tarde, foi dada luz verde para que Iverian iniciasse o tratamento. Iverian aplicou os fagos num penso de libertação lenta à base de hidrogel, que tinha sido misturado primeiro com a suspensão concentrada de fagos produzida pelo dispositivo Phage-BEAM, e que também continha antibióticos sinérgicos. O hidrogel aliviou temporariamente a dor, o que o acalmou ainda mais. Iverian repetiu a aplicação do fago e do hidrogel carregado com antibióticos uma vez por dia. A infecção da ferida melhorou em 24 h e após 7 dias a ferida ficou quase completamente curada. A infecção potencialmente fatal de Iverian foi tratada com sucesso, oportunamente e sem sair de sua casa. Mas, durante muitas décadas anteriores, não se tinha a certeza de que a terapia com fago se tornasse uma ferramenta antibacteriana amplamente aplicada e clinicamente útil. O mundo médico demorou um pouco para perceber que a fagoterapia não precisava ser idêntica à antibioticoterapia, e isto principalmente devido às peculiaridades dos agentes ativos, os fagos.
algumas Peculiaridades Relevantes dos Fagos
Fagos exibem uma série de propriedades que diferem dos antibióticos e dificultam o seu desenvolvimento como produtos farmacêuticos e aplicação em terapia. Primeiro, eles tendem a ser específicos sobre quais bactérias eles infectam. Na melhor das hipóteses, elas visam uma parte considerável de uma única espécie bacteriana, mas na pior das hipóteses infectam apenas um pequeno número de estirpes dentro de uma espécie. Os fagos terapêuticos podem assim ser selecionados para matar principalmente uma espécie bacteriana, ou um subgrupo dela clinicamente relevante, e poupar as bactérias benéficas do paciente (por exemplo, o intestino, a pele ou a flora comensal oral). A maioria dos antibióticos empregados rotineiramente, em contraste, tem um amplo espectro de atividade, que pode causar “danos colaterais” aos microbiomas comensais do paciente, o que, por sua vez, pode resultar em efeitos adversos como a seleção de espécies bacterianas resistentes a antibióticos (por exemplo, Clostridium difficile) ou diarréia associada a antibióticos (Jernberg et al., 2010). O inconveniente da especificidade do fago é que as bactérias infectantes precisam ser identificadas antes de iniciar a terapia de fago. Na antibioticoterapia empírica, em contraste, são normalmente utilizados cocktails de antibióticos de largo espectro que afectam uma multiplicidade de bactérias Gram-positivas e Gram-negativas, e fungos diversos. Quando mais informação é conhecida (por exemplo, de cultura bacteriana), o tratamento pode consistir em antibióticos de espectro estreito, que visam mais especificamente as bactérias ou fungos identificados como causadores da doença.
Segundo, as bactérias e os fagos estão envolvidos numa relação hospedeiro-parasita. Os fagos estritamente líticos são onipresentes no ambiente e requerem a morte do seu hospedeiro bacteriano para completar o seu ciclo de vida. Sem hospedeiros, os fagos não podem existir. Os fagos impõem a selecção de hospedeiros resistentes que, por sua vez, impõem a selecção de fagos eficazes. Isto resulta no que é chamado de “coevolução antagônica”, uma corrida armamentista entre bactérias e fagos, caracterizada pela evolução recíproca da resistência bacteriana e da infectividade dos fagos (Buckling and Rainey, 2002). Assim como a maioria dos antimicrobianos, as bactérias também se tornarão resistentes aos fagos (Luria e Delbrück, 1943; Schooley et al., 2017), mas, ao contrário dos antibióticos estáticos, os fagos têm a capacidade de superar a resistência bacteriana (Buckling e Rainey, 2002). No entanto, há indicações de que bactérias e fagos não aumentarão indefinidamente sua respectiva resistência e infecciosidade (Fortuna et al., 2019).
Ataques de Fagoterapia
Na época do renascimento da Fagoterapia no início dos anos 2000, duas abordagens distintas de Fagoterapia haviam sido desenvolvidas (Pirnay et al., 2011). No que se poderia chamar de abordagem de tamanho único, foram aplicados coquetéis de fago de amplo espectro definidos, que supostamente visavam a maioria das bactérias suspeitas de causar certas doenças infecciosas. Esses coquetéis pré-definidos de fago de amplo espectro foram desenvolvidos, produzidos e testados dentro dos modelos farmaco-econômicos atuais, que haviam sido projetados para atender a medicamentos “estáticos”, como antibióticos. Contudo, os cocktails de fagos de espectro alargado, activos contra a maioria das bactérias Gram-positivas e/ou Gram-negativas comummente encontradas em doenças infecciosas, precisavam de conter grandes quantidades de fagos e revelaram-se muito difíceis de desenvolver. Era possível desenvolver cocktails de fagos de espectro mais restrito, activos contra uma ou poucas espécies bacterianas, para serem utilizados em certas indicações e tendo em conta que as espécies bacterianas infectantes eram conhecidas antecipadamente. Para algumas espécies bacterianas, como o Staphylococcus aureus, os fagos com uma gama de hospedeiros excepcionalmente ampla foram isolados e caracterizados (Vandersteegen et al., 2011). Em PhagoBurn, um ensaio aleatório controlado, o sucesso na redução sustentada da carga de Pseudomonas aeruginosa em feridas de queimadura foi ligado à susceptibilidade inicial ao coquetel de fagos (Jault et al., 2019). No entanto, foi demonstrado que um terço dos pacientes incluídos abrigavam cepas de P. aeruginosa pré-existentes resistentes ao coquetel de fagos, que consistia de nada menos que 12 fagos de P. aeruginosa lítica. Além disso, os cocktails de fagos que foram inicialmente concebidos para serem eficazes precisavam de ser actualizados regularmente (por exemplo, complementados com novos fagos) em resposta ao aparecimento de resistência a fagos ou ao envolvimento de novas estirpes clinicamente relevantes que circulassem. Finalmente, não se sabia se o confronto de bactérias com altas concentrações de coquetéis fixos de fagos causaria o surgimento, propagação e persistência de resistência bacteriana de fagos em hospitais e no ambiente, semelhante ao que tinha acontecido com o uso massivo de antibióticos.
Em conceitos personalizados de fago terapia, um ou mais fagos foram selecionados de um banco de fagos, ou do ambiente, e possivelmente adaptados (seleção in vitro de mutantes de fagos apresentando aumento de infecciosidade) para infectar mais eficientemente as bactérias isoladas do local de infecção do paciente (Friman et al, 2016). Alguns centros de fago terapia criaram e mantiveram grandes bancos de fago terapêuticos, que foram regularmente atualizados com novos fagos, ampliando e adaptando a gama de hospedeiros do banco às populações de bactérias em constante mudança. As abordagens personalizadas de fago terapia foram potencialmente mais sustentáveis, uma vez que apenas a bactéria infectante é visada, resultando em menos pressão de seleção para a resistência bacteriana do fago. No entanto, também eram mais elaboradas e logisticamente mais complexas do que as abordagens de tamanho único, com estirpes bacterianas e fagos correspondentes sendo enviados para todo o mundo (Figura 1). Além disso, os conceitos de medicina de precisão não eram, em geral, compatíveis com a maioria das vias de desenvolvimento e licenciamento de medicamentos (medicamentos nos Estados Unidos), o que exigia vários anos e milhões de euros (dólares) para ser concluído, e isto para cada fago no banco (Verbeken et al., 2012).
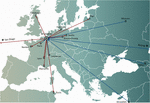
Figura 1. Transferências internacionais de fagos de (setas vermelhas) e para (setas azuis) o Hospital Militar Rainha Astrid (QAMH) em Bruxelas em vista de aplicações clínicas durante o período de 2015-2020. A nível nacional, os fagos foram expedidos do QAMH para cinco hospitais universitários (não mostrados). Além disso, a selecção de fagos correspondentes abrangeu frequentemente a transferência dos isolados bacterianos dos pacientes, e cinco pacientes internacionais (dois da França, dois da Holanda e um da Tunísia) foram transferidos para Bruxelas para a terapia com fagos.
Enter Synthetic Biology
Com o início do terceiro milénio, as abordagens da biologia sintética tinham sido cada vez mais desenvolvidas para reduzir a especificidade dos fagos e a emergência de resistência bacteriana dos fagos (por exemplo desenho orientado pela estrutura) (Pires et al., 2016; Dunne et al., 2019). Por exemplo, foram elaboradas plataformas baseadas em leveduras para a comutação da proteína da cauda da fibra de fago para a engenharia de fagos híbridos com uma gama de hospedeiros mais previsível e alargada (Ando et al., 2015; Yosef et al., 2017) e estratégias de engenharia genética (por exemplo CRISPR-Cas) foram desenvolvidas para abordar outros aspectos como as interacções negativas paciente-fágico (por exemplo, resposta imunitária anti-phage) (Brown et al., 2017), a potencial emergência e propagação de mecanismos de resistência bacteriana de fagos, e a libertação de conteúdos bacterianos nocivos como as endotoxinas (Hwang et al., 2018). Genomas sintéticos de fagos precisam ser reiniciados para produzir descendentes de fagos (Barbu et al., 2016; Pires et al., 2016), através da transformação de Escherichia coli ou Listeria monocytogenes L-forms (Kilcher et al., 2018), ou usando sistemas de transcrição-tradução sem células (TXTL) (Rustad et al., 2018). As estruturas regulatórias ocidentais começaram gradualmente a atender a abordagens de precisão e personalizadas de fago terapia usando fagos naturais (Pirnay et al., 2018), fagos artificiais (Dedrick et al., 2019), e fagos sintéticos.
O desenvolvimento de dispositivos de produção de fagos terapêuticos ad hoc e no local, tais como Phage-BEAM, não funcionou sem problemas, lembrou Iverian. Para começar, requereu inteligência artificial (IA) baseada em correspondência e design de fago silico. O aprendizado profundo (Martorell-Marugán et al., 2019), um subconjunto do Aprendizado de Máquinas, foi escolhido para procurar ligações entre genomas de bactérias e genomas de fagos infectantes, porque era mais fácil de escalar para um maior número de amostras. Por exemplo, métodos de aprendizado profundo não exigiam a chamada extração de características, o que exigiria a anotação em nível de gene/proteína dos genomas de fagos e bactérias e limitaria as previsões a certas relações conhecidas entre características bacterianas e fagos, tais como estruturas de fibra da cauda do fago ligando-se a receptores específicos da parede celular bacteriana. Como um lado negativo, precisava ser alimentado por um fornecimento contínuo de grandes quantidades de dados, ligando os genomas dos fagos líticos aos genomas das bactérias hospedeiras, e foi aí que o sapato beliscou. O sequenciamento de genomas inteiros percolou lentamente na prática da microbiologia clínica (Academia Americana de Microbiologia, 2016), mas os institutos de pesquisa e as empresas farmacêuticas não estavam interessados em submeter seus dados a uma única base de dados centralizada, e nenhum investidor foi encontrado disposto e capaz de adquirir os dados disponíveis e/ou de produzir quantidades suficientes de novos dados. Um segundo obstáculo que teve que ser superado foi a indisponibilidade de síntese rápida, confiável e acessível de grandes moléculas de DNA. As técnicas iniciais de síntese de DNA foram baseadas na química orgânica e produziram moléculas de DNA relativamente pequenas. A síntese de novo genoma fago exigiu a montagem de vários fragmentos de genoma (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) na levedura Saccharomyces cerevisiae, usando cromossomos artificiais de levedura (Ando et al., 2015), ou montagem química (Gibson et al., 2009). O desenvolvimento de uma nova técnica para sintetizar DNA, baseada em enzimas sintetizadoras de DNA encontradas em células do sistema imunológico (Palluk et al., 2018), facilitou a síntese do genoma do fago. Finalmente, alguns obstáculos tiveram que ser superados para desenvolver sistemas genéricos de produção de fagos livres de células capazes de produzir fagos em altos títulos e exibindo os mesmos níveis de infecciosidade bacteriana que seus análogos naturais.
The Breakthrough
O maior problema foi que se tornou muito difícil coletar as quantidades maciças de fagos e seqüências de genoma bacteriano ligadas, necessárias para que os algoritmos de aprendizado profundo de IA pudessem prever e/ou projetar seqüências de fagos com um nível de precisão terapeuticamente aceitável. Iverian lembrou-se que o verdadeiro avanço veio quando a organização sem fins lucrativos “Phage XChange” lançou sua plataforma global de governança de fago com o mesmo nome para criar uma cadeia de suprimento de fago eficiente, padronizada, sustentável e ética (Figura 2). Phage XChange consistiu principalmente de um módulo de IA e um Distributed Ledger (DL) (Thiebes et al., 2020). O módulo de IA da plataforma analisou os genomas de fagos e bactérias ligados para prever e projetar fagos potentes para os clientes. Também previu quais patógenos bacterianos precisavam de atenção mais urgente, com base na Internet das Coisas (IoT) e Grandes Dados e informações fornecidas por organizações internacionais de saúde pública, como a Organização Mundial de Saúde (OMS) e Centros Nacionais de Controle de Doenças. Estes dados orientaram o sistema para o isolamento e caracterização dos fagos mais urgentes.
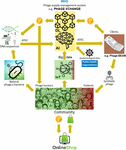
Figura 2. Visão de como a cadeia de suprimentos de fagos poderia ser organizada em 2035. IA, inteligência artificial; ATGC, sequência de ADN; BEAM, anti-microbiano energizado à beira do leito; DL, ledger distribuído; IoT, Internet das Coisas; P, PhageCoin; OMS, Organização Mundial da Saúde.
O módulo DL da plataforma assegurou uma entrada suficiente, qualitativa e registrada de sequências de fago/genoma bacteriófago ligadas ao módulo AI e ditto fornecimento de sequências de fago aos clientes, em conformidade com as disposições do protocolo Nagoya (Expert round table on acceptance and re-implementation of bacteriophage therapy et al, 2018). O DL registou imutavelmente todos os intervenientes (por exemplo, fornecedores de dados, serviços de sequenciação e clientes), transacções e detalhes contratuais. Ele também registrou a qualidade exata, especificações e peso do material fornecido. Um algoritmo determinou a não redundância e estimou o peso (por exemplo, a virulência e a gama de hospedeiros dos fagos) e a conveniência do material submetido. Os fagos que visavam patógenos bacterianos emergentes eram, naturalmente, os mais procurados. A maioria das questões de patentes foram anuladas. O DL actuou como um livro de pagamentos para assegurar que todas as partes fossem pagas atempadamente e de forma justa. Uma série de PhageCoins (a moeda criptográfica da plataforma) foi atribuída aos fornecedores em relação à qualidade, peso e desejabilidade do material fornecido. Os clientes que extraíram resultados de previsão (sequências de fago) através do DL pagaram uma quantia de PhageCoins, proporcional ao valor estimado dos fagos. Estes PhageCoins foram utilizados para manter o DL, para assegurar um fluxo suficiente e contínuo de material e para expandir a virulência dos fagos e os dados da gama de hospedeiros (combinando os fagos com as bactérias). Uma injeção adicional de fundos e incentivo ao fornecimento de material foi encontrada em produtores e fornecedores de todos os tipos de mercadorias. Com a PhageCoins, os fornecedores de fago puderam comprar online todos os tipos de produtos a preços fortemente reduzidos, desde equipamentos de laboratório e escolares até itens esportivos. Estes bens eram fornecidos através de patrocínio corporativo. Várias empresas estabelecidas patrocinaram a PhageXchange em troca de reduções de impostos, publicidade e a imagem de uma marca socialmente responsável. O peso do material fornecido e, portanto, também o seu valor, foram inicialmente subvalorizados, mas foram reavaliados em intervalos regulares (iteração) e aos fornecedores foram atribuídos mais PhageCoins quando justificados. Embora útil desde o momento em que foi introduzida, a plataforma só se tornou realmente bem-sucedida quando foi colocada sob a proteção da OMS, em analogia com o sistema mundial de rastreabilidade, transparência, vigilância e vigilância de Medicamentos de Origem Humana (Warwick et al., 2013). Um acordo formal entre a Phage XChange e a OMS aumentou a confiança internacional na sustentabilidade a longo prazo da plataforma e na protecção contra a exploração comercial pouco ética. A busca de fagos terapêuticos potentes logo se tornou um esforço comunitário para resolver a crise de resistência aos antibióticos, com “caçadores de fagos” independentes, escolas, grupos de escoteiros, aldeias às margens do rio Amazonas, etc., isolando e submetendo fagos ao Phage XChange, em troca do PhageCoins. À margem disto, várias empresas e instituições desenvolveram equipamentos e serviços periféricos, tais como kits de isolamento e plataformas de sequenciamento e sintetização de fago (por exemplo, o dispositivo Phage-BEAM). Em antecipação a estes dispositivos, foram oferecidas soluções intermediárias, onde os próprios fagos foram obtidos através do DL.
Epilog
Esta visão sobre o futuro da fagoterapia proporciona um final otimista para a crise de resistência aos antibióticos. A produção ad hoc e no local de fagos sintéticos, ligada a um sistema global de gestão de fagos de base comunitária, revelou-se uma arma extra bem-vinda e acessível (para sistemas de segurança social) na luta contra infecções bacterianas resistentes aos antibióticos. Contudo, não foi uma bala mágica; foi um suplemento sinérgico para os antimicrobianos estabelecidos. A produção instantânea e sem células de fagos sintéticos, concebidos ou não, tinha vantagens consideráveis sobre os fagos naturais produzidos classicamente (em hospedeiros bacterianos):
(i) Não havia necessidade de manter bancos de fagos terapêuticos físicos e de despachar os isolados bacterianos do paciente e os fagos terapêuticos correspondentes em todo o mundo.
(ii) Fagos sintéticos contra bactérias causadoras de eminentes ameaças à saúde pública, como o surto de E. coli O104:H4 de 2011 na Alemanha (Merabishvili et al.., 2012), ou bactérias (suspeitas de serem) usadas para o bioterrorismo (Joñczyk-Matysiak et al., 2014) poderia ser produzido no local em tempo oportuno.
(iii) Fagos contra bactérias causadoras de doenças potencialmente letais, para as quais não estavam disponíveis estirpes hospedeiras de produção não letais e cuja propagação requeria precauções de bio-contenção de nível 3 de biossegurança (bsl-3), poderiam ser sintetizadas em condições de bsl-1.
(iv) Quando nenhum fago podia ser isolado dos locais de amostragem, por exemplo, porque as estirpes de hospedeiro bacteriano utilizadas nas técnicas de isolamento não eram suscetíveis aos fagos desejados, (previstos) sequências genómicas de fagos, extraídas de dados metagenómicos (Reyes et al, 2010; Amgarten et al., 2018), poderiam ser usados para produzir fagos sintéticos.
(v) As preparações de fagos sintéticos não continham (ou quantidades menores de) moléculas que poderiam ter um impacto negativo nos pacientes (por exemplo, endotoxinas).
(vi) Os dispositivos foram adaptados para produzir fagos sintéticos durante viagens espaciais prolongadas e colonização espacial (Taylor e Sommer, 2005).
Existem poucas chances destas previsões se tornarem realidade. É provavelmente muito míope pensar que um esforço comunitário, apoiado por organizações de saúde pública e gerenciado por uma plataforma global, sustentável e ética, poderia estar no centro de uma solução para a atual crise mundial de resistência aos antibióticos. Algumas partes do sistema proposto, como a produção livre de células de fagos sintéticos usando um dispositivo de cabeceira, têm uma chance razoável de serem realizadas, enquanto outros elementos, como o patrocínio corporativo, provavelmente permanecerão limitados ao reino da ficção científica. Você pode dizer que sou um sonhador, então sinta-se livre para me acordar em 2035 para me confrontar com a realidade!
Contribuições do Autor
J-PP concebeu a visão e redigiu o manuscrito.
Funding
Os custos de publicação foram cobertos pela “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst”.
Conflito de interesses
O autor declara que a pesquisa foi conduzida na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesses.
O editor de manuscritos declarou co-autoria passada com o autor.
Acreditas
A visão pessoal, ou sonho, desenvolvido neste manuscrito surgiu como resultado de interações com muitos colegas pesquisadores nos últimos 15 anos. É impossível nomeá-los a todos, mas não seria justo tirar todos os créditos sozinho. Portanto, decidi reconhecer alguns deles aqui (em ordem alfabética), com o risco – ou melhor, com a certeza – de esquecer alguns influenciadores importantes: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili, Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bossche, Mario Vaneechoutte, Gilbert Verbeken, e Kilian Vogele.
American Academy of Microbiology (2016). Aplicações da Sequenciação Microbiológica Clínica de Próxima Geração: Relatório sobre um Colóquio da Academia Americana de Microbiologia Realizado em Washington, DC, em Abril de 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P. da Silva, A. M., e Setubal, J. C. (2018). MARVEL, uma ferramenta de previsão de sequências bacteriófagas em caixotes metagenómicos. Frente. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., e Loessner, M. J. (2018). Reinício de genoma cruzado de genomas de bacteriófagos sintéticos feitos à medida, em bactérias de forma L. Proc. Natl. Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., and Lu, T. K. (2018). Aplicações baseadas em fagos em biologia sintética. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., e Delbrück, M. (1943). Mutações de bactérias da sensibilidade do vírus à resistência ao vírus. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine”, em Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019.ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). Seleção e caracterização de um candidato bacteriófago terapêutico que lise a estirpe Escherichia coli O104:H4 do surto de 2011 na Alemanha. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R.., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Aspectos clínicos da terapia de fago. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., et al. (2018). De novo síntese de DNA usando conjugados de polimerase-nucleotídeos. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., and Lu, T. K. (2016). Fagos geneticamente modificados: uma revisão dos avanços da última década. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). O paradigma da fago terapia: prêt-à-porter ou sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). O fago magistral. Vírus 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Vírus na microbiota fecal de gêmeos monozigóticos e suas mães. Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P., and Noireaux, V. (2018). Síntese TXTL sem células de bacteriófagos infecciosos T4 em uma única reação do tubo de ensaio. Síntese. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Desenvolvimento e utilização de cocktails terapêuticos personalizados à base de bacteriófagos para tratar um paciente com uma infecção Acinetobacter baumannii resistente disseminada. Antimicrobiano. Agentes Quimioterápicos. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z., and Morris, J. G. Jr. (2001). Terapia com bacteriófagos. Antimicrob. Agentes quimioterápicos. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Vírus: desbloqueando a maior biodiversidade da Terra. Genoma 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., e Sommer, A. P. (2005). Para um tratamento racional das infecções bacterianas durante viagens espaciais prolongadas. Int. J. Antimicrob. Agentes 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B., e Sunyaev, A. (2020). Tecnologia de livros-razão distribuídos em genómica: uma chamada para a Europa. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). Antigo dogma, novos truques – Terapia de fago do século 21. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Avaliação microbiológica e molecular de ISP bacteriófago para o controle de Staphylococcus aureus. PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J. P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Optimização do quadro regulamentar europeu para a terapia bacteriófaga sustentável na medicina humana. Arco. Imunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L., and Wang, H. (2013). Sistemas de codificação globalmente consistentes para produtos médicos de origem humana. Bull. Órgão Mundial de Saúde. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., e Qimron, U. (2017). Estendendo a gama de partículas bacteriófagos para a transdução de DNA. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar