Prefață
Acest articol oferă o viziune personală a ceea ce ar putea fi necesar pentru ca terapia cu fagi să se impună în cele din urmă ca un instrument antibacterian majoritar. Este influențată de eșecurile și incertitudinile istorice și recente din domeniul terapiei cu fagi și își propune să găsească soluții bazate pe tehnologiile viitoare și emergente care se presupune că vor modela știința și societatea de mâine.
Terapia cu fagi
Bacteriofagele (fagi) sunt virușii bacteriilor. Din timpuri imemoriale, aceștia au controlat creșterea și răspândirea gazdelor lor bacteriene. Virusurile bacteriene sunt cele mai omniprezente entități vii din biosfera noastră. Se estimează că în oceane există de 10 milioane de ori mai mulți viruși decât stelele din univers, iar dacă toți fagii de pe Pământ ar fi stivuiți unul peste altul, acest turn s-ar întinde mai departe decât cele mai apropiate 60 de galaxii (Suttle, 2013). Aceștia pot fi găsiți cu ușurință oriunde se dezvoltă bacteriile: în canalizare, în râuri sau în urina și fecalele pacienților. Fagii agenților patogeni bacterieni umani sunt cel mai adesea compuși dintr-un cap icosaedric, o sferă cu 20 de fețe plate alcătuită din proteine și care conține un genom de acid nucleic, de care este atașată o coadă proteică. Atunci când un fag strict litic aderă cu fibrele și vârfurile cozii sale la suprafața bacteriei țintă, învelișul cozii, asemănător unei seringi, se contractă, iar miezul cozii este împins prin peretele celular bacterian, injectând genomul fagului în periplasma celulei bacteriene. Imediat, mașinăria bacteriană de sinteză a ADN-ului și a proteinelor este deturnată pentru a construi copii ale fagului. Unii fagi taie ADN-ul bacterian în bucăți. După o perioadă de latență de câteva minute sau ore, fagii nou formați izbucnesc din gazdele lor bacteriene, care sunt ucise în acest proces. Progeniturile fagilor, care pot fi de ordinul sutelor per bacterie, pleacă apoi să găsească noi bacterii gazdă pe care să le infecteze. Ca atare, fagii pot fi considerați ca fiind antimicrobieni autoreplicanți. Este important faptul că fagii au evoluat pentru a infecta doar anumite bacterii țintă și sunt inofensivi pentru celulele mamiferelor.
Primele dovezi ale agenților de tip viral cu activitate antibacteriană au fost raportate de către bacteriologul englez Frederick Twort și de către microbiologul franco-canadian Felix d’Hérelle în 1915 și, respectiv, 1917 (Sulakvelidze et al., 2001). În 1919, d’Hérelle a exploatat pentru prima dată potențialul terapeutic al fagilor atunci când i-a folosit pentru a vindeca un băiat care suferea de dizenterie la Paris. Terapia cu fagi a fost imediat recunoscută ca o abordare terapeutică pentru tratarea infecțiilor bacteriene, iar comercializarea preparatelor de fagoterapie a fost întreprinsă de mai multe companii, cum ar fi L’Oréal în Europa și Eli Lilly Company în Statele Unite (Sulakvelidze et al., 2001). În 1923, microbiologul georgian Giorgi Eliava a fondat Institutul Eliava din Tbilisi, Georgia, dedicat cercetării în domeniul fagoterapiei. Acesta a fost începutul unei cercetări și dezvoltări extinse în domeniul fagoterapiei în fosta Uniune Sovietică. Cu toate acestea, primele utilizări ale fagoterapiei au fost adesea nesigure, iar cercetarea în domeniul antibioticelor era, de asemenea, în curs de desfășurare. Utilizarea cu succes a penicilinei în timpul celui de-al Doilea Război Mondial și comercializarea ulterioară a acesteia la nivel mondial i-a determinat pe oamenii de știință occidentali să își piardă interesul pentru terapia cu fagi. Cercetătorii sovietici, în schimb, au continuat să dezvolte terapia cu fagi și să își publice rezultatele, dar, din cauza Cortinei de Fier, cunoștințele și experiența lor nu s-au răspândit în întreaga lume (Sulakvelidze et al., 2001). La începutul celui de-al treilea mileniu, povara din ce în ce mai mare pe care o reprezintă pentru sănătate infecțiile cu bacterii rezistente la antibiotice (Cassini et al., 2019) a incitat un interes reînnoit la nivel mondial pentru terapia cu fagi ca un instrument suplimentar viabil pentru gestionarea clinică a infecțiilor bacteriene (Thiel, 2004). Peste tot în lume se înființează centre de fagoterapie, pe urmele Institutului Eliava și a unității de fagoterapie de la Institutul Hirszfeld din Wrocław, Polonia (Miêdzybrodzki et al, 2012).
Anul 2035
Avansați în viitorul Pământ al anului 2035, o lume sumbră caracterizată de suprapopulare umană, perturbări majore ale ecosistemelor, încălzire globală și xenofobie.
În timp ce se înmuia în baia sa, Dr. John Iverian, un microbiolog pensionar, a simțit brusc o înțepătură extrem de dureroasă în ceafă, urmată de un sunet asemănător cu cel al unei elice de avion de mici dimensiuni. A verificat mediul înconjurător și cu coada ochiului a văzut o insectă ciudată, mare, cu picioare lungi și înfiorătoare și antene, așezată pe peretele de lângă cada sa de design. Osuri, sistemul de gestionare a locuinței din mansarda lui Iverian din centrul Anversului, a identificat insecta ca fiind gândacul puturos marmorat maro Halyomorpha halys, care se răspândise în întreaga lume. Raportul lui Osuri, proiectat pe unul dintre ecranele video ale băii, menționa că persoanele, care au fost mușcate, au prezentat inițial o mică rană roșie în zona mușcăturii de pe piele. Atunci când era lăsată nesupravegheată, rana mușcăturii se umfla și producea puroi. Obosit și amețit, nonșalant, Iverian a ieșit din baie și s-a dus la culcare. Se hotărâse să nu efectueze procedura elaborată de tratare a rănii, care fusese sfătuită cu tărie de Osuri. A doua zi dimineață devreme, însă, mușcătura se transformase într-o rană necrotică care prezenta semne clare de infecție.
Anxios, Iverian și-a activat dispozitivul Phage-BEAM. BEAM însemna “Bedside Energized Anti-Microbial”. Dispozitivul avea dimensiunea și forma unei cutii de pantofi, dar cu un aspect mai elegant și mai lustruit. Numele dispozitivului și al producătorului său erau desenate cu litere colorate pe partea laterală a cutiei emailate alb fără cusur. Iverian a scos un tampon din ambalajul steril și l-a trecut ușor peste întreaga zonă a rănii, asigurându-se că exsudatul rănii umezea bine vârful de vată al tamponului. Când tamponul s-a apropiat de zona de “inserare a probei” din cutie, o ușă minusculă s-a deschis ca prin magie, eliberând o hologramă de 15 cm înălțime a unui tehnician de laborator, pe nume Marcia. Aceasta i-a arătat lui Iverian unde să andocheze proba. Marcia a fost dezvoltată pentru a-i ghida pe clienți prin procedura de testare. “Pentru cele mai bune rezultate, vă rugăm să introduceți un nou cartuș de bio-cerneală fagică, Dr. Iverian”, a spus Marcia. La fel ca în cazul imprimantelor 2D de odinioară, costul cartușelor de bio-cerneală era aproape la fel de mare ca și costul dispozitivului Phage-BEAM în sine. Potrivit “Business Insider”, bio-ink-ul phage era al doilea cel mai scump lichid de pe Pământ, după Chanel No. 8. Din fericire, ca unul dintre inventatori, Iverian obținuse dreptul de a avea mereu la dispoziție cea mai recentă versiune a acestui dispozitiv, inclusiv o rezervă continuă de reactivi, în mod gratuit.
Iverian știa perfect cum funcționa dispozitivul, așa că nu avea nevoie de ajutorul Marciei. În primul rând, ADN-ul a fost extras din vârful tamponului și a fost determinat metagenomul – tot materialul genetic prezent în probă, inclusiv bacteriile infectante. Apoi, aceste date genetice au fost trimise către un server securizat “Phage XChange”, unde un algoritm complex bazat pe inteligență artificială a prezis secvența genomului fagului care avea cele mai mari șanse să lizeze bacteria infectantă identificată în metagenom și care ar fi trebuit să provoace cea mai slabă reacție imunitară la pacient. Datele privind genomul fagului au fost trimise către dispozitivul Phage-BEAM, care a sintetizat mai întâi genomul fagului și apoi fagul, folosind un sistem brevetat de producție de fagi fără bacterii.
În termen de 1 oră de la prelevare, dispozitivul ar produce un produs fagic terapeutic gata de utilizare. Rezultatele procedurii pas cu pas ar fi transmise pe imensul ecran video de acasă din sufrageria lui Iverian. Așezat în fotoliul său LC2, ascultând Marea Missă în do minor a lui Mozart, Iverian aștepta cu nerăbdare rezultatele. Avea o presimțire proastă în această privință. Rezultatul i-a dat fiori pe șira spinării lui Iverian. Agent patogen bacterian identificat: Streptococcus pyogenes tulpina FE-2033! Osuri a activat imediat protocolul de alertă de infecție, trimițând un mesaj către Centrul Mondial de Control al Bolilor și a proiectat informații de fond îngrijorătoare despre tulpina bacteriană letală mâncătoare de carne, care era considerată o amenințare iminentă la adresa sănătății publice începând cu anul 2033. Pentru o clipă, Iverian s-a gândit să extirpeze rana infectată și o parte din țesutul sănătos din jur cu un cuțit de bucătărie, dar s-a liniștit și a decis să aștepte și să aplice iminentul produs Phage-BEAM. O oră mai târziu, dispozitivul Phage-BEAM a produs fagi sintetici. Acești fagi au fost apoi amestecați cu bacteriile izolate, într-un modul de validare, pentru a le testa eficacitatea in vitro. Cincisprezece minute mai târziu, s-a dat undă verde pentru ca Iverian să înceapă tratamentul. Iverian a aplicat fagii într-un pansament pentru plăgi pe bază de hidrogel cu eliberare lentă, care fusese mai întâi amestecat cu suspensia concentrată de fagi produsă de dispozitivul Phage-BEAM și care conținea, de asemenea, antibiotice sinergice. Hidrogelul a ameliorat temporar durerea, ceea ce l-a liniștit și mai mult. Iverian a repetat aplicarea hidrogelului încărcat cu fag și antibiotic o dată pe zi. Infecția rănii s-a ameliorat în 24 de ore și, după 7 zile, rana era aproape complet vindecată. Infecția care putea pune în pericol viața lui Iverian a fost tratată cu succes, în timp util și fără a părăsi locuința sa. Dar, timp de multe decenii anterioare, nu a fost sigur că terapia cu fagi va răzbate pentru a deveni un instrument antibacterian aplicat pe scară largă și util din punct de vedere clinic. Lumea medicală a avut nevoie de ceva timp pentru a realiza că terapia cu fagi nu trebuie să fie identică cu terapia cu antibiotice, și aceasta în principal din cauza particularităților agenților activi, fagii.
Câteva particularități relevante ale fagilor
Fagii prezintă o serie de proprietăți care diferă de antibiotice și care au împiedicat dezvoltarea lor ca produse farmaceutice și aplicarea lor în terapie. În primul rând, ei tind să fie specifici în ceea ce privește bacteriile pe care le infectează. În cel mai bun caz, ei vor viza o parte considerabilă dintr-o singură specie bacteriană, dar în cel mai rău caz vor infecta doar un număr mic de tulpini din cadrul unei specii. Fageii terapeutici pot fi astfel selectați pentru a distruge în principal o specie bacteriană sau un subgrup relevant din punct de vedere clinic al acesteia și pentru a cruța bacteriile benefice ale pacientului (de exemplu, flora intestinală, cutanată sau orală comensală). În schimb, majoritatea antibioticelor utilizate în mod obișnuit au un spectru larg de activitate, ceea ce poate provoca “daune colaterale” microbiomului comensal al pacientului, ceea ce, la rândul său, poate avea ca rezultat efecte adverse, cum ar fi selectarea unor specii bacteriene rezistente la antibiotice (de exemplu, Clostridium difficile) sau diareea asociată cu antibioticele (Jernberg et al., 2010). Dezavantajul specificității fagilor este că bacteriile infectante trebuie să fie identificate înainte de a începe terapia cu fagi. În terapia antibiotică empirică, în schimb, se utilizează de obicei cocktailuri de antibiotice cu spectru larg care afectează o multitudine de bacterii Gram-pozitive și Gram-negative, precum și diverse ciuperci. Atunci când se cunosc mai multe informații (de exemplu, din cultura bacteriană), tratamentul poate consta în antibiotice cu spectru îngust, care vizează mai specific bacteriile sau ciupercile identificate ca fiind cauza bolii.
În al doilea rând, bacteriile și fagii sunt implicați într-o relație gazdă-parazit. Fagii strict litici sunt omniprezenți în mediu și au nevoie de moartea gazdei lor bacteriene pentru a-și finaliza ciclul de viață. Fără gazde, fagii nu pot exista. Fagii impun o selecție a gazdelor rezistente, care, la rândul lor, impun o selecție a fagilor eficienți. Acest lucru duce la ceea ce se numește “coevoluție antagonistă”, o cursă a înarmării între bacterii și fagi, caracterizată prin evoluția reciprocă a rezistenței bacteriene și a infectivității fagilor (Buckling și Rainey, 2002). La fel ca în cazul majorității substanțelor antimicrobiene, bacteriile vor deveni astfel rezistente și la fagi (Luria și Delbrück, 1943; Schooley et al., 2017), dar, spre deosebire de antibioticele statice, fagii au capacitatea de a depăși rezistența bacteriană (Buckling și Rainey, 2002). Cu toate acestea, există totuși indicii că bacteriile și fagii nu își vor crește la nesfârșit rezistența și infectivitatea respective (Fortuna et al., 2019).
Abordări ale terapiei cu fagi
La momentul renașterii terapiei cu fagi la începutul anilor 2000, fuseseră dezvoltate două abordări distincte ale terapiei cu fagi (Pirnay et al., 2011). În ceea ce s-ar putea numi abordarea unică, au fost aplicate cocktailuri definite de fagi cu spectru larg, care ar fi trebuit să vizeze majoritatea bacteriilor suspectate de a provoca anumite boli infecțioase. Aceste cocktailuri predefinite de fagi cu spectru larg au fost dezvoltate, produse și testate în cadrul modelelor farmacoeconomice actuale, care fuseseră concepute pentru medicamente “statice”, cum ar fi antibioticele. Cu toate acestea, cocktailurile de fagi cu adevărat cu spectru larg, active împotriva majorității bacteriilor Gram-pozitive și/sau Gram-negative întâlnite în mod obișnuit în bolile infecțioase, trebuiau să conțină cantități mari de fagi și s-au dovedit a fi foarte dificil de dezvoltat. A fost posibil să se dezvolte cocktailuri de fagi cu spectru mai restrâns, active împotriva uneia sau câtorva specii bacteriene, pentru a fi utilizate în anumite indicații și cu condiția ca speciile bacteriene infecțioase să fie cunoscute în prealabil. Pentru unele specii bacteriene, cum ar fi Staphylococcus aureus, au fost izolați și caracterizați fagi care prezintă o gamă de gazde excepțional de largă (Vandersteegen et al., 2011). În PhagoBurn, un studiu randomizat controlat, succesul în obținerea unei reduceri susținute a poverii Pseudomonas aeruginosa în rănile de arsură a fost legat de sensibilitatea inițială la cocktailul de fagi (Jault et al., 2019). Cu toate acestea, s-a demonstrat că o treime dintre pacienții incluși adăposteau tulpini preexistente de P. aeruginosa rezistente la cocktailul de fagi, care a constat în nu mai puțin de 12 fagi litici de P. aeruginosa. În plus, cocktailurile de fagi care au fost inițial concepute pentru a fi eficiente trebuiau să fie actualizate în mod regulat (de exemplu, suplimentate cu noi fagi) ca răspuns la apariția rezistenței la fagi sau la implicarea unor noi tulpini relevante din punct de vedere clinic aflate în circulație. În cele din urmă, nu se știa dacă confruntarea bacteriilor cu concentrații ridicate de cocktailuri de fagi fixați ar determina apariția, răspândirea și persistența rezistenței bacteriene la fagi în spitale și în mediu, similar cu ceea ce s-a întâmplat la utilizarea masivă a antibioticelor.
În conceptele de fagoterapie personalizată, unul sau mai mulți fagi au fost selectați dintr-o bancă de fagi sau din mediul înconjurător și, eventual, adaptați (selecția in vitro a unor mutanți de fagi care prezintă o infectivitate crescută) pentru a infecta mai eficient bacteriile izolate din focarul de infecție al pacientului (Friman et al., 2016). Unele centre de fagoterapie au înființat și întreținut bănci mari de fagi terapeutici, care au fost actualizate în mod regulat cu noi fagi, lărgind și adaptând gama de gazde a băncii la populațiile bacteriene în continuă schimbare. Abordările personalizate de fagoterapie au fost potențial mai durabile, deoarece doar bacteria infectată este vizată, ceea ce duce la o presiune de selecție mai mică în direcția rezistenței bacteriene la fagi. Cu toate acestea, ele au fost, de asemenea, mai elaborate și mai complexe din punct de vedere logistic decât abordările de tip “one-size-fits-all”, cu tulpini bacteriene și fagi corespunzători trimiși peste tot în lume (Figura 1). În plus, conceptele de medicină de precizie nu erau, în general, compatibile cu majoritatea căilor de dezvoltare și de acordare a licențelor pentru medicamente (medicamente în Statele Unite), care necesitau mai mulți ani și milioane de euro (dolari) pentru a fi finalizate, și asta pentru fiecare fag din bancă (Verbeken et al., 2012).
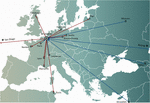
Figura 1. Transferuri internaționale de fagi de la (săgeți roșii) și către (săgeți albastre) Spitalul Militar Queen Astrid (QAMH) din Bruxelles în vederea unor aplicații clinice în perioada 2015-2020. La nivel național, fagii au fost expediați de la QAMH către cinci spitale universitare (nu se arată). În plus, selecția fagilor potriviți a cuprins adesea transferul izolatelor bacteriene ale pacienților, iar cinci pacienți internaționali (doi din Franța, doi din Țările de Jos și unul din Tunisia) au fost transferați la Bruxelles pentru fagoterapie.
Intrați în biologia sintetică
Cu debutul celui de-al treilea mileniu, abordările de biologie sintetică au fost dezvoltate din ce în ce mai mult pentru a reduce specificitatea fagilor și apariția rezistenței fagilor bacterieni (de ex, proiectarea ghidată de structură) (Pires et al., 2016; Dunne et al., 2019). De exemplu, au fost elaborate platforme bazate pe drojdie pentru comutarea proteinelor din fibrele cozii fagilor pentru a proiecta fagi hibrizi cu o gamă de gazde mai previzibilă și mai extinsă (Ando et al., 2015; Yosef et al., 2017) și strategii de inginerie genetică (de ex, instrumentele de editare CRISPR-Cas) au fost dezvoltate pentru a aborda alte aspecte, cum ar fi interacțiunile negative între pacienți și fagi (de exemplu, răspunsul imunitar antifagic) (Brown et al., 2017), apariția și răspândirea potențială a mecanismelor de rezistență a fagilor bacterieni și eliberarea de conținut bacterian dăunător, cum ar fi endotoxinele (Hwang et al., 2018). Genomurile fagilor sintetici au trebuit să fie repornite pentru a produce descendenți fagici (Barbu et al., 2016; Pires et al., 2016), prin transformarea formelor L de Escherichia coli sau Listeria monocytogenes (Kilcher et al., 2018) sau utilizând sisteme de transcriere-translație fără celule (TXTL) (Rustad et al., 2018). Cadrele de reglementare occidentale începuseră treptat să se ocupe de abordările de terapie fagică de precizie și personalizată care utilizează fagi naturali (Pirnay et al., 2018), fagi artificiali (Dedrick et al., 2019) și fagi sintetici.
Dezvoltarea dispozitivelor de producție de fagi terapeutici ad-hoc și la fața locului, cum ar fi Phage-BEAM, nu a decurs fără probleme, a reamintit Iverian. Pentru început, a fost nevoie de o potrivire și proiectare in silico a fagilor bazată pe inteligență artificială (AI). A fost aleasă învățarea profundă (Martorell-Marugán et al., 2019), un subset al învățării automate, pentru a căuta legături între genomurile bacteriene și genomurile fagilor infectanți, deoarece era mai ușor de scalat la un număr mai mare de probe. De exemplu, metodele de învățare profundă nu au necesitat așa-numita extracție a caracteristicilor, care ar necesita o adnotare la nivel de genă/proteină a genomului fagului și a genomului bacterian și ar limita predicțiile la anumite relații cunoscute între caracteristicile bacteriene și cele ale fagului, cum ar fi structurile fibrelor de coadă ale fagului care se leagă de receptori specifici ai peretelui celular bacterian. Ca dezavantaj, trebuia să fie alimentat de o sursă continuă de cantități masive de date, care să facă legătura între genomurile fagilor litici și genomurile bacteriilor gazdă, și aici a fost o problemă. Secvențierea genomului integral pătrunsese încet în practica microbiologiei clinice (American Academy of Microbiology, 2016), dar institutele de cercetare și companiile farmaceutice nu erau dornice să își transmită datele către o singură bază de date centralizată și nu s-au găsit investitori dispuși și capabili să achiziționeze datele disponibile și/sau să producă cantități suficiente de date noi. Un al doilea obstacol care a trebuit să fie depășit a fost indisponibilitatea sintezei rapide, fiabile și accesibile a moleculelor mari de ADN. Tehnicile inițiale de sinteză a ADN-ului se bazau pe chimia organică și produceau molecule de ADN relativ mici. Sinteza de novo a genomurilor de fagi a necesitat asamblarea mai multor fragmente de genom (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) în drojdia Saccharomyces cerevisiae, utilizând cromozomi artificiali de drojdie (Ando et al., 2015) sau asamblarea chimică (Gibson et al., 2009). Dezvoltarea unei noi tehnici de sintetizare a ADN-ului, bazată pe enzimele de sintetizare a ADN-ului care se găsesc în celulele sistemului imunitar (Palluk et al., 2018), a facilitat sinteza genomului fagilor. În cele din urmă, au trebuit depășite unele obstacole pentru a dezvolta sisteme generice de producere a fagilor fără celule, capabile să producă fagi în titruri ridicate și care să prezinte aceleași niveluri de infectivitate bacteriană ca și analogii lor naturali.
Descoperirea
Problema majoră a fost că s-a dovedit a fi foarte dificil să se colecteze cantitățile masive de secvențe de genomuri de fagi și bacterii legate între ele, necesare pentru ca algoritmii de inteligență artificială cu învățare profundă să prezică și/sau să proiecteze secvențe de fagi cu un nivel de precizie acceptabil din punct de vedere terapeutic. Iverian și-a amintit că adevărata descoperire a venit atunci când organizația non-profit “Phage XChange” și-a lansat platforma globală de guvernanță a fagilor cu același nume pentru a crea un lanț de aprovizionare cu fagi eficient, standardizat, durabil și etic (Figura 2). Phage XChange a constat în principal dintr-un modul de inteligență artificială și un registru distribuit (Distributed Ledger – DL) (Thiebes et al., 2020). Modulul AI al platformei a analizat genomurile fagilor și bacteriilor legate între ele pentru a prezice și a proiecta fagi puternici pentru clienți. De asemenea, a prezis ce agenți patogeni bacterieni necesitau cea mai urgentă atenție, pe baza Internetului lucrurilor (IoT) și a Big Data și a informațiilor furnizate de organizațiile internaționale de sănătate publică, cum ar fi Organizația Mondială a Sănătății (OMS) și Centrele naționale pentru controlul bolilor. Aceste date au direcționat sistemul către izolarea și caracterizarea fagilor de care este nevoie cel mai urgent.
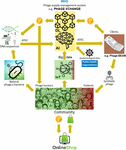
Figura 2. Viziune a modului în care ar putea fi organizat lanțul de aprovizionare cu fagi în 2035. AI, inteligență artificială; ATGC, secvență de ADN; BEAM, antimicrobian energizat la patul bolnavului; DL, registrul distribuit; IoT, Internetul lucrurilor; P, PhageCoin; OMS, Organizația Mondială a Sănătății.
Modul DL al platformei a asigurat o intrare suficientă, calitativă și înregistrată a secvențelor legate de genomul fagilor/bacteriilor în modulul AI și idem furnizarea de secvențe de fagi către clienți, în conformitate cu prevederile protocolului de la Nagoya (Expert round table on acceptance and re-implementation of bacteriophage therapy et al, 2018). DL a înregistrat în mod imuabil toate părțile interesate (de exemplu, furnizorii de date, serviciile de secvențiere și clienții), tranzacțiile și detaliile contractului. De asemenea, a înregistrat calitatea exactă, specificațiile și greutatea materialului furnizat. Un algoritm a determinat non-redundanța și a estimat greutatea (de exemplu, virulența și gama de gazde a fagilor) și oportunitatea materialului furnizat. Fagii care vizează agenții patogeni bacterieni emergenți au fost, desigur, cei mai căutați. Majoritatea problemelor legate de brevete au fost evitate. DL a acționat ca un registru de plăți pentru a se asigura că toate părțile au fost plătite la timp și în mod echitabil. Un număr de PhageCoins (moneda criptografică a platformei) a fost atribuit furnizorilor în funcție de calitatea, greutatea și dorința materialului furnizat. Clienții care au extras rezultatele predicției (secvențe de fagi) prin intermediul DL au plătit o sumă de PhageCoins, proporțională cu valoarea estimată a fagilor. Aceste PhageCoins au fost folosite pentru a menține DL, pentru a asigura un flux suficient și continuu de material și pentru a extinde virulența fagilor și datele privind gama de gazde (potrivirea fagilor cu bacteriile). O injecție suplimentară de fonduri și un stimulent pentru furnizarea de material a fost găsită la producătorii și furnizorii de tot felul de bunuri. Cu PhageCoins câștigate instantaneu, furnizorii de fagi au putut cumpăra online tot felul de produse la prețuri foarte reduse, de la echipamente de laborator și școlare până la articole sportive. Aceste bunuri au fost furnizate prin sponsorizări corporative. Mai multe companii consacrate au sponsorizat PhageXchange în schimbul reducerilor de taxe, al publicității și al imaginii unei mărci responsabile din punct de vedere social. Greutatea materialului furnizat și, prin urmare, și valoarea acestuia, au fost inițial subevaluate, dar au fost reevaluate la intervale regulate (iterație), iar furnizorilor li s-au atribuit mai multe PhageCoins atunci când era justificat. Chiar dacă a fost utilă din momentul în care a fost introdusă, platforma a devenit cu adevărat reușită doar atunci când a fost pusă sub protecția OMS, prin analogie cu sistemul mondial de trasabilitate, transparență, vigilență și supraveghere a medicamentelor de origine umană (Warwick et al., 2013). Un acord formal între Phage XChange și OMS a sporit încrederea internațională în sustenabilitatea pe termen lung a platformei și în protecția acesteia împotriva exploatării comerciale lipsite de etică. Căutarea de fagi terapeutici puternici a devenit în curând un efort comunitar menit să rezolve criza rezistenței la antibiotice, cu “vânători de fagi” independenți, școli, grupuri de cercetași, sate de pe malurile râului Amazon etc., care izolează și trimit fagi către Phage XChange, în schimbul unor PhageCoins. În marja acestui demers, diverse companii și instituții au dezvoltat echipamente și servicii periferice, cum ar fi kituri de izolare a fagilor și platforme de secvențiere și sintetizare a fagilor (de exemplu, dispozitivul Phage-BEAM). În anticiparea acestor dispozitive, au fost oferite soluții intermediare, prin care fagii înșiși erau obținuți prin DL.
Epilog
Acest punct de vedere asupra viitorului terapiei cu fagi oferă un final optimist la criza rezistenței la antibiotice. Producția ad-hoc și la fața locului de fagi sintetici, legată de un sistem global de gestionare a fagilor, bazat pe comunitate, s-a dovedit a fi o armă suplimentară binevenită și accesibilă (pentru sistemele de securitate socială) în lupta împotriva infecțiilor bacteriene rezistente la antibiotice. Cu toate acestea, nu a fost un glonț magic; a fost un supliment sinergic la antimicrobienele stabilite. Producerea instantanee și fără celule a fagilor sintetici, concepuți sau nu, avea avantaje considerabile față de fagii naturali produși în mod clasic (în gazde bacteriene):
(i) Nu era nevoie să se întrețină bănci fizice de fagi terapeutici și să se expedieze în toată lumea izolatele bacteriene ale pacientului și fagii terapeutici corespunzători.
(ii) Fagi sintetici împotriva bacteriilor care cauzează amenințări eminente la adresa sănătății publice, cum ar fi epidemia de E. coli O104:H4 din 2011 din Germania (Merabishvili et al., 2012), sau bacterii (suspectate a fi) utilizate pentru bioterorism (Joñczyk-Matysiak et al., 2014) ar putea fi produse în timp util la fața locului.
(iii) Fagii împotriva bacteriilor care provoacă boli potențial letale, pentru care nu erau disponibile tulpini gazdă de producție neletale și a căror propagare obișnuia să necesite precauții de biocontainere de nivel de biosecuritate 3 (bsl-3), ar putea fi sintetizați în condiții de bsl-1.
(iv) În cazul în care nu au putut fi izolați fagi din locurile de prelevare a probelor, de exemplu, deoarece tulpinile gazdă bacteriene utilizate în tehnicile de izolare nu erau sensibile la fagii doriți, secvențele genomice de fagi (prezise), extrase din datele metagenomice (Reyes et al., 2010; Amgarten et al., 2018), ar putea fi utilizate pentru a produce fagi sintetici.
(v) Preparatele de fagi sintetici nu conțineau (sau conțineau cantități mai mici de) molecule care ar putea avea un impact negativ asupra pacienților (de exemplu, endotoxine).
(vi) Dispozitivele au fost adaptate pentru a produce fagi sintetici în timpul călătoriilor spațiale prelungite și al colonizării spațiale (Taylor și Sommer, 2005).
Există puține șanse ca aceste predicții să se adeverească. Probabil că este prea puțin vizionar să credem că un efort comunitar, susținut de organizații de sănătate publică și gestionat de o platformă globală, durabilă și etică, ar putea fi în centrul unei soluții la actuala criză mondială a rezistenței la antibiotice. Unele părți ale sistemului propus, cum ar fi producția fără celule a fagilor sintetici cu ajutorul unui dispozitiv de la patul bolnavului, au șanse rezonabile de a se realiza, în timp ce alte elemente, cum ar fi sponsorizarea corporativă, vor rămâne probabil limitate la domeniul science-fiction. Puteți spune că sunt un visător, așa că nu ezitați să mă treziți în 2035 pentru a mă confrunta cu realitatea!
Contribuții ale autorilor
J-PP a conceput viziunea și a redactat manuscrisul.
Finanțare
Costurile de publicare au fost acoperite de “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst”.
Conflict de interese
Autorul declară că cercetarea a fost condusă în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Editorul care se ocupă de manipulare a declarat că a fost în trecut coautor cu autorul.
Recunoștințe
Viziunea personală, sau visul, dezvoltat în acest manuscris a apărut ca urmare a interacțiunilor cu mulți colegi cercetători în ultimii 15 ani. Este imposibil să îi numim pe toți, dar nu ar fi corect să ne asumăm singuri toate meritele. Prin urmare, am decis să îi recunosc aici pe unii dintre ei (în ordine alfabetică), cu riscul – sau mai bine zis, cu certitudinea – de a uita unii influențatori importanți: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili, Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bossche, Mario Vaneechoutte, Gilbert Verbeken și Kilian Vogele.
American Academy of Microbiology (2016). Applications of Clinical Microbial Microbial Next-Generation Sequencing: Report on an American Academy of Microbiology Colloquium Held in Washington, DC, in April 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P. P., da Silva, A. M., și Setubal, J. C. (2018). MARVEL, un instrument de predicție a secvențelor de bacteriofagi în bini metagenomici. Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | Full CrossRef Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., și Loessner, M. J. (2018). Repornirea între genuri a genomurilor de bacteriofagi sintetici personalizați și sintetici în bacterii de formă L. Proc. Natl. acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | Refef Full Text | Google Scholar
Lemire, S., Yehl, K. M., și Lu, T. K. K. (2018). Aplicații bazate pe fagi în biologia sintetică. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virologie-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., și Delbrück, M. (1943). Mutații ale bacteriilor de la sensibilitatea la virus la rezistența la virus. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine”, în Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019.ch3
PubMed Abstract | Reflectarea textului integral | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). Selectarea și caracterizarea unui bacteriofag terapeutic candidat care lizează tulpina Escherichia coli O104:H4 din focarul din 2011 din Germania. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract |Refef Full Text | Google Scholar
Miêdzybrodzki, R., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Aspecte clinice ale terapiei cu fagi. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., et al. (2018). Sinteza ADN de novo folosind conjugate de polimerază-nucleotide. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., și Lu, T. K. (2016). Fagi obținuți prin inginerie genetică: o trecere în revistă a progreselor din ultimul deceniu. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). The phage therapy paradigm: prêt-à-porter or sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | Full CrossRef Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). Fagul magistral. Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract |Ref Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Viruși în microbiota fecală a gemenilor monozigoți și a mamelor lor. Nature 466, 334-338. doi: 10.1038/nature0919199
PubMed Abstract | Refef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P., and Noireaux, V. (2018). Sinteza TXTL fără celule a bacteriofagului T4 infecțios într-o singură reacție în eprubetă. Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Dezvoltarea și utilizarea unor cocktailuri terapeutice personalizate pe bază de bacteriofage pentru a trata un pacient cu o infecție cu Acinetobacter baumannii rezistentă diseminată. Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | Text integral | Google Scholar
Sulakvelidze, A., Alavidze, Z., și Morris, J. G. Jr. (2001). Terapia cu bacteriofagi. Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Viruși: deblocarea celei mai mari biodiversități de pe Pământ. Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | Full Text | Google Scholar
Taylor, P. W., și Sommer, A. P. (2005). Către un tratament rațional al infecțiilor bacteriene în timpul călătoriilor spațiale prelungite. Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B., și Sunyaev, A. (2020). Distributed ledger technology in genomics: a call for Europe. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | Full CrossRef Text | Google Scholar
Thiel, K. (2004). Dogmă veche, trucuri noi – terapia cu fagi din secolul XXI. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbtbt0104-31
PubMed Abstract | Full Cross Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Microbiological and molecular assessment of bacteriophage ISP for the control of Staphylococcus aureus (Evaluarea microbiologică și moleculară a bacteriofagului ISP pentru controlul Staphylococcus aureus). PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J. P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Optimizarea cadrului european de reglementare pentru o terapie bacteriofagică durabilă în medicina umană. Arch. Immunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | Full CrossRef Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L., și Wang, H. (2013). Sisteme de codificare coerente la nivel mondial pentru produsele medicale de origine umană. Bull. Organizația Mondială a Sănătății. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., și Qimron, U. (2017). Extinderea gamei de gazde a particulelor bacteriofage pentru transducția ADN. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar
.