Det finns ett samband mellan tryck, volym och temperatur i verkliga gaser
För en idealisk gas ger en plott av \(PV/nRT\) mot \(P\) en horisontell linje med en skärningspunkt på 1 på \(PV/nRT\)-axeln. Verkliga gaser uppvisar dock betydande avvikelser från det beteende som förväntas för en ideal gas, särskilt vid höga tryck (figur \(\(\PageIndex{1a}\)). Endast vid relativt låga tryck (mindre än 1 atm) närmar sig verkliga gaser det ideala gasbeteendet (figur \(\PageIndex{1b}\)).
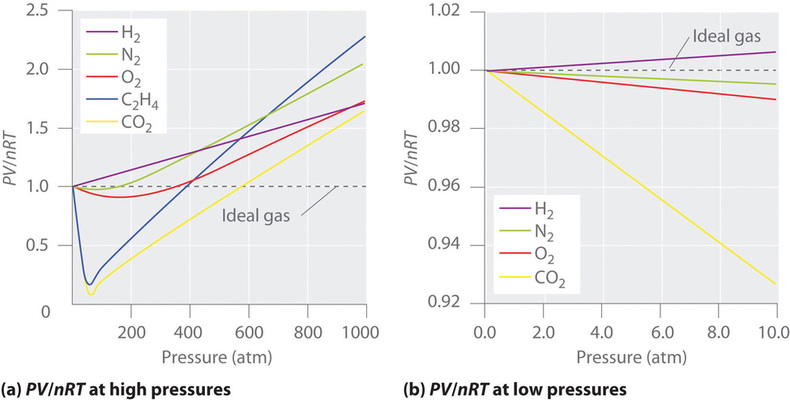
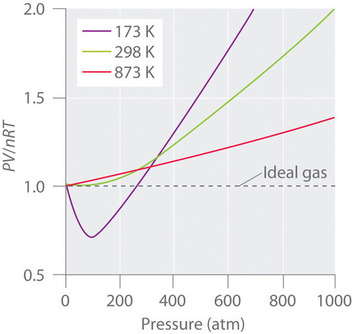
Äkta gaser närmar sig också idealgasbeteendet mer vid högre temperaturer, vilket visas i figur \(\PageIndex{2}\) för \(N_2\). Varför beter sig verkliga gaser så annorlunda än idealgaser vid höga tryck och låga temperaturer? Under dessa förhållanden är de två grundläggande antagandena bakom lagen om ideala gaser – nämligen att gasmolekylerna har försumbar volym och att intermolekylära interaktioner är försumbara – inte längre giltiga.
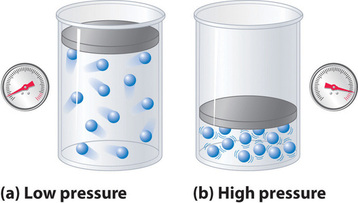
Eftersom molekylerna i en idealgas antas ha nollvolym är den volym som står till deras förfogande för rörelse alltid densamma som behållarens volym. Molekylerna i en verklig gas har däremot små men mätbara volymer. Vid låga tryck är gasmolekylerna relativt långt ifrån varandra, men när gasens tryck ökar blir de intermolekylära avstånden mindre och mindre (figur \(\(\PageIndex{3}\)). Detta leder till att den volym som upptas av molekylerna blir betydande jämfört med behållarens volym. Följaktligen är den totala volymen som upptas av gasen större än den volym som förutses av lagen om ideala gaser. Vid mycket höga tryck är således det experimentellt uppmätta värdet av PV/nRT större än det värde som förutsägs av den ideala gaslagen.
För övrigt dras alla molekyler till varandra genom en kombination av krafter. Dessa krafter blir särskilt viktiga för gaser vid låga temperaturer och höga tryck, där de intermolekylära avstånden är kortare. Attraktioner mellan molekyler minskar antalet kollisioner med behållarväggen, en effekt som blir mer uttalad när antalet attraktiva interaktioner ökar. Eftersom det genomsnittliga avståndet mellan molekylerna minskar, minskar det tryck som gasen utövar på behållarväggen, och det observerade trycket är lägre än förväntat (figur \(\PageIndex{4}\)). Som framgår av figur \(\(\PageIndex{2}\)) är förhållandet \(PV/nRT\) vid låga temperaturer lägre än vad som förutses för en ideal gas, en effekt som blir särskilt tydlig för komplexa gaser och för enkla gaser vid låga temperaturer. Vid mycket höga tryck dominerar effekten av att den molekylära volymen inte är noll. Konkurrensen mellan dessa effekter är ansvarig för det minimum som observeras i diagrammet \(PV/nRT\) mot \(P\) för många gaser.
Nonzero molekylvolym gör att den faktiska volymen är större än vad som förutsägs vid höga tryck; intermolekylära attraktioner gör att trycket är lägre än vad som förutsägs.
Vid höga temperaturer har molekylerna tillräckligt mycket rörelseenergi för att övervinna intermolekylära attraktionskrafter, och effekterna av icke-noll molekylvolym dominerar. Omvänt minskar gasmolekylernas kinetiska energi när temperaturen sänks. Så småningom nås en punkt där molekylerna inte längre kan övervinna de intermolekylära attraktionskrafterna, och gasen blir flytande (kondenserar till en vätska)
.