Vad är en polar kovalent bindning?
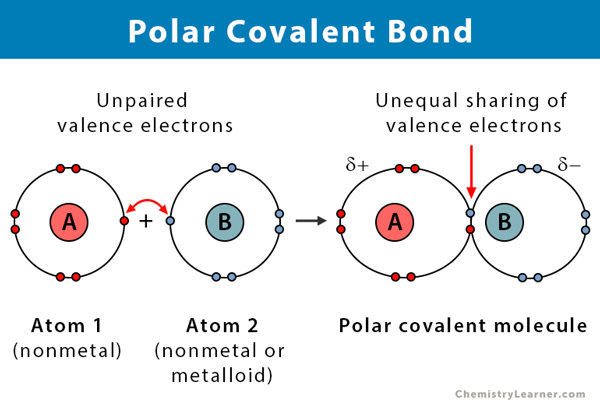
En kovalent bindning bildas när två atomer delar elektroner med varandra. Den kovalenta bindningen är sannolikt polär när elektronerna delas ojämnt. Skråheten uppstår på grund av skillnaden i de två atomernas elektronegativitet. Elektronegativitet är ett mått på en atoms benägenhet att attrahera ett elektronpar för bindning. Den mäts med hjälp av en skala som kallas Pauling-skalan och ligger mellan 0,7 och 4. Följande tabell förklarar vilken typ av kemisk bindning som bildas på grund av denna skillnad i elektronegativitet .
| Typ av kemisk bindning | Elektronegativitetsskillnad |
|---|---|
| Opolär kovalent | 0 |
| Svagt polär kovalent | 0.1 till 0,4 |
| Polar kovalent | 0,5 till 2 |
| Jonisk | > 2 |
Jo större skillnaden i elektroneegativitet, desto större är polariteten och bindningsstyrkan. Därför har polära kovalenta bindningar en intermediär bindningsstyrka.
Egenskaper hos polära kovalenta bindningar
Här är några fakta om polära kovalenta bindningar.
- Finns mellan två icke-metaller eller mellan en icke-metall och en metalloid
- Ojämnt fördelade elektroner i en förening
- Elektronegativitetsskillnaden mellan atomer är mellan 0.1 och 2
- En ände av bindningen är positivt laddad och den andra änden är negativt laddad
- Polära föreningar löses upp i ett polärt lösningsmedel
Exempel på polära kovalenta bindningar
Här är några exempel på en polär kovalent bindning med elektronegativitetsskillnaden mellan de två bindande atomerna :
| Sammansättningens namn | Molekylformel | Bindning | Elektronegativitet skillnad |
|---|---|---|---|
|
Vatten |
H2O |
O-H |
|
| Vätefluorid | HF | H-F | 1.9 |
| Väteklorid | HCl |
H-Cl |
0.9 |
|
Vätebromid |
HBr |
H-Br |
|
|
Ammoniak |
NH3 |
N-H |
|
|
Svaveldioxid |
SO2 | S=O | 1 |
| Vätesulfid | H2S | H-S | 0.4 |
| Metanol | CH3OH | O-H | 1,4 |
En förklaring till den polära kovalenta bindningen i vissa föreningar ges nedan.
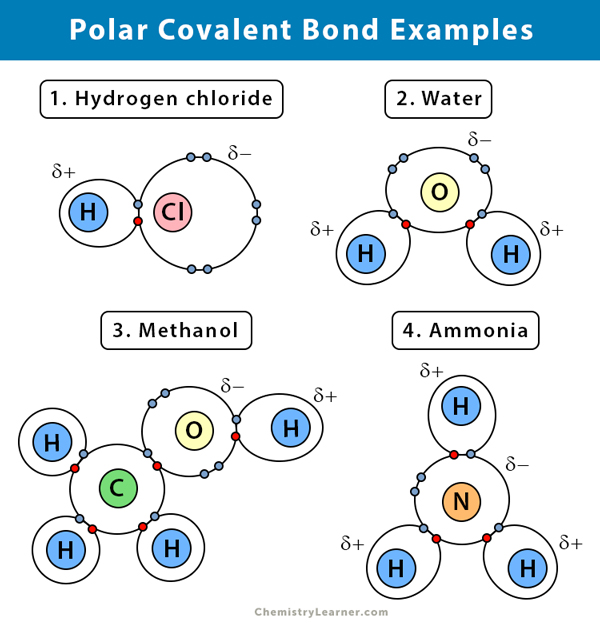
Vatten (H2O)
Vatten är ett polar lösningsmedel. En polär kovalent bindning skapas när syreatomen (O), som är mer elektronegativ än väte, drar de delade elektronerna mot sig själv. Som ett resultat av detta har syreatomen en delvis negativ laddning associerad med den. Vätgaserna (H) är å andra sidan i huvudsak protoner och har en partiell positiv laddning associerad med sig.
Väteklorid (HCl)
Väteklorid är en polär kovalent förening eftersom kloratomen (Cl) är mer elektronegativ än väteatomen (H). Klor bär alltså en delvis negativ laddning, medan väte bär en delvis positiv laddning.
Ammoniak (NH3)
Ammoniak är en polär molekyl. Den centrala atomen, kväve (N), är bunden till tre väteatomer (H). Eftersom N är mer elektronegativt än H tenderar elektronerna att hänga runt N-atomen.
Vätebromid (HBr)
Skillnaden i elektronegativitet mellan väte (H) och brom (Br) är inte alltför stor. Därför har HBr-gasen en kovalent bindning som är polariserad, och väteatomen har en svagt positiv laddning och brom har en svagt negativ laddning. Som ett resultat av detta dras elektronparet till brom.
Skillnaden mellan polära och opolära kovalenta bindningar
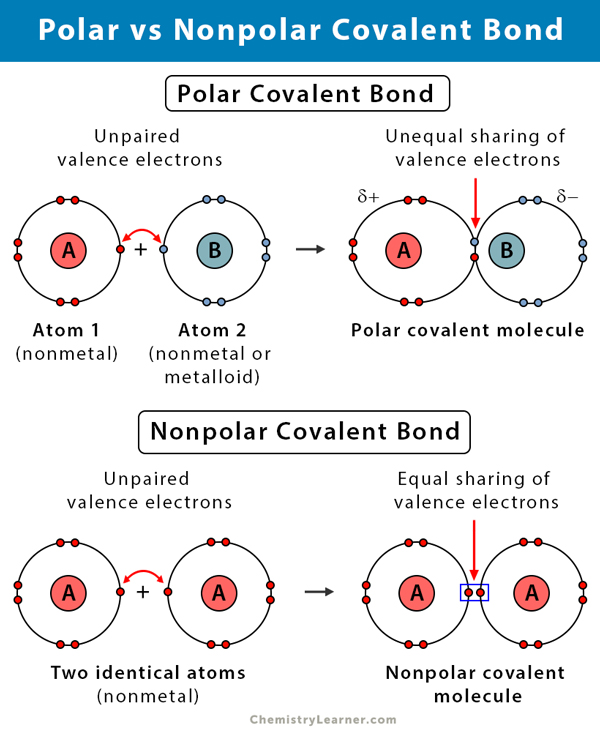
Nedanstående tabell jämför och kontrasterar polära och opolära kovalenta bindningar.
Polär kovalent bindning vs. Opolär kovalent bindning |
||
| Polär | Nonpolär | |
|---|---|---|
|
Typer av atomer |
Mellan två icke-metaller. med olika elektronegativitet |
Mellan två icke-metaller med samma elektronegativitet |
|
Elektronegativitetsskillnad |
0.1 – 2 |
|
|
Elektronfördelning |
Asymmetrisk. Ojämlik fördelning. |
Symmetrisk. Lika fördelning. |
|
Förflyttning av delade elektroner |
Till den mer elektronegativa atomen, vilket gör den delen negativ |
Ingen förflyttning. Elektriskt neutral. |
|
Dipolmoment |
Non-.noll |
Noll |
|
Förekomst av andra typer av bindningar i föreningar |
Vätgasbindning |
Van der Waals-bindning |
|
Affinitet för vatten |
Hydrofil |
Hydrofob |
|
Fysikaliska egenskaper hos föreningarna |
Hög smältpunkt och hög smältpunkt. kokpunkter |
Låga smält- och kokpunkter |
|
Vätskors flyktighet |
Låg flyktighet |
Hög flyktighet |
|
Föreningarnas löslighet |
Lösligt i polära lösningsmedel |
Lösligt i opolära lösningsmedel |
|
Exempel |
Vatten (H2O), ammoniak (NH3) och väteklorid (HCl) |
Väte (H2), syre (O2) och kväve (N2) |
.