Abstract
Diagnosen av en massa på halsen kan vara en utmaning. Hos vuxna är den vanligaste diagnosen malignitet, och både primära och metastatiska tumörer bör övervägas. Andra frekventa alternativ är infektiösa processer. Vi presenterar fallet med en 88-årig kvinnlig patient med en submandibulär massa med inflammatoriska tecken, som inte svarade på antibiotikabehandling, med en finnålsaspirationsbiopsi som visade en inflammatorisk lesion. Massan utvecklades under en månad med associerad anorexi vilket resulterade i inläggning för diagnos med öppen biopsi. Efter intagningen diagnostiserades ett invasivt karcinom i höger bröst, och den mykobakteriella odlingen av biopsin av den submandibulära massan var positiv för Mycobacterium tuberculosis. Immunosenescens de äldre bidrar till sårbarhet för cancer men även infektioner som kan uppträda atypiskt och därmed resultera i fördröjd diagnos
Inledning
Den differentialdiagnostiska bedömningen av halsmassor är ytterst utmanande, eftersom flera faktorer måste beaktas. De viktigaste diagnostiska alternativen hos vuxna är malignitet, antingen primär, metastaserande från tumörer i de övre luftvägarna eller matsmältningskanalen, eller lymfom . Benigna neoplasier som lipom, fibromer och hemangiom kan också hittas.
Sjuttiofem procent av halsmassorna hos patienter över 40 år är maligna , och risken ökar med stigande ålder. Läsionens storlek och symtomens varaktighet är andra viktiga prediktorer för risken för malignitet , liksom kronisk solexponering, rökning, alkoholkonsumtion, dålig tandvård, miljöexponering och familjehistoria .
Massans fysiska egenskaper är också viktiga för differentialdiagnosen. Fasta, hårda eller fasta, med oregelbundna gränser tyder på solida maligniteter; multipla mjuka och gummiartade massor tyder på lymfom; massor med inflammatoriska tecken tyder på infektiösa orsaker .
Inflammatoriska massor kan bero på inflammation av lymfkörtlar (cervikal adenit), som vanligen är självbegränsade och löser sig spontant . Kronisk inflammation i submandibulära eller parotiska körtlar med kronisk sialadenit är också möjlig .
Infektiösa orsaker kan vara virala, bakteriella eller svamprelaterade. Virusinfektioner som cytomegalovirus (CMV), Epstein-Barrvirus (EBV), mässling, Adenovirus, Echovirus, Rhinovirus och Respiratory Syncitial Virus (RSV) ger vanligen upphov till multipla lymfkörtlar med cervikal adenit. Bakterieinfektioner kan orsaka nekros, med abscessbildning, spontan dränering och till och med kronisk fistelbildning . Andra agens bör också övervägas nämligen mykobakterier , kattskrapssjuka av Bartonella , aktinomykos , Toxoplasma gondii .
Andra mindre frekventa orsaker är gikt , inflammatorisk pseudotumör , Kimuras sjukdom , Castlemans sjukdom och sarkoidos .
Diagnosen ställs vanligen med hjälp av finnålsaspirationscytologi, som är en snabb och känslig metod . Om diagnosen förblir oklar kan en öppen biopsi vara nödvändig . Laboratorietesterna varierar med presentationen, men bör inkludera inflammatoriska parametrar inklusive leukocytantal, erytrocytsedimentationshastighet (ESR), C-reaktivt protein (CRP), virus- och bakterieserologi enligt klinisk anamnes och undersökning samt tuberkulintest på huden . Karaktärisering av massan kan göras med ultraljud som skiljer mellan cystiska lesioner, spottkörteltumörer, reaktiva eller maligna lymfkörtlar med hjälp av kriterier som storlek och vaskularisering . Datortomografi (CT) och magnetisk resonanstomografi (MRI) bidrar ytterligare till att karakterisera massorna utifrån storlek och morfologiska avvikelser (central nekros, fettsträngar och heterogenitet) . Positronemissionstomografi kan användas för att undersöka halsmassor eftersom den upptäcker ökad metabolism , men den rekommenderas inte som ett fristående test eftersom den inte skiljer inflammatoriska från neoplastiska lesioner . Om malignitet misstänks bör ytterligare undersökningar utföras, inklusive helkropps-CT-scanning och endoskopiska undersökningar från övre luftvägarna och mag- och tarmkanalen .
Fallrapport
Vi presenterar fallet med en 88-årig skör kvinna som bodde på ett vårdhem och som presenterade sig på akutmottagningen på grund av ett tre till fyra veckors progressivt förlopp med prostration, anorexi och en högersubmandibulär massa med inflammatoriska tecken. Hon undersöktes av avdelningen för käk- och ansiktskirurgi, som hade utfört en fin nålsaspirationscytologi av massan som visade inflammatoriska celler, negativ för neoplastiska celler. Vidare hade hon redan medicinerats med oral amoxicillin-klavulansyra (875 mg/125 mg 3id i 7 dagar) utan förbättring.
Hennes tidigare sjukdomshistoria innehöll essentiell hypertoni, sinusbradykardi, perifer artärsjukdom, mild kognitiv nedsättning och depression. Hon var polymedicinerad med aspirin, olmesartan, pentoxifyllin, paroxetin och alprazolam.
Vid undersökning var hon överviktig, uppvisade en icke öm submandibulär massa på 3 × 3 cm, fast men gummiaktig, med inflammatoriska tecken, utan exsudat (Figur 1). Hon förblev afebril utan andra relevanta kliniska tecken.
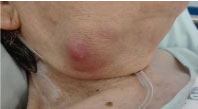 Figur 1: Foto av den högra submandibulära massan. Visa figur 1
Figur 1: Foto av den högra submandibulära massan. Visa figur 1
Med tanke på sjukdomsprogressionen togs patienten in för ytterligare undersökningar, inklusive en öppen biopsi av massan, och påbörjades en empirisk behandling med intravenös amoxicillin-klavulansyra (1000 mg/200 mg i ytterligare 9 dagar) och klindamycin (600 mg 4id i 7 dagar), också utan klinisk förbättring.
Blodprover visade endast en mikrocytisk hypokrom anemi med järnbrist och negativa inflammatoriska parametrar (tabell 1).
Tabell 1: Blodprov från patienten.Visa tabell 1
En datortomografi (CT) av hela kroppen visade flera nekrotiska cervikala lymfkörtlar, de största i den vänstra supraklavikulära fossae och en nodul i den högra bröstkörteln, oregelbunden med hyperattenueringstecken som tyder på vaskularisering (figur 2 och figur 3).
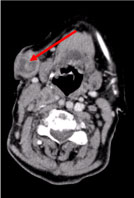 Figur 2: CT av halsen: Multipla nekrotiska cervikala lymfkörtlar, den största subkutana, 27 mm i diameter (pil). Visa figur 2
Figur 2: CT av halsen: Multipla nekrotiska cervikala lymfkörtlar, den största subkutana, 27 mm i diameter (pil). Visa figur 2
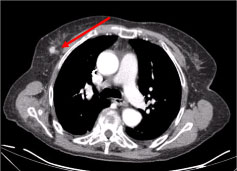 Figur 3: CT-skanning av bröstkorgen: 10 mm stor lesion på högra bröstkörteln, nodulärt oregelbunden, med ett hyperattenueringstecken som tyder på vaskularisering (pil). Visa figur 3
Figur 3: CT-skanning av bröstkorgen: 10 mm stor lesion på högra bröstkörteln, nodulärt oregelbunden, med ett hyperattenueringstecken som tyder på vaskularisering (pil). Visa figur 3
En öppen biopsi utfördes, som visade mjukdelsinfiltration av polymorfa kärnleukocyter och histiocyter samt vaskulit. Gram-, Grocott-, Ziehl-Neelsen- och PAS-färgningar var negativa; polymeraskedjereaktions (PCR)-baserad analys för påvisande av Mycobacterium tuberculosis i vävnad var också negativ.
Patienten skrevs ut med fortsatt uppföljning på bröstkirurgiska och käk- och ansiktskirurgiska kliniken.
På bröstkirurgiska kliniken utfördes en ultraljudsstyrd kärnnålsbiopsi av bröstlesionen. Invasivt bröstkarcinom NOS, grad 1 diagnostiserades. Tumören var ER-positiv (90 %), PR-positiv (90 %), HER2 2+ genom immunohistokemi, ISH-negativ, med ett proliferationsindex (Ki67) på 10 % (luminal A molekylär subtyp) (figur 4). Den klassificerades som cT1N0M0. Vid denna tidpunkt började patienten med tamoxifen.
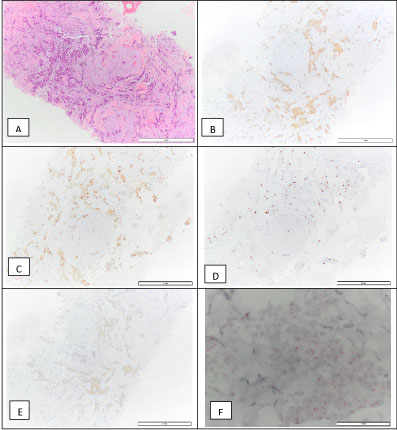 Figur 4: Biopsi av invasivt bröstkarcinom: H&E (A), positiv för östrogenreceptor – 90 % (B), positiv för progesteronreceptor – 90 % (C), Ki67 – 10 % (D), HER2 2+ (E) och en negativ D-ISH HER2-amplifiering (F), vilket är förenligt med en molekylär subtyp luminal A. View Figure 4
Figur 4: Biopsi av invasivt bröstkarcinom: H&E (A), positiv för östrogenreceptor – 90 % (B), positiv för progesteronreceptor – 90 % (C), Ki67 – 10 % (D), HER2 2+ (E) och en negativ D-ISH HER2-amplifiering (F), vilket är förenligt med en molekylär subtyp luminal A. View Figure 4
Två månader senare var mykobakteriekulturen av den öppna biopsin positiv för Mycobacterium tuberculosis complex, känslig för alla första linjens antibiotika. Patienten inledde behandling med första linjens antituberkulostatika (300 mg isoniazid, 600 mg rifampicin, 1500 mg pyrazinamid och 1200 mg etambutol i 2 månader, följt av 4 månader med 300 mg isoniazid och 600 mg rifampicin) och remitterades till tuberkuloskliniken för uppföljning.
Patienten avled 1 år efter den första diagnosen.
Diskussion
Som tidigare diskuterats påverkas diagnosen av en halsmassa av flera faktorer. Ålder och svaghet är viktiga faktorer att ta hänsyn till.
Åldrande är förknippat med en minskning av immunsvaret, ofta beskrivet som Immunosenescence . Det påverkar både det adaptiva och det medfödda systemet, på olika sätt . Det adaptiva immunsystemet minskar ofta i funktion, vanligen genom en minskning av T-cellernas aktivitet . Å andra sidan har det medfödda immunförsvaret beskrivits som överdrivet på grund av bristande reglerande förmåga, vilket kan leda till ett proinflammatoriskt tillstånd, vilket också är skadligt . Immunosenescens har förknippats med en ökad frekvens och svårighetsgrad av infektioner , en sämre immunövervakning av maligna celler och en minskad effektivitet vid vaccination .
Därmed bidrar immunosenescens till den ökade cancerdiagnosen hos äldre, med en medianålder på 70 år vid diagnosen . Andra faktorer spelar en roll, t.ex. den längre tid som äldre celler utsätts för karcinogenes eller högre känslighet hos äldre celler för karcinogenes , men också det ökade paradoxala inflammatoriska svaret .
Infektioner är mer frekventa hos äldre, särskilt luftvägsinfektioner , med stor dödlighet förknippad. Tuberkulos är ett viktigt folkhälsoproblem som drabbar 9,6 miljoner människor i världen och har ökat i befolkningen över 65 år . Det har föreslagits att tuberkulos hos äldre ofta beror på reaktivering av latent tuberkulos när det cellulära immunsvaret avtar . Den kan dock också bero på primärinfektion eller återinfektion hos en tidigare behandlad patient . Andra faktorer ökar risken för tuberkulos hos äldre, t.ex. att bo på ett vårdhem, vilket ökar risken 2-3 gånger . Vissa komorbiditeter, som diabetes mellitus , kronisk obstruktiv lungsjukdom , leversjukdom, malignitet och kardiovaskulära sjukdomar ; immunosuppressiva behandlingar med kortikoider och anti-TNF ; och undernäring .
Tuberkulos hos äldre har en atypisk klinisk presentation . Den huvudsakliga presentationen är fortfarande pulmonell i 75 % av fallen , men extrapulmonella platser är mer frekventa . Organspecifika symtom är mindre frekventa, och patienterna uppvisar mer vaga symtom, t.ex. asteni och kognitiv försämring . Diagnosen är också svårare eftersom äldre personer ofta har kroniska avvikelser, t.ex. onormala leverenzymer, hypoalbuminemi, hyponatrinemi, hypokalemi och anemi . Radiografiskt finns det färre kroniska förändringar . Tuberkulintestet är ofta obestämt på grund av anergi, och det finns ett behov av att upprepa testet för att dra nytta av förstärkningseffekten . Provodlingar kan vara negativa . Behandlingen är också en utmaning hos äldre personer på grund av sämre följsamhet och polyfarmaci med ökad risk för toxicitet, särskilt hepatotoxicitet . Mortaliteten är också betydligt högre; upp till 10 gånger högre .
Denna fallbeskrivning illustrerar utmaningarna med att diagnostisera en halsmassa hos äldre. Lokala inflammatoriska tecken tydde på infektion, men de systemiska symtomen väckte misstanke om malignitet. I efterhand kan vi hävda att flera tecken och laboratorietester kunde tyda på tuberkulos, såsom inflammatoriska tecken, resistens mot antibiotika, anemi och hyponatremi. Den samtidiga diagnosen av invasivt bröstcancer var ett tillfälligt fynd. Det är dock rimligt att anta att cancer kan ha bidragit till immunosenescens och underlättat reaktivering av latent tuberkulos.
Finansiellt stöd
Det fanns inget finansiellt stöd.
Författarnas bidrag
Alla författare har bidragit i lika stor utsträckning.
- Gleeson M, Herbert A, Richards A (2000) Management of lateral neck masses in adults. BMJ 320: 1521-1524.
- Schwetschenau E, Kelley DJ (2002) The adult neck mass. Am Fam Physician 66: 831-838.
- Armstrong WB, Giglio MF (1998) Is this lump in the neck anything to worry about? Postgrad Med 104.
- Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307. Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.
- Barnes L (1996) Pathology of the head and neck: General considerations. (3rd edn), In: Myers EN, Suen JY, 17-32.
- Goffart, Y, Hamoir M, Deron P, Claes J, Remacle M (2005) Management of neck masses in adults. B-ENT 1: 133-140.
- Karem KL, Paddock CD, Regnery RL (2000) Bartonella henselae, B. quintana, and B. bacilliformis: historical pathogens of emerging significance. Microbes Infect 2: 1193-1205.
- Mccabe RE, Brooks RG, Dorfman RF, Remington JS (1987) Clinical spectrum in 107 cases of toxoplasmic lymphadenopathy. Rev Infect Dis 9: 754-774.
- Landau A, Reese DJ, Blumenthal DR, Chin NW (1990) Tophaceous neck mass presenting as a thyroglossal duct cyst. Arthritis Rheum 33: 910-911.
- Hytiroglou P, Brandwein MS, Strauchen JA, Mirante JP, Urken ML, et al. (1992) Inflammatory pseudotumor of the parapharyngeal space: case report and review of the literature. Head Neck 14: 230-234.
- Armstrong WB, Allison G, Pena F, Kim JK (1998) Kimura’s disease: two case reports and a literature review. Ann Otol Rhinol Laryngol 107: 1066-1071.
- YI AY, deTar M, Becker TS, Rice DH (1995) Giant lymph node hyperplasia of the head and neck (Castleman’s disease): a report of five cases. Otolaryngol Head Neck Surg 113: 462-466.
- Shah Uk, White JA, Gooey JE, Hybels RL (1997) Otolaryngologiska manifestationer av sarkoidos: presentation och diagnos. Laryngoscope 107: 67-75.
- Underhill T, Mcguirt F, Williams D (2000) Advances in imaging head and neck tumors. Current Opinion in Otolaryngology Head and Neck Surgery 8: 91-97.
- Ponnappan S, Ponnappan U (2011) Aging and immune function: molecular mechanisms to interventions. Antioxid Redox Signal 14: 1551-1585.
- Gruver AL, Hudson LL, Sempowski GD (2007) Immunosenescence of ageing. J Pathol 211: 144-156.
- Foster AD, Sivarapatna A, Gress RE (2012) The aging immune system and its relationship with cancer. Aging health 7: 707-718.
- Stervbo U, Meier S, Mälzer JN, Baron U, Bozzetti C, et al. (2015) Effekter av åldrande på mänskliga leukocyter (del I): immunofenotypning av medfödda immunceller. Age (Dordr) 37: 92.
- Mcelhaney JE, Effros RB (2009) Immunosenescence: what does it mean to health outcomes in older adults? Curr Opin Immunol 21: 418-424.
- Gloeckler Ries LA, Reichman ME, Lewis DR, Hankey BF, Edwards BK (2003) Cancer survival and incidence from the Surveillance, Epidemiology, and End Results (SEER) program. Oncologist 8: 541-552.
- Finkel T, Serrano M, Blasco MA (2007) The common biology of cancer and ageing. Nature 448: 767-774.
- Vasto S, Carruba G, Lio D, Colonna-Romano G, Di Bona D, et al. (2009) Inflammation, åldrande och cancer. Mech Ageing Dev 130: 40-45.
- Gardner ID (1980) The effect of aging on susceptibility to infection. Rev Infect Dis 2: 801-810.
- Bellmann-Weiler R, Weiss G (2009) Pitfalls in the diagnosis and therapy of infections in elderly patients–a mini-review. Gerontology 55: 241-249.
- LI J, Chung PH, Leung CLK, Nishikiori N, Chan EYY, et al. (2017) The strategic framework of tuberculosis control and prevention in the elderly: a scoping review towards End TB targets. Infect Dis Poverty 6: 70.
- Byng-Maddick R, Noursadeghi M (2016) Does tuberculosis threaten our ageing populations? BMC Infect Dis 16: 119.
- Negin J, Abimbola S, Marais BJ (2015) Tuberculosis among older adults–time to take notice. Int J Infect Dis 32: 135-137.
- Rajagopalan S (2001) Tuberculosis and aging: a global health problem. Clin Infect Dis 33: 1034-1039.
- Rajagopalan S (2016) Tuberculosis in Older Adults. Clin Geriatr Med 32: 479-491.
- Chan E (2006) Tuberculosis in the elderly: Keep a high index of suspicion. Journal of Respiratory Diseases 27: 307-315.
- Jeon CY, Murray MB (2008) Diabetes mellitus ökar risken för aktiv tuberkulos: en systematisk genomgång av 13 observationsstudier. PLoS Med 5: e152.
- Inghammar M, Ekbom A, Engström G, Ljungberg B, Romanus V, et al. (2010) COPD and the risk of tuberculosis–a population-based cohort study. PLoS One 5: e10138.
- Brode SK, Jamieson FB, Ng R, Campitelli MA, Kwong JC, et al. (2015) Increased risk of mycobacterial infections associated with anti-rheumatic medications. Thorax 70: 677-682.
- Morris CD (1990) Pulmonary tuberculosis in the elderly: a different disease? Thorax 45: 912-913.
- Pérez-Guzmán C, Vargas MH, Torres-Cruz A, Villarreal-Velarde H (1999) Does aging modify pulmonary tuberculosis?: En metaanalytisk genomgång. Chest 116: 961-967.
- Dutt AK, Stead WW (1993) Tuberculosis in the elderly. Med Clin North Am 77: 1353-1368.
- Nagami Ph, Yoshikawa Tt (1983) Tuberculosis in the geriatric patient. J Am Geriatr Soc 31: 356-363.
- Kwon YS, Chi SY, Oh IJ, Kim KS, Kim YI, et al. (2013) Clinical characteristics and treatment outcomes of tuberculosis in the elderly: a case control study. BMC Infect Dis 13: 121.
- Thompson NJ, Glassroth JL, Snider DE Jr, Farer LS (1979) The booster phenomenon in serial tuberculin testing. Am Rev Respir Dis 119: 587-597.
- Borgdorff MW, Veen J, Kalisvaart NA, Nagelkerke N (1998) Mortalitet bland tuberkulospatienter i Nederländerna under perioden 1993-1995. Eur Respir J 11: 816-820.
Citation
de Figueiredo IR, Alves RV, Castro SG, Lourenço F, Antunes AM, et al. (2019) A Submandibular Mass in an Elderly Patient. J Geriatr Med Gerontol 5:064. doi.org/10.23937/2469-5858/1510064