Det här är en kortfattad översikt över information relaterad till FDA:s godkännande att marknadsföra denna produkt. Se länkarna nedan till sammanfattningen av data om säkerhet och effektivitet (SSED) och produktens märkning för mer fullständig information om denna produkt, dess indikationer för användning och grunden för FDA:s godkännande.
Produktnamn: Axonics Sacral Neuromodulation System
PMA Applicant: Axonics Modulation Technologies, Inc.
Address: Axonics Sacral Sacral Sacral, Inc: Adress: 26 Technology Drive, Irvine, CA 92618
Godkännandedatum: 1: Godkännandebrev: 13 november 2019
Godkännandebrev: 1: Approval Order
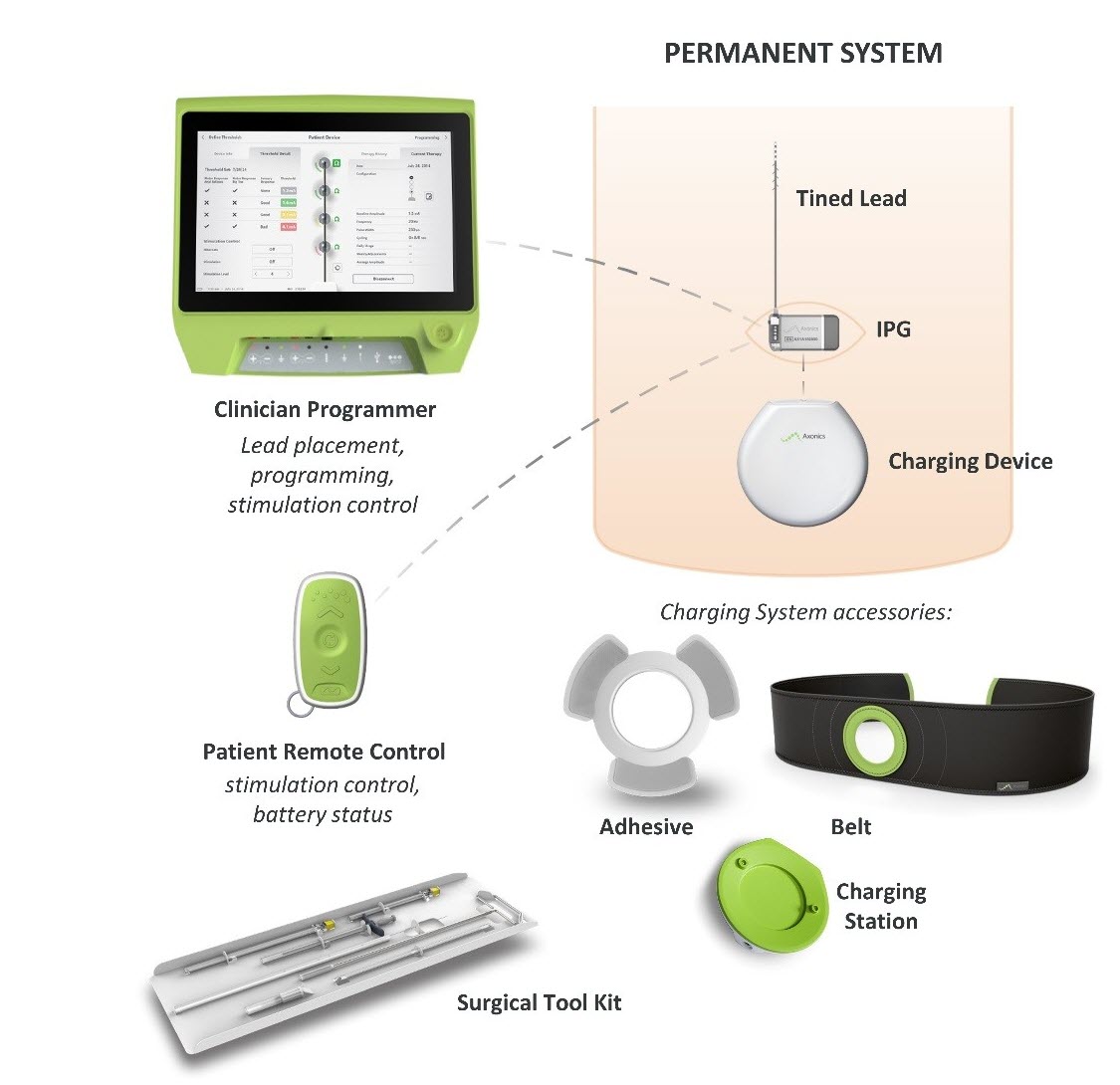
Vad är det? Axonics Sacral Neuromodulation (SNM) System är ett system för sakral nervstimulering (SNS) som är avsett att behandla urinretention och symtom på överaktiv blåsa. Det använder en implanterad stimulator för att leverera elektriska pulser genom en ledartråd till elektroder som är placerade nära sakralnerven.
Hur fungerar det? En implanterbar pulsgenerator (IPG) placeras kirurgiskt under huden i övre delen av skinkan och fästs vid en ledningstråd som passerar mellan höftbenen i bäckenet och slutar vid sakralnerven. IPG:n skickar elektriska pulser genom ledningskabeln till sakrala nerven som går från ryggmärgen till blåsan för att hjälpa till att förbättra urineringskontrollen.
När används den? Axonics SNM-system för urinreglering används för behandling av urinretention och symtom på överaktiv blåsa hos patienter som har misslyckats med eller inte kunnat tolerera andra behandlingar, såsom livsstilsförändringar, bäckenbottenövningar eller medicinering. Om de inte behandlas kan urinretention och överaktiv blåsa minska patientens livskvalitet och resultera i betydande utmaningar när det gäller att upprätthålla aktiviteter i det dagliga livet.
Vad kommer det att åstadkomma? Resultaten från en klinisk studie av Axonics SNM-system i kombination med ytterligare kliniska data som sammanställts från en systematisk genomgång av den litteratur som finns tillgänglig för en liknande SNM-enhet visar att det finns fördelar för de flesta patienter med urinretention och symtom på överaktiv blåsa som har misslyckats med eller inte kunnat tolerera andra behandlingar. I Axonics kliniska studie av patienter med trängningsinkontinens uppnådde 90 % (116/129) av patienterna med det implanterade SNM-systemet en minst 50 % minskning av antalet trängningsläckage efter 6 månader jämfört med antalet trängningsläckage utan SNM-systemet. I en mer långsiktig studie (van Kerrebroeck, 2007) följdes 152 patienter som fått ett liknande SNM-system implanterat i 5 år. Efter 5 år hade 58 % (56/96) av patienterna med trängningsinkontinens förbättrats med minst 50 % (mätt i antal läckage per dag). Efter 5 år hade dessutom 40 % (10/25) av patienterna med trängningsfrekvens minst 50 % förbättring (mätt i antal tömningar per dag), och 58 % (18/31) av patienterna med urinretention hade minst 50 % förbättring (mätt i antal kateteriseringar per dag). Med tanke på likheterna i utformning, teknik, prestanda, indikationer för användning, utdataegenskaper och den patientpopulation som det är avsett att behandla, anser FDA att Axonics SNM-system kommer att ha liknande prestanda som det kommersiellt tillgängliga SNM-systemet som utvärderats i de publicerade studierna.
Var får det inte användas? Axonics SNM-system ska inte användas hos:
- Patienter som inte har visat ett lämpligt svar på teststimulering; eller
- Patienter som inte kan använda Axonics SNM-system
Tillkommande information (inklusive varningar, försiktighetsåtgärder och biverkningar):
- Sammanfattning av data om säkerhet och effektivitet
- Patientmärkning
- Märkning för läkare
- PMA Database Entry