Abstract
El diagnóstico de una masa en el cuello puede suponer un reto. En el adulto el diagnóstico más frecuente es la malignidad, y deben considerarse tanto los tumores primarios como los metastásicos. Otras opciones frecuentes son los procesos infecciosos. Presentamos el caso de una paciente de 88 años con una masa submandibular con signos inflamatorios, que no responde a la terapia antibiótica, y cuya biopsia por aspiración con aguja fina mostró una lesión inflamatoria. La masa se desarrolló durante un mes con anorexia asociada, por lo que fue ingresada para el diagnóstico con biopsia abierta. Tras el ingreso, se diagnosticó un carcinoma invasivo de la mama derecha, y el cultivo de micobacterias de la biopsia de la masa submandibular fue positivo para Mycobacterium tuberculosis. La inmunosenescencia de los ancianos contribuye a la vulnerabilidad a los cánceres, pero también a las infecciones, que pueden presentarse de forma atípica y, por tanto, dar lugar a un retraso en el diagnóstico.
Introducción
El diagnóstico diferencial de las masas del cuello es extremadamente difícil, ya que hay que tener en cuenta varios factores. La principal opción diagnóstica en adultos es la malignidad, ya sea primaria, metastásica de tumores del tracto respiratorio superior o digestivo, o linfoma . También pueden encontrarse neoplasias benignas como lipomas, fibromas y hemangiomas.
El 75% de las masas del cuello en pacientes mayores de 40 años son malignas , y el riesgo aumenta con la edad . El tamaño de la lesión y la duración de los síntomas son otros predictores importantes del riesgo de malignidad , así como la exposición crónica al sol, el tabaquismo, el consumo de alcohol, la mala dentición, las exposiciones ambientales y los antecedentes familiares.
Las características físicas de la masa también son importantes para el diagnóstico diferencial. Las masas sólidas, duras o fijas, con límites irregulares son sugestivas de neoplasias sólidas; las masas múltiples blandas y gomosas sugieren linfoma; las masas con signos inflamatorios sugieren causas infecciosas .
Las masas inflamatorias pueden ser el resultado de la inflamación de los ganglios linfáticos (adenitis cervical), que suelen ser autolimitadas y resolverse espontáneamente . También es posible la inflamación crónica de las glándulas submandibulares o parótidas con sialadenitis crónica.
Las causas infecciosas pueden ser de naturaleza viral, bacteriana o fúngica . Las infecciones víricas como el Citomegalovirus (CMV), el Epstein-Barrvirus (EBV), el sarampión, el Adenovirus, el Ecovirus, el Rinovirus y el Virus Sincitial Respiratorio (VSR) suelen presentarse con múltiples ganglios linfáticos con adenitis cervical. Las infecciones bacterianas pueden causar necrosis, con formación de abscesos, drenaje espontáneo e incluso formación de fístulas crónicas. También hay que considerar otros agentes, como las micobacterias, la enfermedad por arañazo de gato por Bartonella, la actinomicosis y el Toxoplasma gondii.
Otras causas menos frecuentes son la gota, el pseudotumor inflamatorio, la enfermedad de Kimura, la enfermedad de Castleman y la sarcoidosis.
El diagnóstico suele realizarse mediante citología por aspiración con aguja fina, que es un método rápido y sensible. Si el diagnóstico no está claro, puede ser necesaria una biopsia abierta . Las pruebas de laboratorio varían en función de la presentación, pero deben incluir parámetros inflamatorios como el recuento de leucocitos, la velocidad de sedimentación globular (VSG), la proteína C reactiva (PCR), la serología vírica y bacteriana según la historia clínica y la exploración y la prueba cutánea de la tuberculina . La caracterización de la masa puede realizarse con ecografía, que permite diferenciar las lesiones quísticas, los tumores de las glándulas salivales y los ganglios linfáticos reactivos o malignos mediante criterios como el tamaño y la vascularización . La tomografía computarizada (TC) y la resonancia magnética (RM) también ayudan a caracterizar las masas en función del tamaño y de las anomalías morfológicas (necrosis central, encallamiento de la grasa y heterogeneidad). La tomografía por emisión de positrones puede utilizarse para estudiar las masas del cuello, ya que detecta un aumento del metabolismo, pero no se recomienda como prueba independiente, ya que no distingue las lesiones inflamatorias de las neoplásicas. En caso de sospecha de malignidad, se deben realizar estudios complementarios, incluyendo TAC de cuerpo entero y estudios endoscópicos del tracto respiratorio superior y digestivo.
Informe de un caso
Presentamos el caso de una mujer de 88 años, frágil, que vive en una residencia de ancianos, que acudió a urgencias por un cuadro de postración progresiva de 3 a 4 semanas, anorexia y una masa submandibular derecha con signos inflamatorios. Estaba siendo estudiada por el Servicio de Cirugía Maxilofacial, que había realizado una citología por aspiración con aguja fina de la masa que reveló células inflamatorias, negativas para células neoplásicas. Además, ya había sido medicada con amoxicilina-ácido clavulánico por vía oral (875 mg/125 mg 3id durante 7 días), sin que hubiera mejorado.
Sus antecedentes médicos incluían hipertensión esencial, bradicardia sinusal, enfermedad arterial periférica, deterioro cognitivo leve y depresión. Estaba polimedicada con aspirina, olmesartán, pentoxifilina, paroxetina y alprazolam.
En la exploración era obesa, presentaba una masa submandibular no sensible de 3 × 3 cm, sólida pero gomosa, con signos inflamatorios, sin exudado (Figura 1). Permanecía afebril sin otros signos clínicos relevantes.
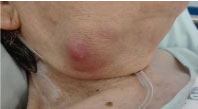 Figura 1: Fotografía de la masa submandibular derecha. Ver Figura 1
Figura 1: Fotografía de la masa submandibular derecha. Ver Figura 1
Considerando la progresión de la enfermedad la paciente fue ingresada para realizar más pruebas, incluyendo una biopsia abierta de la masa, y se inició tratamiento empírico con amoxicilina-ácido clavulánico intravenoso (1000 mg/200 mg durante 9 días más) y clindamicina (600 mg 4id durante 7 días), también sin mejoría clínica.
Los análisis de sangre sólo mostraron una anemia microcítica hipocrómica con deficiencia de hierro y parámetros inflamatorios negativos (Tabla 1).
Tabla 1: Análisis de sangre de la paciente.Ver Tabla 1
Una tomografía computarizada (TC) de cuerpo entero reveló múltiples ganglios linfáticos cervicales necróticos, el mayor en la fosa supraclavicular izquierda y un nódulo en la glándula mamaria derecha, irregular con signo hiperatenuante sugestivo de vascularización (Figura 2 y Figura 3).
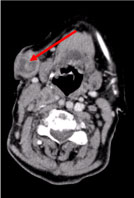 Figura 2: TC de cuello: Múltiples ganglios linfáticos cervicales necróticos, el mayor subcutáneo, de 27 mm de diámetro (flecha). Ver Figura 2
Figura 2: TC de cuello: Múltiples ganglios linfáticos cervicales necróticos, el mayor subcutáneo, de 27 mm de diámetro (flecha). Ver Figura 2
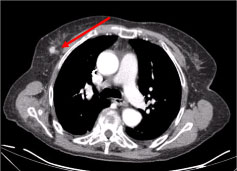 Figura 3: TC de tórax: Lesión de 10 mm en la glándula mamaria derecha, nodular irregular, con signo hiperatenuante sugestivo de vascularización (flecha). Ver Figura 3
Figura 3: TC de tórax: Lesión de 10 mm en la glándula mamaria derecha, nodular irregular, con signo hiperatenuante sugestivo de vascularización (flecha). Ver Figura 3
Se realizó una biopsia a cielo abierto, que mostró infiltración de tejidos blandos por leucocitos e histiocitos nucleares polimorfos y vasculitis. Las tinciones de Gram, Grocott, Ziehl-Neelsen y PAS fueron negativas; el ensayo basado en la reacción en cadena de la polimerasa (PCR) para la detección de Mycobacterium tuberculosis en el tejido también fue negativo.
La paciente fue dada de alta con seguimiento posterior en las clínicas de Cirugía Mamaria y Cirugía Maxilofacial.
En la clínica de Cirugía Mamaria se realizó una biopsia con aguja gruesa guiada por ecografía de la lesión mamaria. Se diagnosticó carcinoma invasivo de mama NOS, grado 1. El tumor era ER-positivo (90%), PR-positivo (90%), HER2 2+ por inmunohistoquímica, ISH negativo, con un índice de proliferación (Ki67) del 10% (subtipo molecular luminal A) (Figura 4). Se clasificó como cT1N0M0. En ese momento, la paciente comenzó a recibir tamoxifeno.
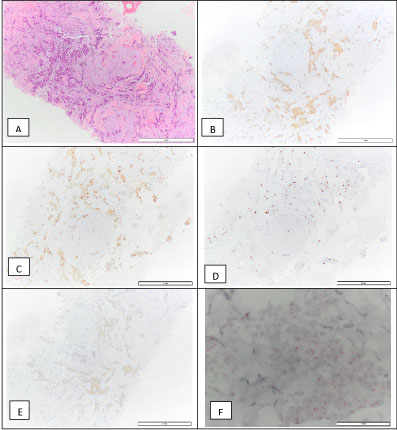 Figura 4: Biopsia de carcinoma invasivo de mama: H&E (A), positivo para el receptor de estrógenos – 90% (B), positivo para el receptor de progesterona – 90% (C), Ki67 – 10% (D), HER2 2+ (E), y una amplificación de HER2 D-ISH negativa (F), que es compatible con un subtipo molecular luminal A. Ver Figura 4
Figura 4: Biopsia de carcinoma invasivo de mama: H&E (A), positivo para el receptor de estrógenos – 90% (B), positivo para el receptor de progesterona – 90% (C), Ki67 – 10% (D), HER2 2+ (E), y una amplificación de HER2 D-ISH negativa (F), que es compatible con un subtipo molecular luminal A. Ver Figura 4
Dos meses después, el cultivo micobacteriano de la biopsia abierta fue positivo para Mycobacterium tuberculosis complex, sensible a todos los antibióticos de primera línea. La paciente inició tratamiento con agentes antituberculostáticos de primera línea (300 mg de isoniazida, 600 mg de rifampicina, 1500 mg de pirazinamida y 1200 mg de etambutol durante 2 meses, seguido de 4 meses de 300 mg de isoniazida y 600 mg de rifampicina) y fue remitida a la clínica de tuberculosis para su seguimiento.
El paciente falleció 1 año después del diagnóstico inicial.
Discusión
Como se ha comentado anteriormente, el diagnóstico de una masa en el cuello se ve afectado por varios factores. La edad y la fragilidad son factores importantes a tener en cuenta.
El envejecimiento se asocia con una disminución de la respuesta inmunitaria, a menudo descrita como Inmunosenescencia . Afecta tanto al sistema adaptativo como al innato, de diferentes maneras. La función del sistema inmunitario adaptativo suele disminuir, normalmente por un descenso de la actividad de las células T. Por otra parte, se ha descrito que el sistema inmunitario innato es excesivo por falta de poder regulador, lo que puede dar lugar a un estado aproinflamatorio, que también es perjudicial . La inmunosenescencia se ha asociado con un aumento de la frecuencia y la gravedad de las infecciones, una menor vigilancia inmunitaria de las células malignas y una menor eficacia en la vacunación.
Por lo tanto, la inmunosenescencia contribuye al aumento del diagnóstico de cáncer en las personas mayores, con una edad media de 70 años en el momento del diagnóstico. Otros factores influyen, como el mayor tiempo de exposición a la carcinogénesis o la mayor susceptibilidad de las células de mayor edad a la carcinogénesis , pero también el aumento de la respuesta inflamatoria paradójica.
Las infecciones son más frecuentes en los ancianos, en particular las del tracto respiratorio, con una gran mortalidad asociada. La tuberculosis es un importante problema de salud pública que afecta a 9,6 millones de personas en todo el mundo y ha ido aumentando en la población mayor de 65 años . Se ha sugerido que la tuberculosis en los ancianos suele ser el resultado de la reactivación de la tuberculosis latente, ya que la respuesta inmunitaria celular disminuye. Sin embargo, también puede ser el resultado de una infección primaria o una reinfección en un paciente previamente tratado . Hay otros factores que aumentan el riesgo de tuberculosis en los ancianos, como el hecho de residir en una residencia de ancianos, que multiplica por 2 el riesgo . Algunas comorbilidades, como la diabetes mellitus, la enfermedad pulmonar obstructiva crónica, la enfermedad hepática, la malignidad y las enfermedades cardiovasculares; las terapias inmunosupresoras con corticoides y anti TNF; y la malnutrición.
La tuberculosis en los ancianos tiene una presentación clínica atípica. La presentación principal sigue siendo pulmonar en el 75% de los casos , pero las localizaciones extrapulmonares son más frecuentes . Los síntomas específicos de los órganos son menos frecuentes, y los pacientes presentan síntomas más vagos, como astenia y deterioro cognitivo. El diagnóstico también es más difícil, ya que los ancianos presentan frecuentes anomalías crónicas, como enzimas hepáticas anormales, hipoalbuminemia, hiponatremia, hipopotasemia, anemia . Desde el punto de vista radiográfico, hay menos cambios crónicos. La prueba cutánea de la tuberculina es a menudo indeterminada debido a la anergia, y es necesario repetirla aprovechando el efecto de refuerzo. Los cultivos de muestras pueden ser negativos . El tratamiento también es un reto en los ancianos, debido a un menor cumplimiento y a la polifarmacia con mayor riesgo de toxicidad, especialmente de hepatotoxicidad . La mortalidad también es significativamente mayor; hasta 10 veces más.
Este informe de caso ilustra los desafíos de diagnosticar una masa en el cuello en los ancianos. Los signos inflamatorios locales eran sugestivos de infección, pero los síntomas sistémicos hicieron sospechar de malignidad. En retrospectiva, podemos argumentar que varios signos y pruebas de laboratorio podrían sugerir tuberculosis, como los signos inflamatorios, la resistencia a los antibióticos, la anemia y la hiponatremia. El diagnóstico simultáneo de carcinoma de mama invasivo fue un hallazgo incidental. Sin embargo, es razonable suponer que el cáncer puede haber contribuido a la inmunosenescencia, facilitando la reactivación de la tuberculosis latente.
Apoyo financiero
No hubo apoyo financiero.
Contribución de los autores
Todos los autores contribuyeron por igual.
- Gleeson M, Herbert A, Richards A (2000) Management of lateral neck masses in adults. BMJ 320: 1521-1524.
- Schwetschenau E, Kelley DJ (2002) The adult neck mass. Am Fam Physician 66: 831-838.
- Armstrong WB, Giglio MF (1998) ¿Hay que preocuparse por este bulto en el cuello? Postgrad Med 104.
- Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.
- Barnes L (1996) Pathology of the head and neck: Consideraciones generales. (3ª ed.), En: Myers EN, Suen JY, 17-32.
- Goffart, Y, Hamoir M, Deron P, Claes J, Remacle M (2005) Management of neck masses in adults. B-ENT 1: 133-140.
- Karem KL, Paddock CD, Regnery RL (2000) Bartonella henselae, B. quintana, and B. bacilliformis: historical pathogens of emerging significance. Microbes Infect 2: 1193-1205.
- Mccabe RE, Brooks RG, Dorfman RF, Remington JS (1987) Clinical spectrum in 107 cases of toxoplasmic lymphadenopathy. Rev Infect Dis 9: 754-774.
- Landau A, Reese DJ, Blumenthal DR, Chin NW (1990) Tophaceous neck mass presenting as a thyroglossal duct cyst. Arthritis Rheum 33: 910-911.
- Hytiroglou P, Brandwein MS, Strauchen JA, Mirante JP, Urken ML, et al. (1992) Inflammatory pseudotumor of the parapharyngeal space: case report and review of the literature. Head Neck 14: 230-234.
- Armstrong WB, Allison G, Pena F, Kim JK (1998) Kimura’s disease: two case reports and a literature review. Ann Otol Rhinol Laryngol 107: 1066-1071.
- YI AY, deTar M, Becker TS, Rice DH (1995) Giant lymph node hyperplasia of the head and neck (Castleman’s disease): a report of five cases. Otolaryngol Head Neck Surg 113: 462-466.
- Shah Uk, White JA, Gooey JE, Hybels RL (1997) Otolaryngologic manifestations of sarcoidosis: presentation and diagnosis. Laryngoscope 107: 67-75.
- Underhill T, Mcguirt F, Williams D (2000) Advances in imaging head and neck tumors. Current Opinion in Otolaryngology Head and Neck Surgery 8: 91-97.
- Ponnappan S, Ponnappan U (2011) Aging and immune function: molecular mechanisms to interventions. Antioxid Redox Signal 14: 1551-1585.
- Gruver AL, Hudson LL, Sempowski GD (2007) Inmunosenescencia del envejecimiento. J Pathol 211: 144-156.
- Foster AD, Sivarapatna A, Gress RE (2012) El sistema inmunitario que envejece y su relación con el cáncer. Aging health 7: 707-718.
- Stervbo U, Meier S, Mälzer JN, Baron U, Bozzetti C, et al. (2015) Efectos del envejecimiento en los leucocitos humanos (parte I): inmunofenotipado de las células inmunitarias innatas. Age (Dordr) 37: 92.
- Mcelhaney JE, Effros RB (2009) Immunosenescence: what does it mean to health outcomes in older adults? Curr Opin Immunol 21: 418-424.
- Gloeckler Ries LA, Reichman ME, Lewis DR, Hankey BF, Edwards BK (2003) Cancer survival and incidence from the Surveillance, Epidemiology, and End Results (SEER) program. Oncologist 8: 541-552.
- Finkel T, Serrano M, Blasco MA (2007) La biología común del cáncer y el envejecimiento. Nature 448: 767-774.
- Vasto S, Carruba G, Lio D, Colonna-Romano G, Di Bona D, et al. (2009) Inflammation, ageing and cancer. Mech Ageing Dev 130: 40-45.
- Gardner ID (1980) The effect of aging on susceptibility to infection. Rev Infect Dis 2: 801-810.
- Bellmann-Weiler R, Weiss G (2009) Pitfalls in the diagnosis and therapy of infections in elderly patients–a mini-review. Gerontology 55: 241-249.
- LI J, Chung PH, Leung CLK, Nishikiori N, Chan EYY, et al. (2017) El marco estratégico de control y prevención de la tuberculosis en los ancianos: una revisión de alcance hacia los objetivos de End TB. Infect Dis Poverty 6: 70.
- Byng-Maddick R, Noursadeghi M (2016) ¿Amenaza la tuberculosis a nuestras poblaciones que envejecen? BMC Infect Dis 16: 119.
- Negin J, Abimbola S, Marais BJ (2015) Tuberculosis among older adults–time to take notice. Int J Infect Dis 32: 135-137.
- Rajagopalan S (2001) Tuberculosis y envejecimiento: un problema de salud mundial. Clin Infect Dis 33: 1034-1039.
- Rajagopalan S (2016) Tuberculosis en adultos mayores. Clin Geriatr Med 32: 479-491.
- Chan E (2006) Tuberculosis en los ancianos: Mantener un alto índice de sospecha. Journal of Respiratory Diseases 27: 307-315.
- Jeon CY, Murray MB (2008) Diabetes mellitus increases the risk of active tuberculosis: a systematic review of 13 observational studies. PLoS Med 5: e152.
- Inghammar M, Ekbom A, Engström G, Ljungberg B, Romanus V, et al. (2010) COPD and the risk of tuberculosis–a population-based cohort study. PLoS One 5: e10138.
- Brode SK, Jamieson FB, Ng R, Campitelli MA, Kwong JC, et al. (2015) Mayor riesgo de infecciones micobacterianas asociadas a los medicamentos antirreumáticos. Thorax 70: 677-682.
- Morris CD (1990) Tuberculosis pulmonar en los ancianos: ¿una enfermedad diferente? Thorax 45: 912-913.
- Pérez-Guzmán C, Vargas MH, Torres-Cruz A, Villarreal-Velarde H (1999) ¿Modifica el envejecimiento la tuberculosis pulmonar? Una revisión meta-analítica. Chest 116: 961-967.
- Dutt AK, Stead WW (1993) Tuberculosis in the elderly. Med Clin North Am 77: 1353-1368.
- Nagami Ph, Yoshikawa Tt (1983) Tuberculosis in the geriatric patient. J Am Geriatr Soc 31: 356-363.
- Kwon YS, Chi SY, Oh IJ, Kim KS, Kim YI, et al. (2013) Características clínicas y resultados del tratamiento de la tuberculosis en los ancianos: un estudio de casos y controles. BMC Infect Dis 13: 121.
- Thompson NJ, Glassroth JL, Snider DE Jr, Farer LS (1979) The booster phenomenon in serial tuberculin testing. Am Rev Respir Dis 119: 587-597.
- Borgdorff MW, Veen J, Kalisvaart NA, Nagelkerke N (1998) Mortality among tuberculosis patients in The Netherlands in the period 1993-1995. Eur Respir J 11: 816-820.
Citación
de Figueiredo IR, Alves RV, Castro SG, Lourenço F, Antunes AM, et al. (2019) Una masa submandibular en un paciente anciano. J Geriatr Med Gerontol 5:064. doi.org/10.23937/2469-5858/1510064