- Qué es el lutecio
- ¿Dónde se encuentra el lutecio
- Historia
- Identificación del lutecio
- Propiedades y características del lutecio
- Propiedades generales
- Propiedades físicas
- Propiedades químicas
- Datos atómicos del lutecio (elemento 71)
- ¿Para qué se utiliza
- Posibles efectos sobre la salud
- Hechos interesantes
- Costo del lutecio
Qué es el lutecio
El lutecio es un metal plateado, duro y denso de las tierras raras clasificado como lantánido y representado por el símbolo químico Lu . Es el último elemento químico perteneciente a la serie de los lantánidos, siendo el isótopo estable más abundante en la naturaleza el 175Lu (97,4% de abundancia). Otro isótopo radiactivo de larga vida, el 176Lu, tiene un periodo de semidesintegración de 3,78 X 1010 años.

Símbolo del lutecio
¿Dónde se encuentra el lutecio
El lutecio, al igual que otros lantánidos, se obtiene comercialmente del mineral monacita . Dado que se encuentra en pequeñas cantidades (alrededor del 0,003%) en la monacita , su extracción puede ser difícil y se realiza mediante la reducción del fluoruro anhidro utilizando calcio metal . Aunque el elemento se encuentra en cantidades mínimas en casi todos los minerales que contienen itrio, pueden considerarse fuentes naturales de lutecio. Los tres principales países productores de lutecio son China, Rusia y Malasia, mientras que los tres principales países con reservas son China, los países de la CEI y Estados Unidos.

Lutecio
Historia
Origen de su nombre: El nombre del elemento deriva de la palabra romana ‘Lutetia’, el antiguo nombre de la ciudad francesa de París .
Quién lo descubrió: Aunque el químico francés Georges Urbain, el químico estadounidense Charles James y el científico austriaco Carl Auer von Welsbach descubrieron el elemento de forma independiente, el mérito del descubrimiento recayó en Urbain, ya que fue el primero en comunicar los resultados .
Cuándo y cómo se descubrió
El mineral gadolinita o itrio, descubierto en 1794, ha sido la fuente de la itria, la terbia, la erbia y otros elementos de tierras raras . El químico suizo Jean Charles Marignac separó la erbia en dos componentes que incluían la iterbia y la erbia, de los cuales se creía que la iterbia era un compuesto de iterbio.
En 1907, Georges Urbain, mientras experimentaba en la Sorbona de París, aisló con éxito el iterbio en dos elementos, a los que denominó lutecio y neoiterbio . Sin embargo, estos elementos fueron rebautizados posteriormente como lutecio e iterbio, respectivamente, por los químicos. Carl Auer von Welsbach separó el elemento del iterbio y lo denominó cassipoium por la constelación circumpolar de Casiopea . Charles James también extrajo con éxito el elemento en la Universidad de New Hampshire .
Aunque es difícil de preparar, el lutecio metálico puro se produjo en 1953 .
Identificación del lutecio |
|||
| Número atómico | 71 | ||
| Número CAS | 7439-94-3 | ||
| Posición en la tabla periódica | Grupo | Período | Bloque |
| Lantánidos | 6 | f | |

Ubicación del lutecio en la tabla periódica
Propiedades y características del lutecio
Propiedades generales |
||||||||||||||||
| Masa atómica | 174.967 amu | |||||||||||||||
| Masa atómica relativa | 174.967 | |||||||||||||||
Propiedades físicas |
||||||||||||||||
| Color | Blanco plateado | |||||||||||||||
| Punto de fusión/punto de congelación | 1663 °C, 3025 °F | |||||||||||||||
| Punto de ebullición | 3402 °C, 6156 °F | |||||||||||||||
| Densidad | 9.84 g cm-3 | |||||||||||||||
| Estado de la materia a temperatura ambiente (sólido/líquido/gas) | Sólido | |||||||||||||||
| Dureza | ||||||||||||||||
| – Brinell | 893 MPa | |||||||||||||||
| – Mohs | 2.6 | |||||||||||||||
| – Vickers | 1160 MPa | |||||||||||||||
| Conductividad eléctrica | 1.8X106 S/m | |||||||||||||||
| Conductividad térmica | 16 W/(m K) | |||||||||||||||
| Calor específico | 154 J kg-1 K-1 | |||||||||||||||
| Módulo de masa | 47.6 GPa | |||||||||||||||
| Módulo de corte | 27,2 GPa | |||||||||||||||
| Módulo de Young | 68.6 GPa | |||||||||||||||
| Presión de vapor | ||||||||||||||||
| – Temperatura (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Presión (Pa) | – | – | – | 3.28X 10-11 | 1,59X 10-7 | 6,79X 10-5 | 6,28X 10-3 | 0,211 | 3,18 | 26.7 | – | |||||
Propiedades químicas |
||||||||||||||||
| Estados de oxidación | 3 | |||||||||||||||
| Isótopos | Isótopo | Masa | Abundancia | Half-vida | Modo de desintegración | |||||||||||
| 175Lu | 174.941 | 97,40 | – | – | ||||||||||||
| 176Lu | 175,943 | 2,60 | 3.73 X 1010 años | β-
β+ EC |
||||||||||||
Datos atómicos del lutecio (elemento 71)
| Valencia electrones | 3 | |||||||
| Números cuánticos | 2D3/2 | |||||||
| Configuración de electrones (configuración de gases nobles) | 4f145d16s2 | |||||||
| Estructura atómica | ||||||||
| – Número de electrones | 71 | |||||||
| – Número de neutrones | 104 | |||||||
| – Número de protones | 71 | |||||||
| Radio del átomo | ||||||||
| – Radio atómico | 2.24 Å | |||||||
| – Radio covalente | 1,74 Å | |||||||
| Electronegatividad (escala Pauling) | 1,0 | |||||||
| Afinidad de los electrones | 32.81 kJ mol-1 | |||||||
| Energía de ionización (kJ mol-1) | 1ª | 2ª | 3ª | 4ª | 5ª | 6ª | 7ª | 8ª |
| 523.516 | 1341.1 | 2022.275 | 4365.96 | 6445.2 | – | – | – | |
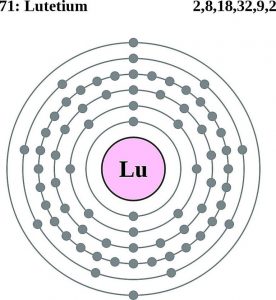
Configuración de los electrones del lutecio (modelo de Bohr)
¿Para qué se utiliza
Tiene poco uso práctico fuera de la investigación científica . A continuación se indican algunos usos comerciales del lutecio:
- Puede utilizarse como catalizador para el craqueo de productos petrolíferos en las refinerías de petróleo .
- La radioinmunoterapia con lutecio-177-dotato se utiliza como forma de tratamiento del cáncer, mientras que el lutecio-176 se emplea para la datación radiométrica de meteoritos .
- El oxiortosilicato de lutecio se utiliza en los detectores de PET (tomografía por emisión de positrones) para realizar un escáner médico que permite crear una imagen en 3D de la actividad celular en el cuerpo.
Posibles efectos sobre la salud
El lutecio tiene una baja toxicidad y no se le conocen funciones biológicas en el cuerpo humano; aunque se cree que puede ayudar a impulsar el metabolismo. También se cree que es un peligro de explosión.
Hechos interesantes
- El lutecio es el elemento más duro y denso del grupo de los lantánidos.
- Existe en compuestos generalmente en su estado trivalente, Lu3+.
- El elemento se representa a veces visualmente con una imagen basada en el escudo de París.
Costo del lutecio
La forma pura del lutecio cuesta unos 350 dólares por gramo , pero cuesta unos 7.000 dólares por 100 gramos a granel .
- http://www.rsc.org/periodic-table/element/71/lutetium
- https://education.jlab.org/itselemental/ele071.html
- https://www.livescience.com/38425-lutetium.html
- https://www.webelements.com/lutetium/isotopes.html
- https://www.chemicool.com/elements/lutetium.html
- http://periodictable.com/Elements/071/data.html
- http://web.newworldencyclopedia.org/entry/Lutetium
- https://hobart.k12.in.us/ksms/PeriodicTable/lutetium.htm