Esipuhe
Tässä artikkelissa esitetään henkilökohtainen näkemys siitä, mitä tarvittaisiin, jotta faagiterapia voisi vihdoin ja viimein lyödä itsensä läpi valtavirran antibakteerisena työkaluna. Se on saanut vaikutteita faagiterapia-alan historiallisista ja viimeaikaisista epäonnistumisista ja epävarmuustekijöistä, ja siinä pyritään löytämään ratkaisuja, jotka perustuvat tulevaisuuden ja kehittyviin teknologioihin, joiden oletetaan mallintavan huomisen tiedettä ja yhteiskuntaa.
Faagiterapia
Bakteriofagit (faagit) ovat bakteerien viruksia. Ikimuistoisista ajoista lähtien ne ovat kontrolloineet bakteeri-isäntänsä kasvua ja leviämistä. Bakteerivirukset ovat biosfäärimme kaikkialle levinneet elolliset olennot. Valtamerissä on arviolta 10 miljoonaa kertaa enemmän viruksia kuin maailmankaikkeudessa on tähtiä, ja jos kaikki maapallon faagit pinottaisiin päällekkäin, tämä torni ulottuisi kauemmas kuin 60 lähintä galaksia (Suttle, 2013). Niitä löytyy helposti sieltä, missä bakteerit viihtyvät: viemäreistä, joista tai potilaiden virtsasta ja ulosteesta. Ihmisen bakteeripatogeenien faagit koostuvat useimmiten ikosaedrisestä päästä, pallosta, jossa on 20 proteiineista valmistettua litteää pintaa ja joka sisältää nukleiinihappogenomin, johon on kiinnittynyt proteiinihäntä. Kun tiukasti lytinen faagi tarttuu häntäkuiduillaan ja piikeillään kohdebakteerinsa pintaan, ruiskumainen häntätuppi supistuu ja hännän ydin ajetaan bakteerin soluseinämän läpi ruiskuttaen faagin genomin bakteerisolun periplasmaan. Välittömästi bakteerin DNA- ja proteiinisynteesikoneisto kaapataan rakentamaan kopioita faagista. Jotkin faagit leikkaavat bakteerin DNA:n palasiksi. Minuuteista tunteihin kestävän piilevän jakson jälkeen vasta muodostuneet faagit purkautuvat ulos bakteeri-isännistään, jotka kuolevat prosessin aikana. Faagin jälkeläiset, joita voi olla satoja bakteeria kohti, lähtevät sitten etsimään uusia isäntäbakteereja tartuttaakseen. Näin ollen faageja voidaan pitää itseään monistavina mikrobilääkkeinä. Tärkeää on, että faagit ovat kehittyneet infektoimaan vain tiettyjä kohdebakteereja, ja ne ovat vaarattomia nisäkässoluille.
Englantilainen bakteriologi Frederick Twort raportoi varhaisista todisteista virusten kaltaisista aineista, joilla on antibakteerista aktiivisuutta, ja ranskalais-kanadalainen mikrobiologi Felix d’Hérelle raportoi niistä vuosina 1915 ja 1917 (Sulakvelidze et al., 2001). Vuonna 1919 d’Hérelle hyödynsi ensimmäistä kertaa faagien terapeuttista potentiaalia, kun hän käytti niitä parantaakseen punatautia sairastavan pojan Pariisissa. Faagihoito tunnustettiin välittömästi terapeuttiseksi lähestymistavaksi bakteeri-infektioiden hoitoon, ja useat yritykset, kuten L’Oréal Euroopassa ja Eli Lilly Company Yhdysvalloissa, ryhtyivät kaupallistamaan faagihoitovalmisteita (Sulakvelidze et al., 2001). Vuonna 1923 georgialainen mikrobiologi Giorgi Eliava perusti Georgian Tbilisiin Eliava-instituutin, joka oli omistautunut faagihoidon tutkimukselle. Se oli entisen Neuvostoliiton laajan faagihoitotutkimuksen ja -kehityksen alku. Faagiterapian varhaiset käyttökohteet olivat kuitenkin usein epäluotettavia, ja myös antibioottien tutkimus oli ollut käynnissä. Penisilliinin menestyksekäs käyttö toisen maailmansodan aikana ja sen myöhempi maailmanlaajuinen markkinointi saivat länsimaiset tutkijat menettämään kiinnostuksensa faagiterapiaa kohtaan. Neuvostoliittolaiset tutkijat sen sijaan jatkoivat faagiterapian kehittämistä ja tulostensa julkaisemista, mutta rautaesiripun vuoksi heidän tietonsa ja kokemuksensa eivät levinneet kaikkialle maailmaan (Sulakvelidze et al., 2001). Kolmannen vuosituhannen kynnyksellä antibiooteille resistenttien bakteerien aiheuttamien infektioiden aiheuttama kasvava terveysrasitus (Cassini ym., 2019) herätti uudelleen maailmanlaajuista kiinnostusta faagihoitoa kohtaan, joka on käyttökelpoinen lisäväline bakteeri-infektioiden kliinisessä hoidossa (Thiel, 2004). Kaikkialle maailmaan ollaan perustamassa faagiterapiakeskuksia Eliava-instituutin ja Hirszfeld-instituutin faagiterapiayksikön jalanjäljissä Wrocławissa Puolassa (Miêdzybrodzki ym, 2012).
Vuosi 2035
Eteenpäin tulevaisuuden maapalloon vuonna 2035, synkkään maailmaan, jolle on ominaista ihmisten ylikansoittuminen, suuret ekosysteemihäiriöt, ilmaston lämpeneminen ja muukalaisviha.
Kylvyssä kylpevän tohtori John Iverian, eläkkeelle jäänyt mikrobiologi, tunsi yhtäkkiä erittäin kivuliaan pistoksen niskassaan, jota seurasi ääni, joka muistutti pienikokoisen lentokoneen potkurin ääntä. Hän seuloi ympäristöä ja näki silmäkulmassaan oudon suuren hyönteisen, jolla oli pitkät karmivat jalat ja antennit ja joka istui seinällä hänen design-kylpyammeensa vieressä. Osuri, Iverianin Antwerpenin keskustassa sijaitsevan loftin kodinhallintajärjestelmä, tunnisti hyönteisen ruskeaksi marmoroituneeksi haisukärpäseksi Halyomorpha halys, joka oli levinnyt ympäri maailmaa. Osurin raportissa, joka heijastettiin yhdelle kylpyhuoneen videoruuduista, mainittiin, että ihmiset, joita purtiin, kokivat aluksi pientä punaista haavaumaa purema-alueella ihollaan. Kun puremahaava jätettiin hoitamatta, se turposi ja tuotti märkää. Väsynyt ja muikea, ei-ihminen Iverian astui ulos kylvystä ja meni nukkumaan. Hän oli päättänyt olla suorittamatta monimutkaista haavanhoitotoimenpidettä, jota Osuri oli vahvasti neuvonut. Varhain seuraavana aamuna purema oli kuitenkin muuttunut nekroottiseksi haavaksi, jossa oli selviä merkkejä infektiosta.
Vanhoillisesti Iverian aktivoi Phage-BEAM-laitteensa. BEAM oli lyhenne sanoista “Bedside Energized Anti-Microbial”. Laite oli kooltaan ja muodoltaan kenkälaatikon kokoinen, mutta tyylikkäämmän ja kiillotetumman näköinen. Laitteen nimi ja valmistaja oli suunniteltu värikkäin kirjaimin saumattomasti valkoiseksi emaloidun laatikon kylkeen. Iverian otti pyyhkeen steriilistä pakkauksestaan ja kuljetti sitä varovasti koko haava-alueen yli varmistaen, että haavaerite kostutti pyyhkeen vanupuikon kärjen perusteellisesti. Kun pyyhkäisypuikko lähestyi laatikon “insert sample” -aluetta, pieni ovi avautui kuin taikaiskusta ja vapautti 10 tuuman korkuisen hologrammin, jossa oli Marcia-niminen laboratorioteknikko. Hän näytti Iverianille, mihin näyte laitetaan. Marcia oli kehitetty opastamaan asiakkaita testimenettelyn läpi. “Parhaan tuloksen saamiseksi asettakaa uusi faagibiomustepatruuna, tohtori Iverian”, Marcia sanoi. Aivan kuten eilisten 2D-tulostimien kohdalla, biovärikasettien hinta oli lähes yhtä korkea kuin itse Phage-BEAM-laitteen hinta. Business Insiderin mukaan faagibiomuste oli maailman toiseksi kallein neste Chanel No. 8:n jälkeen. Onneksi Iverian oli yhtenä keksijöistä saanut oikeuden saada aina käyttöönsä laitteen uusimman version, johon kuului myös jatkuva reagenssien toimitus, ilmaiseksi.
Iverian tiesi täydellisesti, miten laite toimi, joten hän ei tarvinnut Marcian apua. Ensin pyyhkäisyn kärjestä uutettiin DNA ja määritettiin metagenomi – kaikki näytteessä esiintyvä geneettinen materiaali, mukaan lukien infektoivat bakteerit. Seuraavaksi nämä geneettiset tiedot lähetettiin suojattuun “Phage XChange” -palvelimeen, jossa monimutkainen tekoälyyn perustuva algoritmi ennusti sellaisen faagin genomisekvenssin, joka todennäköisimmin lyysoi metagenomissa tunnistetut infektoivat bakteerit ja jonka oli tarkoitus saada aikaan heikoin immuunireaktio potilaassa. Faagin genomitiedot lähetettiin Phage-BEAM-laitteeseen, joka syntetisoi ensin faagin genomin ja sitten faagin käyttämällä omaa bakteerivapaata faagituotantojärjestelmää.
Laite tuotti yhden tunnin kuluessa näytteenotosta käyttövalmiin terapeuttisen faagituotteen. Vaiheittaisen menettelyn tulokset välitettäisiin Iverianin olohuoneen valtavaan kotivideonäyttöön. Istuen LC2-tuolissaan ja kuunnellen Mozartin Suurta messua c-molli, Iverian odotti jännittyneenä tulosten saapumista. Hänellä oli huono tunne tästä. Tulos ravisteli Iverianin selkärankaa pitkin. Bakteeripatogeeni tunnistettu: Streptococcus pyogenes -kanta FE-2033! Osuri aktivoi välittömästi infektiohälytysprotokollan, lähetti viestin Maailman tautienvalvontakeskukseen ja ennusti huolestuttavia taustatietoja tappavasta lihaa syövästä bakteerikannasta, jota pidettiin välittömänä uhkana kansanterveydelle vuodesta 2033 lähtien. Iverian harkitsi hetken aikaa tartunnan saaneen haavan ja ympäröivän terveen kudoksen poistamista keittiöveitsellä, mutta hän rauhoittui ja päätti odottaa ja soveltaa välitöntä Phage-BEAM-tuotetta. Tunnin kuluttua Phage-BEAM-laite oli tuottanut synteettisiä faageja. Nämä faagit sekoitettiin sitten eristettyihin bakteereihin validointimoduulissa niiden in vitro -tehokkuuden testaamiseksi. Viisitoista minuuttia myöhemmin Iverian sai vihreää valoa hoidon aloittamiselle. Iverian levitti faagit hitaasti vapautuvaan hydrogeelipohjaiseen haavasidokseen, joka oli ensin sekoitettu Phage-BEAM-laitteen tuottamaan konsentroituun faagisuspensioon ja joka sisälsi myös synergistisiä antibiootteja. Hydrogeeli lievitti väliaikaisesti kipua, mikä rauhoitti häntä entisestään. Iverian toisti faagilla ja antibiootilla täytetyn hydrogeelin levittämisen kerran päivässä. Haavatulehdus parani 24 tunnin kuluessa, ja 7 päivän kuluttua haava oli lähes täysin parantunut. Iverianin mahdollisesti hengenvaarallinen infektio hoidettiin onnistuneesti, oikea-aikaisesti ja poistumatta hänen kotoaan. Moniin aiempiin vuosikymmeniin ei kuitenkaan ollut varmaa, että faagihoidosta tulisi laajasti sovellettava ja kliinisesti hyödyllinen antibakteerinen väline. Lääketieteessä oli kestänyt jonkin aikaa tajuta, että faagihoidon ei tarvinnut olla identtinen antibioottihoidon kanssa, ja tämä johtui pääasiassa vaikuttavien aineiden, faagien, erityispiirteistä.
Joitakin asiaan liittyviä faagien erityispiirteitä
Faageilla on useita ominaisuuksia, jotka poikkeavat antibiooteista ja jotka ovat haitanneet niiden kehittämistä lääkevalmisteiksi ja niiden soveltamista hoidossa. Ensinnäkin ne ovat yleensä spesifisiä sen suhteen, mitkä bakteerit ne infektoivat. Parhaimmillaan ne kohdistuvat huomattavaan osaan yhtä bakteerilajia, mutta pahimmillaan ne infektoivat vain pienen määrän kantoja yhden lajin sisällä. Terapeuttiset faagit voidaan siten valita siten, että ne tappavat pääasiassa yhden bakteerilajin tai sen kliinisesti merkityksellisen alaryhmän ja säästävät potilaan hyödylliset bakteerit (esim. suolisto, iho tai suun lähifloora). Useimmilla rutiininomaisesti käytetyillä antibiooteilla on sitä vastoin laaja aktiivisuusspektri, mikä voi aiheuttaa “liitännäisvahinkoja” potilaan mikrobiomille, mikä puolestaan voi johtaa haitallisiin vaikutuksiin, kuten antibiooteille resistenttien bakteerilajien (esim. Clostridium difficile) valikoitumiseen tai antibiootteihin liittyvään ripuliin (Jernberg ym., 2010). Faagispesifisyyden haittapuolena on se, että infektoivat bakteerit on tunnistettava ennen faagihoidon aloittamista. Sen sijaan empiirisessä antibioottihoidossa käytetään yleensä laajakirjoisia antibioottikoktaileja, jotka vaikuttavat moniin grampositiivisiin ja gramnegatiivisiin bakteereihin sekä erilaisiin sieniin. Kun tiedetään enemmän tietoa (esim. bakteeriviljelystä), hoito voi koostua kapeakirjoisista antibiooteista, jotka kohdistuvat spesifisemmin tautia aiheuttaviksi tunnistettuihin bakteereihin tai sieniin.
Toiseksi bakteerit ja faagit ovat mukana isäntä-parasiittisuhteessa. Tiukasti lytiset faagit ovat kaikkialla ympäristössä, ja ne vaativat bakteeri-isäntänsä kuoleman saadakseen elinkaarensa päätökseen. Ilman isäntää faageja ei voi olla olemassa. Faagit valikoivat vastustuskykyisiä isäntiä, jotka puolestaan valikoivat tehokkaita faageja. Tämä johtaa niin sanottuun “antagonistiseen yhteisevoluutioon”, bakteerien ja faagien väliseen asevarustelukilpailuun, jolle on ominaista bakteerien vastustuskyvyn ja faagien infektiivisyyden vastavuoroinen kehittyminen (Buckling ja Rainey, 2002). Aivan kuten useimmille mikrobilääkkeille, bakteerit tulevat näin ollen vastustuskykyisiksi myös faageille (Luria ja Delbrück, 1943; Schooley ym., 2017), mutta toisin kuin staattisilla antibiooteilla, faageilla on kyky voittaa bakteerien vastustuskyky (Buckling ja Rainey, 2002). On kuitenkin viitteitä siitä, että bakteerit ja faagit eivät loputtomasti lisää keskinäistä vastustuskykyään ja infektiivisyyttään (Fortuna ym., 2019).
Faagiterapian lähestymistavat
Faagiterapian herätessä uudelleen henkiin 2000-luvun alussa oli kehitetty kaksi erilaista faagiterapian lähestymistapaa (Pirnay ym., 2011). Niin sanotussa yhden koon lähestymistavassa käytettiin määriteltyjä laajakirjoisia faagikoktaileja, joiden oletettiin kohdistuvan useimpiin bakteereihin, joiden epäiltiin aiheuttavan tiettyjä tartuntatauteja. Nämä ennalta määritellyt laajavaikutteiset faagikoktailit kehitettiin, tuotettiin ja testattiin nykyisissä farmakologis-taloudellisissa malleissa, jotka oli suunniteltu “staattisia” lääkkeitä, kuten antibiootteja, varten. Todella laajavaikutteisten faagikoktailien, jotka tehoavat useimpiin tartuntataudeissa yleisesti esiintyviin grampositiivisiin ja/tai gramnegatiivisiin bakteereihin, oli kuitenkin sisällettävä suuria määriä faageja, ja niiden kehittäminen osoittautui hyvin vaikeaksi. Oli mahdollista kehittää kapea-alaisempia, yhtä tai muutamaa bakteerilajia vastaan aktiivisia faagikoktaileja, joita voitiin käyttää tietyissä käyttöaiheissa ja joiden infektoivat bakteerilajit oli tunnettava etukäteen. Joillekin bakteerilajeille, kuten Staphylococcus aureus -bakteerille, oli eristetty ja karakterisoitu faageja, joilla oli poikkeuksellisen laaja isäntäalue (Vandersteegen ym., 2011). Satunnaistetussa kontrolloidussa PhagoBurn-tutkimuksessa onnistuminen Pseudomonas aeruginosa -taudinaiheuttajien pysyvän vähenemisen saavuttamisessa palovammahaavoissa oli yhteydessä alkuperäiseen herkkyyteen faagikoktailille (Jault ym., 2019). Kolmasosalla mukana olleista potilaista osoitettiin kuitenkin olevan jo olemassa olevia P. aeruginosa -kantoja, jotka olivat resistenttejä faagikoktailille, joka koostui peräti 12:sta lytisestä P. aeruginosa -faagista. Lisäksi alun perin tehokkaiksi suunniteltuja faagikoktaileja oli päivitettävä säännöllisesti (esim. täydennettävä uusilla faageilla) vastauksena faagiresistenssin ilmaantumiseen tai uusien kliinisesti merkityksellisten kantojen esiintymiseen. Lisäksi ei tiedetty, aiheuttaisiko bakteerien kohtaaminen suurilla pitoisuuksilla kiinteitä faagikoktaileja bakteerien faagiresistenssin syntymisen, leviämisen ja pysyvyyden sairaaloissa ja ympäristössä samaan tapaan kuin antibioottien laajamittaisen käytön yhteydessä oli tapahtunut.
Henkilökohtaisissa faagihoitokonsepteissa yksi tai useampi faagi valittiin faagipankista tai ympäristöstä ja mahdollisesti mukautettiin (in vitro -valinta faagimutaatioiden, joilla oli lisääntynyt infektiivisyys, valinta) infektoimaan tehokkaammin potilaan infektiokohdasta eristettyjä bakteereja (Friman et al.,, 2016). Jotkin faagiterapiakeskukset perustivat ja ylläpitivät suuria terapeuttisia faagipankkeja, joita päivitettiin säännöllisesti uusilla faageilla, jolloin pankin isäntävalikoimaa laajennettiin ja mukautettiin jatkuvasti muuttuviin bakteeripopulaatioihin. Yksilölliset faagihoitomenetelmät olivat potentiaalisesti kestävämpiä, koska vain infektoiva bakteeri on kohteena, jolloin valintapaine bakteerien faagiresistenssiä kohtaan on vähäisempi. Ne olivat kuitenkin myös monimutkaisempia ja logistisesti monimutkaisempia kuin yhden koon lähestymistavat, sillä bakteerikantoja ja niihin sopivia faageja lähetettiin ympäri maailmaa (kuva 1). Lisäksi täsmälääketieteen konseptit eivät yleensä olleet yhteensopivia useimpien lääkevalmisteiden (Yhdysvalloissa lääkkeiden) kehitys- ja lisensointipolkujen kanssa, joiden läpivieminen vaati useita vuosia ja miljoonia euroja (dollareita), ja vieläpä jokaista pankissa olevaa faagia varten (Verbeken ym., 2012).
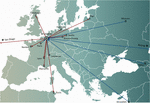
Kuva 1. Faagien kansainväliset siirrot (punaiset nuolet) Brysselin Queen Astrid Military Hospital (QAMH) -sairaalasta (punaiset nuolet) ja siniset nuolet (siniset nuolet) kliinisiä sovelluksia silmällä pitäen vuosina 2015-2020. Kansallisella tasolla faageja lähetettiin QAMH:sta viiteen yliopistosairaalaan (ei kuvassa). Lisäksi sopivien faagien valintaan sisältyi usein potilaiden bakteeri-isolaattien siirto, ja viisi kansainvälistä potilasta (kaksi Ranskasta, kaksi Alankomaista ja yksi Tunisiasta) siirrettiin Brysseliin faagihoitoa varten.
Synteettinen biologia
Kolmannen vuosituhannen alussa synteettisen biologian lähestymistapoja oli kehitetty yhä enemmän faagien spesifisyyden vähentämiseksi ja bakteerien faagiresistenssin synnyttämiseksi (esim, rakenneohjattu suunnittelu) (Pires et al., 2016; Dunne et al., 2019). Esimerkiksi hiivapohjaisia alustoja faagien häntäkuituproteiinien vaihtamiseksi kehitettiin hybridifaagien suunnittelemiseksi, joilla on ennustettavampi ja laajempi isäntäalue (Ando et al., 2015; Yosef et al., 2017), ja geenitekniikan strategioita (esim, CRISPR-Cas-editointityökaluja) kehitettiin muiden näkökohtien, kuten potilaan ja faagin negatiivisten vuorovaikutusten (esim. faagin vastainen immuunivaste) (Brown ym., 2017), bakteerien faagiresistenssimekanismien mahdollisen ilmaantumisen ja leviämisen sekä haitallisten bakteerisisältöjen, kuten endotoksiinien, vapautumisen käsittelemiseksi (Hwang ym., 2018). Synteettiset faagigenomit oli käynnistettävä uudelleen faagin jälkeläisten tuottamiseksi (Barbu et al., 2016; Pires et al., 2016), transformoimalla Escherichia coli- tai Listeria monocytogenes L-muotoja (Kilcher et al., 2018) tai käyttämällä soluvapaita transkriptio-translaatio-järjestelmiä (TXTL) (Rustad et al., 2018). Länsimaiset sääntelykehykset olivat vähitellen alkaneet ottaa huomioon tarkkuus- ja yksilölliset faagihoitomenetelmät, joissa käytettiin luonnossa esiintyviä faageja (Pirnay ym., 2018), muokattuja faageja (Dedrick ym., 2019) ja synteettisiä faageja.
Faagien tilapäisten ja paikan päällä tapahtuvien terapeuttisten faagien tuotantolaitteiden, kuten Phage-BEAMin, kehittäminen ei sujunut kitkattomasti, Iverian muistutti. Aluksi tarvittiin tekoälyyn (AI) perustuvaa in silico -faagien yhteensovittamista ja suunnittelua. Syväoppiminen (Martorell-Marugán et al., 2019), koneoppimisen osajoukko, valittiin bakteerien genomien ja infektoivien faagien genomien välisten yhteyksien etsimiseen, koska se oli helpompi skaalata suuremmille näytemäärille. Syväoppimismenetelmät eivät esimerkiksi vaatineet niin sanottua ominaisuuksien louhintaa, joka edellyttäisi faagien ja bakteerien genomien geeni-/proteiinitason annotointia ja rajoittaisi ennusteet tiettyihin tunnettuihin bakteerien ja faagien ominaisuuksien välisiin suhteisiin, kuten faagien häntäkuiturakenteiden sitoutuminen tiettyihin bakteerien soluseinän reseptoreihin. Huonona puolena oli se, että siihen tarvittiin jatkuvasti valtavat tietomäärät, jotka yhdistävät lytisten faagien genomit isäntäbakteerien genomeihin, ja tässä kohtaa kenkä puristi. Koko genomin sekvensointi oli hiljalleen tihentynyt kliinisen mikrobiologian käytäntöön (American Academy of Microbiology, 2016), mutta tutkimuslaitokset ja lääkeyritykset eivät olleet halukkaita toimittamaan tietojaan yhteen keskitettyyn tietokantaan, eikä sijoittajia löytynyt, jotka olisivat halukkaita ja kykeneviä hankkimaan saatavilla olevia tietoja ja/tai tuottamaan riittäviä määriä uutta tietoa. Toinen este, joka oli voitettava, oli suurten DNA-molekyylien nopean, luotettavan ja kohtuuhintaisen synteesin saamattomuus. Alkuperäiset DNA-synteesitekniikat perustuivat orgaaniseen kemiaan ja tuottivat suhteellisen pieniä DNA-molekyylejä. Faagien genomien de novo -synteesi edellytti useiden genomifragmenttien kokoamista (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) hiivassa Saccharomyces cerevisiae, käyttämällä hiivan keinotekoisia kromosomeja (Ando et al., 2015) tai kemiallista kokoamista (Gibson et al., 2009). Uuden DNA:n syntetisointitekniikan kehittäminen, joka perustuu immuunijärjestelmän soluista löytyviin DNA:ta syntetisoiviin entsyymeihin (Palluk ym., 2018), helpotti faagien genomisynteesiä. Lopuksi oli voitettava joitakin esteitä, jotta voitiin kehittää geneerisiä soluttomia faagituotantojärjestelmiä, jotka kykenivät tuottamaan faageja korkeissa tittereissä ja osoittamaan samaa bakteeri-infektiivisyyttä kuin niiden luonnolliset analogit.
A läpimurto
Suurimpana ongelmana oli se, että osoittautui hyvin vaikeaksi kerätä massiivisia määriä toisiinsa linkittyneitä faagien ja bakteerien genomisekvenssejä, joita syväoppimisella toimivien tekoälyalgoritmeja varten tarvittiin, jotta ne pystyivät ennustamaan ja/tai suunnittelemaan faagien genomisekvenssejä terapeuttisella tavalla hyväksyttävällä tarkkuudella. Iverian muisteli, että todellinen läpimurto tapahtui, kun voittoa tavoittelematon järjestö “Phage XChange” käynnisti samannimisen maailmanlaajuisen faagien hallinta-alustan luodakseen tehokkaan, standardoidun, kestävän ja eettisen faagien toimitusketjun (kuva 2). Phage XChange koostui pääasiassa tekoälymoduulista ja Distributed Ledgeristä (DL) (Thiebes et al., 2020). Alustan tekoälymoduuli analysoi linkitettyjä faagien ja bakteerien genomeja ennustaakseen ja suunnitellakseen tehokkaita faageja asiakkaille. Se myös ennusti, mitkä bakteeripatogeenit tarvitsivat kiireellisintä huomiota esineiden internetin (IoT) ja Big Datan sekä kansainvälisten kansanterveysjärjestöjen, kuten Maailman terveysjärjestön (WHO) ja kansallisten tautienvalvontakeskusten, toimittamien tietojen perusteella. Nämä tiedot ohjasivat järjestelmää kohti kiireellisimmin tarvittavien faagien eristämistä ja karakterisointia.
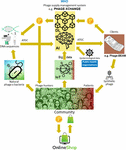
Kuva 2. Visio siitä, miten faagien toimitusketju voisi olla järjestetty vuonna 2035. AI, tekoäly; ATGC, DNA-sekvenssi; BEAM, bedside energized anti-microbial; DL, hajautettu pääkirja; IoT, esineiden internet; P, PhageCoin; WHO, Maailman terveysjärjestö.
Alustan DL-moduuli varmisti riittävän, laadullisen ja kirjatun linkitettyjen faagien/bakteerien genomisekvenssien syötön tekoälymoduuliin ja ditto faagisekvenssien toimittamisen asiakkaille Nagoyan pöytäkirjan määräysten mukaisesti (Expert round table on acceptance and re-implementation of bacteriophage therapy ym, 2018). DL kirjasi muuttumattomasti kaikki sidosryhmät (esim. tietojen toimittajat, sekvensointipalvelut ja asiakkaat), transaktiot ja sopimustiedot. Se kirjasi myös toimitetun materiaalin tarkan laadun, eritelmät ja painon. Algoritmi määritteli redundanssin puuttumisen ja arvioi toimitetun materiaalin painon (esim. faagien virulenssi ja isäntäalue) ja haluttavuuden. Uusiin bakteeripatogeeneihin kohdistuvat faagit olivat luonnollisesti halutuimpia. Useimmat patenttikysymykset vältettiin. DL toimi maksukirjanpitäjänä varmistaakseen, että kaikille osapuolille maksettiin ajoissa ja oikeudenmukaisesti. Toimittajille annettiin useita PhageCoineja (alustan kryptovaluutta) suhteessa toimitetun materiaalin laatuun, painoon ja haluttavuuteen. Asiakkaat, jotka poimivat ennustustuloksia (faagisekvenssejä) DL:n kautta, maksoivat PhageCoineja määrän, joka oli suhteessa faagien arvioituun arvoon. Näitä PhageCoins-kolikoita käytettiin DL:n ylläpitämiseen, riittävän ja jatkuvan materiaalivirran varmistamiseen sekä faagien virulenssi- ja isäntäaluetietojen laajentamiseen (faagien ja bakteerien yhteensovittaminen). Lisävaroja ja kannustimia materiaalin toimittamiseen saatiin kaikenlaisten tavaroiden tuottajilta ja toimittajilta. Välittömästi ansaituilla PhageCoins-kolikoilla faagien toimittajat pystyivät ostamaan verkosta kaikenlaisia tuotteita voimakkaasti alennettuun hintaan laboratorio- ja kouluvälineistä urheiluvälineisiin. Nämä tavarat saatiin yritysten sponsoroinnin kautta. Useat vakiintuneet yritykset sponsoroivat PhageXchangea vastineeksi veronalennuksista, julkisuudesta ja sosiaalisesti vastuullisen tuotemerkin imagosta. Toimitetun materiaalin paino ja siten myös sen arvo oli aluksi aliarvostettu, mutta se arvioitiin uudelleen säännöllisin väliajoin (iteraatio), ja toimittajille annettiin lisää PhageCoineja, kun se oli perusteltua. Vaikka alusta oli hyödyllinen heti käyttöönotostaan lähtien, siitä tuli todella menestyksekäs vasta, kun se asetettiin WHO:n suojelukseen, mikä vastaa ihmisperäisten lääkkeiden maailmanlaajuista jäljitettävyys-, läpinäkyvyys-, valppaus- ja valvontajärjestelmää (Warwick et al., 2013). Phage XChangen ja WHO:n välinen virallinen sopimus lisäsi kansainvälistä luottamusta alustan pitkän aikavälin kestävyyteen ja suojeluun epäeettiseltä kaupalliselta hyödyntämiseltä. Tehokkaiden terapeuttisten faagien etsinnästä tuli pian yhteisöllinen ponnistus, jonka tavoitteena on ratkaista antibioottiresistenssikriisi, ja itsenäiset “faaginmetsästäjät”, koulut, partioryhmät, Amazon-joen rannoilla sijaitsevat kylät jne. eristävät ja toimittavat faageja Phage XChangeen PhageCoinsia vastaan. Tämän marginaalissa eri yritykset ja laitokset kehittivät oheislaitteita ja -palveluita, kuten faagien eristyssarjoja sekä sekvensointi- ja faagisynteesialustoja (esim. Phage-BEAM-laite). Näitä laitteita ennakoiden tarjottiin väliratkaisuja, joissa itse faagit saatiin DL:n kautta.
Epilog
Tämä näkemys faagihoidon tulevaisuudesta tarjoaa optimistisen lopun antibioottiresistenssikriisiin. Synteettisten faagien tilapäinen ja paikan päällä tapahtuva tuotanto, joka on liitetty maailmanlaajuiseen, yhteisöpohjaiseen faagien hallintajärjestelmään, osoittautui tervetulleeksi ja edulliseksi (sosiaaliturvajärjestelmien kannalta) lisäaseeksi taistelussa antibiooteille resistenttejä bakteeri-infektioita vastaan. Se ei kuitenkaan ollut mikään taikaluoti, vaan synergistinen lisä vakiintuneille mikrobilääkkeille. Synteettisten faagien välittömällä ja soluvapaalla tuotannolla, olivatpa ne sitten suunniteltuja tai ei, oli huomattavia etuja verrattuna klassisesti (bakteeri-isännissä) tuotettuihin luonnollisiin faageihin:
(i) Fyysisiä terapeuttisia faagipankkeja ei tarvinnut ylläpitää eikä potilaan bakteeri-isolaatteja ja niihin sopivia terapeuttisia faageja tarvinnut lähettää eri puolille maailmaa.
(ii) Synteettiset faagit merkittäviä kansanterveysuhkia aiheuttavia bakteereja vastaan, kuten vuonna 2011 Saksassa puhjennut E. coli O104:H4-epidemia (Merabishvili ym, 2012), tai bakteereja, joita (epäillään käytettävän) bioterrorismiin (Joñczyk-Matysiak et al., 2014) voitaisiin tuottaa ajoissa paikan päällä.
(iii) Mahdollisesti tappavia tauteja aiheuttavia bakteereja vastaan suunnatut faagit, joille ei ole saatavilla ei-tappavia tuotanto-isäntäkantoja ja joiden levittäminen vaati aiemmin bioturvallisuustaso 3:n (bsl-3) biosäilytystoimia, voitaisiin syntetisoida bsl-1-olosuhteissa.
(iv) Kun näytteenottopaikoista ei voitu eristää faageja esimerkiksi siksi, että eristystekniikoissa käytetyt bakteeri-isäntäkannat eivät olleet alttiita halutuille faageille, metagenomitiedoista poimittuja (ennustettuja) faagien genomisekvenssejä (Reyes ym, 2010; Amgarten ym., 2018), voitiin käyttää synteettisten faagien tuottamiseen.
(v) Synteettiset faagivalmisteet eivät sisältäneet lainkaan (tai pienempiä määriä) molekyylejä, joilla voisi olla kielteisiä vaikutuksia potilaisiin (esim. endotoksiinit).
(vi) Laitteita mukautettiin synteettisten faagien tuottamiseen pidennetyn avaruusmatkailun ja avaruuskolonisaation aikana (Taylor ja Sommer, 2005).
Ei ole paljonkaan todennäköisyyttä sille, että nämä ennusteet toteutuvat. On luultavasti liian lyhytnäköistä ajatella, että yhteisöllinen toiminta, jota kansanterveysjärjestöt tukevat ja jota hallinnoi maailmanlaajuinen, kestävä ja eettinen foorumi, voisi olla nykyisen maailmanlaajuisen antibioottiresistenssikriisin ratkaisun ytimessä. Joillakin ehdotetun järjestelmän osilla, kuten synteettisten faagien soluvapaalla tuotannolla vuodeosastolaitteella, on kohtuulliset mahdollisuudet toteutua, kun taas toiset osat, kuten yritysten sponsorointi, jäävät todennäköisesti tieteiskirjallisuuden piiriin. Voitte sanoa, että olen uneksija, joten herättäkää minut vapaasti vuonna 2035 kohtaamaan todellisuus!
Tekijöiden panos
J-PP ideoi vision ja laati käsikirjoituksen.
Rahoitus
Julkaisukustannukset kattoi “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst”.
Esintressiristiriita
Tekijä vakuuttaa, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Käsittelevä päätoimittaja ilmoitti aiemmasta yhteistoiminnasta kirjoittajan kanssa.
Kiitokset
Persoonallinen näkemys tai unelma, joka kehitettiin tässä käsikirjoituksessa, syntyi vuorovaikutuksessa monien tutkijakollegoiden kanssa viimeisten 15 vuoden aikana. On mahdotonta nimetä heitä kaikkia, mutta ei olisi reilua ottaa kaikkia kunnianosoituksia yksin. Siksi päätin mainita tässä joitakin heistä (aakkosjärjestyksessä), vaikka riskinä – tai paremminkin varmuutena – on, että unohdan joitakin tärkeitä vaikuttajia: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Téa Glonti, Nino Grdzelishvili,
American Academy of Microbiology (2016). Kliinisten mikrobien seuraavan sukupolven sekvensoinnin sovellukset: Report on an American Academy of Microbiology Colloquium Held in Washington, DC, in April 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P., da Silva, A. M., and Setubal, J. C. (2018). MARVEL, työkalu bakteriofagisekvenssien ennustamiseen metagenomissa. Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., ja Loessner, M. J. (2018). Räätälöityjen, synteettisten bakteriofagien genomien sukujenvälinen uudelleenkäynnistys L-muotoisissa bakteereissa. Proc. Natl. Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., and Lu, T. K. (2018). Fage-pohjaiset sovellukset synteettisessä biologiassa. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., ja Delbrück, M. (1943). Bakteerien mutaatiot virusherkkyydestä virusresistenssiin. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine,” in Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019..ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). Sellaisen terapeuttisen bakteriofagikandidaatin valinta ja karakterisointi, joka lysoi Saksassa vuonna 2011 puhjenneen Escherichia coli O104:H4 -kannan. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Faagihoidon kliiniset näkökohdat. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., ym. et al. (2018). De novo DNA-synteesi polymeraasi-nukleotidikonjugaattien avulla. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., and Lu, T. K. (2016). Geneettisesti muunnetut faagit: katsaus viime vuosikymmenen edistysaskeliin. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). Faagihoidon paradigma: prêt-à-porter vai sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). Magistraalinen faagi. Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Virukset monotsygoottisten kaksosten ja heidän äitiensä ulostemikrobistossa. Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P., and Noireaux, V. (2018). Tarttuvan bakteriofagi T4:n soluvapaa TXTL-synteesi yhdessä koeputkireaktiossa. Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Henkilökohtaisten bakteriofagipohjaisten terapeuttisten cocktailien kehittäminen ja käyttö sellaisen potilaan hoitoon, jolla oli levinnyt resistentti Acinetobacter baumannii -infektio. Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z., and Morris, J. G. Jr. (2001). Bakteriofagihoito. Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Virukset: maapallon suurimman biologisen monimuotoisuuden avaaminen. Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., and Sommer, A. P. (2005). Kohti bakteeri-infektioiden järkevää hoitoa pitkien avaruusmatkojen aikana. Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B., ja Sunyaev, A. (2020). Distributed ledger technology in genomics: a call for Europe. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). Vanha dogma, uudet temput – 2000-luvun faagiterapia. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Mikrobiologinen ja molekulaarinen arviointi bakteriofagi ISP:stä Staphylococcus aureuksen torjunnassa. PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J. P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Eurooppalaisen sääntelykehyksen optimointi kestävää bakteriofagihoitoa varten ihmislääketieteessä. Arch. Immunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L., and Wang, H. (2013). Globaalisti yhdenmukaiset koodausjärjestelmät ihmisperäisille lääkkeille. Bull. World Health Organ. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., ja Qimron, U. (2017). Bakteriofagihiukkasten isäntäalueen laajentaminen DNA-siirtoa varten. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar