Prefacio
Este artículo ofrece una visión personal de lo que podría ser necesario para que la terapia de fagos se abra paso finalmente como una herramienta antibacteriana principal. Está influenciado por los fracasos e incertidumbres históricas y recientes en el campo de la terapia con fagos y pretende encontrar soluciones basadas en tecnologías futuras y emergentes que se supone que modelarán la ciencia y la sociedad del mañana.
Terapia con fagos
Los bacteriófagos (fagos) son los virus de las bacterias. Desde tiempos inmemoriales han controlado el crecimiento y la propagación de sus huéspedes bacterianos. Los virus bacterianos son las entidades vitales más ubicuas de nuestra biosfera. Se calcula que hay 10 millones de veces más virus en los océanos que estrellas en el universo, y si todos los fagos de la Tierra se apilaran unos sobre otros, esta torre se extendería más allá de las 60 galaxias más cercanas (Suttle, 2013). Pueden encontrarse fácilmente allí donde prosperan las bacterias: en las alcantarillas, los ríos o la orina y las heces de los pacientes. Los fagos de los patógenos bacterianos humanos suelen estar compuestos por una cabeza icosaédrica, una esfera con 20 caras planas formada por proteínas y que contiene un genoma de ácido nucleico, al que se une una cola proteica. Cuando un fago estrictamente lítico se adhiere con sus fibras y púas de la cola a la superficie de su bacteria objetivo, la vaina de la cola en forma de jeringa se contrae y el núcleo de la cola es conducido a través de la pared celular bacteriana, inyectando el genoma del fago en el periplasma de la célula bacteriana. Inmediatamente, la maquinaria bacteriana de síntesis de ADN y proteínas es secuestrada para construir copias del fago. Algunos fagos cortan el ADN bacteriano en trozos. Tras un periodo de latencia de minutos a horas, los fagos recién formados se desprenden de sus huéspedes bacterianos, que mueren en el proceso. La progenie de los fagos, que pueden ser cientos por bacteria, sale entonces a buscar nuevas bacterias huéspedes a las que infectar. Por tanto, los fagos pueden considerarse antimicrobianos autorreplicantes. Es importante destacar que los fagos han evolucionado para infectar únicamente a ciertas bacterias objetivo y son inofensivos para las células de los mamíferos.
Las primeras pruebas de la existencia de agentes similares a los virus con actividad antibacteriana fueron comunicadas por el bacteriólogo inglés Frederick Twort y por el microbiólogo franco-canadiense Felix d’Hérelle en 1915 y 1917, respectivamente (Sulakvelidze et al., 2001). En 1919, d’Hérelle explotó por primera vez el potencial terapéutico de los fagos cuando los utilizó para curar a un niño enfermo de disentería en París. La terapia con fagos fue reconocida inmediatamente como un enfoque terapéutico para tratar las infecciones bacterianas y varias empresas, como L’Oréal en Europa y Eli Lilly Company en Estados Unidos, se encargaron de comercializar los preparados de terapia con fagos (Sulakvelidze et al., 2001). En 1923, el microbiólogo georgiano Giorgi Eliava fundó el Instituto Eliava en Tbilisi, Georgia, dedicado a la investigación de la terapia con fagos. Fue el inicio de una amplia investigación y desarrollo de la fagoterapia en la antigua Unión Soviética. Sin embargo, los primeros usos de la fagoterapia eran a menudo poco fiables y la investigación sobre los antibióticos también estaba en marcha. El éxito del uso de la penicilina durante la Segunda Guerra Mundial y su posterior comercialización en todo el mundo hizo que los científicos occidentales perdieran el interés por la fagoterapia. Los investigadores soviéticos, en cambio, siguieron desarrollando la terapia con fagos y publicando sus resultados, pero debido al Telón de Acero sus conocimientos y experiencia no se extendieron por todo el mundo (Sulakvelidze et al., 2001). En los albores del tercer milenio, la creciente carga sanitaria de las infecciones por bacterias resistentes a los antibióticos (Cassini et al., 2019) incitó un renovado interés mundial por la terapia de fagos como herramienta adicional viable para el tratamiento clínico de las infecciones bacterianas (Thiel, 2004). En todo el mundo se están creando centros de terapia de fagos, siguiendo los pasos del Instituto Eliava y la unidad de terapia de fagos del Instituto Hirszfeld en Wrocław, Polonia (Miêdzybrodzki et al, 2012).
El año 2035
Adelante, la Tierra futura de 2035, un mundo sombrío caracterizado por la superpoblación humana, las grandes alteraciones de los ecosistemas, el calentamiento global y la xenofobia.
Mientras se remojaba en su bañera, el doctor John Iverian, un microbiólogo jubilado, sintió de repente un pinchazo extremadamente doloroso en la nuca, seguido de un sonido como el de la hélice de un avión pequeño. Examinó el entorno y con el rabillo del ojo vio un extraño y gran insecto con largas y espeluznantes patas y antenas sentado en la pared junto a su bañera de diseño. Osuri, el sistema de gestión del hogar del loft de Iverian en el centro de Amberes, identificó el insecto como la chinche apestosa marrón Halyomorpha halys, que se había extendido por todo el mundo. El informe de Osuri, proyectado en una de las pantallas de vídeo del cuarto de baño, mencionaba que las personas picadas experimentaban inicialmente una pequeña llaga roja en la zona de la picadura. Cuando se dejaba sin atender, la herida de la mordedura se hinchaba y producía pus. Cansado y confuso, Iverian salió de su baño y se fue a la cama. Había decidido no realizar el elaborado procedimiento de tratamiento de la herida, que le había aconsejado encarecidamente Osuri. Sin embargo, a primera hora de la mañana siguiente, la mordedura se había convertido en una herida necrótica que mostraba claros signos de infección.
Ansiosamente, Iverian activó su dispositivo Phage-BEAM. BEAM significaba “Bedside Energized Anti-Microbial”. El dispositivo tenía el tamaño y la forma de una caja de zapatos, pero con un aspecto más elegante y pulido. El nombre del dispositivo y su fabricante estaban diseñados en letras de colores en el lateral de la caja esmaltada blanca sin costuras. Iverian sacó un hisopo de su envase estéril y lo pasó suavemente por toda la zona de la herida, asegurándose de que el exudado de la herida mojara bien la punta de algodón del hisopo. Cuando el hisopo se acercó a la zona de “inserción de muestras” de la caja, una pequeña puerta se abrió como por arte de magia, liberando un holograma de 10 pulgadas de alto de una técnica de laboratorio, llamada Marcia. Ella mostró a Iverian dónde debía acoplar la muestra. Marcia se desarrolló para guiar a los clientes a través del procedimiento de la prueba. “Para obtener los mejores resultados, inserte un nuevo cartucho de tinta biológica de fago, Dr. Iverian”, dijo Marcia. Al igual que ocurría con las impresoras 2D de antaño, el coste de los cartuchos de biotinta era casi tan elevado como el del propio dispositivo Phage-BEAM. Según “Business Insider”, la bio-tinta fágica era el segundo líquido más caro del mundo, por detrás del Chanel nº 8. Por suerte, como uno de los inventores, Iverian había obtenido el derecho a tener siempre a su disposición la versión más reciente de este dispositivo, incluyendo un suministro continuo de reactivos, de forma gratuita.
Iverian sabía perfectamente cómo funcionaba el dispositivo, por lo que no necesitaba la ayuda de Marcia. En primer lugar, se extraía el ADN de la punta del hisopo y se determinaba el metagenoma -todo el material genético presente en la muestra, incluidas las bacterias infectantes-. A continuación, estos datos genéticos se enviaron a un servidor seguro “Phage XChange”, donde un complejo algoritmo basado en la inteligencia artificial predijo la secuencia del genoma del fago que tenía más probabilidades de lisar las bacterias infectantes identificadas en el metagenoma y que supuestamente provocaría la reacción inmunitaria más débil en el paciente. Los datos del genoma del fago se enviaron al dispositivo Phage-BEAM, que primero sintetizó el genoma del fago y luego el fago, utilizando un sistema propio de producción de fagos sin bacterias.
En el plazo de 1 hora tras la toma de muestras, el dispositivo produciría un producto de fago terapéutico listo para usar. Los resultados del procedimiento paso a paso se transmitirían a la enorme pantalla de vídeo doméstica del salón de Iverian. Sentado en su sillón LC2, escuchando la Gran Misa en Do menor de Mozart, Iverian esperaba ansiosamente la llegada de los resultados. Tenía un mal presentimiento. El resultado provocó escalofríos en Iverian. Patógeno bacteriano identificado: Streptococcus pyogenes cepa FE-2033. Osuri activó inmediatamente el protocolo de alerta de infección, enviando un mensaje al Centro Mundial de Control de Enfermedades y proyectando información de fondo preocupante sobre la cepa bacteriana letal devoradora de carne, que se consideraba una amenaza inminente para la salud pública desde el año 2033. Por un momento, Iverian consideró la posibilidad de extirpar la herida infectada y parte del tejido sano circundante con un cuchillo de cocina, pero se calmó y decidió esperar y aplicar el inminente producto Phage-BEAM. Una hora después, el dispositivo Phage-BEAM había producido fagos sintéticos. Estos fagos se mezclaron entonces con las bacterias aisladas, en un módulo de validación, para probar su eficacia in vitro. Quince minutos después, se dio luz verde para que Iverian comenzara el tratamiento. Iverian aplicó los fagos en un apósito para heridas a base de hidrogel de liberación lenta, que se había mezclado primero con la suspensión concentrada de fagos producida por el dispositivo Phage-BEAM, y que también contenía antibióticos sinérgicos. El hidrogel alivió temporalmente el dolor, lo que le calmó aún más. Iverian repitió la aplicación del hidrogel cargado de fagos y antibióticos una vez al día. La infección de la herida mejoró en 24 horas y al cabo de 7 días la herida estaba casi completamente curada. La infección potencialmente mortal de Iverian fue tratada con éxito, a tiempo y sin salir de su casa. Pero, durante muchas décadas anteriores, no era seguro que la terapia con fagos se abriera paso hasta convertirse en una herramienta antibacteriana de amplia aplicación y utilidad clínica. El mundo de la medicina había tardado en darse cuenta de que la terapia con fagos no tenía por qué ser idéntica a la terapia con antibióticos, y ello principalmente por las peculiaridades de los agentes activos, los fagos.
Algunas peculiaridades relevantes de los fagos
Los fagos presentan una serie de propiedades que difieren de los antibióticos y que dificultan su desarrollo como productos farmacéuticos y su aplicación en la terapia. En primer lugar, tienden a ser específicos en cuanto a las bacterias que infectan. En el mejor de los casos, se dirigirán a una parte considerable de una sola especie bacteriana, pero en el peor de los casos sólo infectarán un pequeño número de cepas dentro de una especie. Por tanto, los fagos terapéuticos pueden seleccionarse para eliminar principalmente una especie bacteriana, o un subgrupo clínicamente relevante de la misma, y dejar a salvo las bacterias beneficiosas del paciente (por ejemplo, el intestino, la piel o la flora comensal oral). En cambio, la mayoría de los antibióticos que se emplean habitualmente tienen un amplio espectro de actividad, lo que puede causar “daños colaterales” a los microbiomas comensales del paciente, lo que a su vez puede dar lugar a efectos adversos como la selección de especies bacterianas resistentes a los antibióticos (por ejemplo, Clostridium difficile) o la diarrea asociada a los antibióticos (Jernberg et al., 2010). El inconveniente de la especificidad de los fagos es que es necesario identificar las bacterias infectantes antes de iniciar la terapia con fagos. En cambio, en la terapia antibiótica empírica se suelen utilizar cócteles de antibióticos de amplio espectro que afectan a una multitud de bacterias Gram-positivas y Gram-negativas, así como a diversos hongos. Cuando se conoce más información (por ejemplo, a partir de un cultivo bacteriano), el tratamiento puede consistir en antibióticos de espectro reducido, que se dirigen más específicamente a las bacterias u hongos identificados como causantes de la enfermedad.
En segundo lugar, las bacterias y los fagos participan en una relación huésped-parásito. Los fagos estrictamente líticos son omnipresentes en el medio ambiente y requieren la muerte de su huésped bacteriano para completar su ciclo vital. Sin huéspedes, los fagos no pueden existir. Los fagos imponen la selección de huéspedes resistentes, que a su vez imponen la selección de fagos eficaces. Esto da lugar a lo que se denomina “coevolución antagónica”, una carrera armamentística entre bacterias y fagos, caracterizada por la evolución recíproca de la resistencia bacteriana y la infectividad de los fagos (Buckling y Rainey, 2002). Al igual que con la mayoría de los antimicrobianos, las bacterias también se volverán resistentes a los fagos (Luria y Delbrück, 1943; Schooley et al., 2017), pero, a diferencia de los antibióticos estáticos, los fagos tienen la capacidad de superar la resistencia bacteriana (Buckling y Rainey, 2002). No obstante, hay indicios de que las bacterias y los fagos no aumentarán indefinidamente su respectiva resistencia e infectividad (Fortuna et al., 2019).
Enfoques de la terapia con fagos
En el momento del renacimiento de la terapia con fagos, a principios de la década de 2000, se habían desarrollado dos enfoques distintos de terapia con fagos (Pirnay et al., 2011). En lo que podría llamarse el enfoque de talla única, se aplicaron cócteles de fagos definidos de amplio espectro, que se suponía debían dirigirse a la mayoría de las bacterias sospechosas de causar ciertas enfermedades infecciosas. Estos cócteles de fagos de amplio espectro predefinidos se desarrollaron, produjeron y probaron dentro de los modelos farmacoeconómicos actuales, que habían sido diseñados para atender a medicamentos “estáticos” como los antibióticos. Sin embargo, los cócteles de fagos de amplio espectro, activos contra la mayoría de las bacterias Gram-positivas y/o Gram-negativas que se encuentran habitualmente en las enfermedades infecciosas, debían contener grandes cantidades de fagos y resultaron ser muy difíciles de desarrollar. Era posible desarrollar cócteles de fagos de espectro más reducido, activos contra una o unas pocas especies bacterianas, para utilizarlos en determinadas indicaciones y teniendo en cuenta que las especies bacterianas infectantes se conocían de antemano. Para algunas especies bacterianas, como Staphylococcus aureus, se han aislado y caracterizado fagos que muestran un rango de huéspedes excepcionalmente amplio (Vandersteegen et al., 2011). En PhagoBurn, un ensayo controlado aleatorizado, el éxito en la consecución de una reducción sostenida de la carga de Pseudomonas aeruginosa en las heridas por quemaduras estaba relacionado con la susceptibilidad inicial al cóctel de fagos (Jault et al., 2019). Sin embargo, se demostró que un tercio de los pacientes incluidos albergaban cepas de P. aeruginosa preexistentes resistentes al cóctel de fagos, que consistía en no menos de 12 fagos líticos de P. aeruginosa. Además, los cócteles de fagos que se diseñaron inicialmente para ser eficaces debían actualizarse con regularidad (por ejemplo, complementarse con nuevos fagos) en respuesta a la aparición de resistencia a los fagos o a la participación de nuevas cepas clínicamente relevantes en circulación. Por último, se desconocía si la confrontación de las bacterias con altas concentraciones de cócteles de fagos fijos provocaría la aparición, propagación y persistencia de la resistencia bacteriana a los fagos en los hospitales y en el medio ambiente, de forma similar a lo que había ocurrido con el uso masivo de antibióticos.
En los conceptos de terapia fágica personalizada, se seleccionaron uno o más fagos de un banco de fagos, o del medio ambiente, y posiblemente se adaptaron (selección in vitro de mutantes de fagos que exhiben una mayor infectividad) para infectar más eficientemente las bacterias aisladas del sitio de infección del paciente (Friman et al, 2016). Algunos centros de terapia con fagos crearon y mantuvieron grandes bancos de fagos terapéuticos, que se actualizaban periódicamente con nuevos fagos, ampliando y adaptando la gama de huéspedes del banco a las poblaciones bacterianas en constante cambio. Los enfoques de terapia con fagos personalizados eran potencialmente más sostenibles, ya que sólo se dirigía a la bacteria infectante, lo que daba lugar a una menor presión de selección hacia la resistencia bacteriana a los fagos. Sin embargo, también eran más elaborados y complejos desde el punto de vista logístico que los enfoques de talla única, ya que las cepas bacterianas y los fagos correspondientes se enviaban a todo el mundo (Figura 1). Además, los conceptos de medicina de precisión eran, en general, incompatibles con la mayoría de las vías de desarrollo y autorización de productos medicinales (fármacos en Estados Unidos), que requerían varios años y millones de euros (dólares) para completarse, y esto para cada fago del banco (Verbeken et al., 2012).
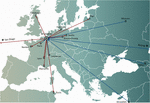
Figura 1. Transferencias internacionales de fagos desde (flechas rojas) y hacia (flechas azules) el Hospital Militar Reina Astrid (QAMH) de Bruselas con vistas a las aplicaciones clínicas durante el periodo 2015-2020. A nivel nacional, se enviaron fagos desde el QAMH a cinco hospitales universitarios (no se muestra). Además, la selección de los fagos coincidentes a menudo abarcaba la transferencia de los aislados bacterianos de los pacientes, y cinco pacientes internacionales (dos de Francia, dos de los Países Bajos y uno de Túnez) fueron trasladados a Bruselas para la terapia con fagos.
Entre la biología sintética
Con el inicio del tercer milenio, se habían desarrollado cada vez más enfoques de biología sintética para reducir la especificidad de los fagos y la aparición de la resistencia bacteriana a los fagos (por ejemplo, diseño guiado por la estructura) (Pires et al., 2016; Dunne et al., 2019). Por ejemplo, se elaboraron plataformas basadas en la levadura para el cambio de la proteína de la fibra de la cola del fago para diseñar fagos híbridos con un rango de huéspedes más predecible y extendido (Ando et al., 2015; Yosef et al., 2017) y estrategias de ingeniería genética (por ejemplo, herramientas de edición CRISPR-Cas) se desarrollaron para abordar otros aspectos como las interacciones negativas entre los pacientes y los fagos (por ejemplo, la respuesta inmunitaria antifágica) (Brown et al., 2017), la posible aparición y propagación de mecanismos de resistencia a los fagos bacterianos y la liberación de contenidos bacterianos nocivos como las endotoxinas (Hwang et al., 2018). Los genomas de fagos sintéticos debían reiniciarse para producir crías de fagos (Barbu et al., 2016; Pires et al., 2016), mediante la transformación de las formas L de Escherichia coli o Listeria monocytogenes (Kilcher et al., 2018), o utilizando sistemas de transcripción-traducción sin células (TXTL) (Rustad et al., 2018). Los marcos regulatorios occidentales habían comenzado a atender gradualmente los enfoques de terapia de fagos de precisión y personalizados que utilizan fagos de origen natural (Pirnay et al., 2018), fagos de ingeniería (Dedrick et al., 2019) y fagos sintéticos.
El desarrollo de dispositivos de producción de fagos terapéuticos ad hoc e in situ, como Phage-BEAM, no se desarrolló sin problemas, recordó Iverian. Para empezar, fue necesario el diseño y la combinación de fagos in silico basados en la inteligencia artificial (IA). Se eligió el aprendizaje profundo (Martorell-Marugán et al., 2019), un subconjunto del aprendizaje automático, para buscar vínculos entre los genomas bacterianos y los genomas de los fagos infectantes, porque era más fácil de escalar a un mayor número de muestras. Por ejemplo, los métodos de aprendizaje profundo no requerían la llamada extracción de características, que exigiría la anotación a nivel de genes/proteínas de los genomas de los fagos y las bacterias y limitaría las predicciones a ciertas relaciones conocidas entre las características de las bacterias y los fagos, como las estructuras de las fibras de la cola de los fagos que se unen a receptores específicos de la pared celular de las bacterias. Como contrapartida, necesitaba ser alimentado por un suministro continuo de cantidades masivas de datos, que relacionaran los genomas de los fagos líticos con los genomas de las bacterias hospedadoras, y ahí es donde el zapato se clavó. La secuenciación del genoma completo se había filtrado lentamente en la práctica de la microbiología clínica (American Academy of Microbiology, 2016), pero los institutos de investigación y las empresas farmacéuticas no estaban dispuestos a enviar sus datos a una única base de datos centralizada, y no se encontraron inversores dispuestos y capaces de adquirir los datos disponibles y/o producir cantidades suficientes de datos nuevos. Un segundo obstáculo que había que superar era la falta de disponibilidad de una síntesis rápida, fiable y asequible de grandes moléculas de ADN. Las técnicas iniciales de síntesis de ADN se basaban en la química orgánica y producían moléculas de ADN relativamente pequeñas. La síntesis de novo de genomas de fagos requería ensamblar varios fragmentos del genoma (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) en la levadura Saccharomyces cerevisiae, utilizando cromosomas artificiales de levadura (Ando et al., 2015), o ensamblaje químico (Gibson et al., 2009). El desarrollo de una nueva técnica para sintetizar ADN, basada en las enzimas sintetizadoras de ADN que se encuentran en las células del sistema inmunitario (Palluk et al., 2018), facilitó la síntesis del genoma del fago. Por último, hubo que superar algunos obstáculos para desarrollar sistemas genéricos de producción de fagos sin células, capaces de producir fagos en títulos elevados y de exhibir los mismos niveles de infectividad bacteriana que sus análogos naturales.
El avance
El principal problema fue que resultó muy difícil recopilar las cantidades masivas de secuencias vinculadas de fagos y genomas bacterianos necesarias para que los algoritmos de IA de aprendizaje profundo pudieran predecir y/o diseñar secuencias de fagos con un nivel de precisión terapéuticamente aceptable. Iverian recordó que el verdadero avance se produjo cuando la organización sin ánimo de lucro “Phage XChange” lanzó su plataforma global de gobernanza de fagos del mismo nombre para crear una cadena de suministro de fagos eficiente, estandarizada, sostenible y ética (Figura 2). Phage XChange consistía principalmente en un módulo de IA y un Libro Mayor Distribuido (DL) (Thiebes et al., 2020). El módulo de IA de la plataforma analizaba fagos y genomas bacterianos vinculados para predecir y diseñar fagos potentes para los clientes. También predijo qué patógenos bacterianos necesitaban una atención más urgente, basándose en el Internet de las Cosas (IoT) y el Big Data y en la información proporcionada por organizaciones internacionales de salud pública, como la Organización Mundial de la Salud (OMS) y los Centros de Control de Enfermedades nacionales. Estos datos dirigieron el sistema hacia el aislamiento y la caracterización de los fagos más urgentes.
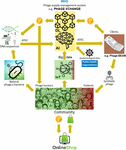
Figura 2. Visión de cómo podría organizarse la cadena de suministro de fagos en 2035. IA, inteligencia artificial; ATGC, secuencia de ADN; BEAM, antimicrobiano energizado de cabecera; DL, libro mayor distribuido; IoT, Internet de las cosas; P, PhageCoin; OMS, Organización Mundial de la Salud.
El módulo de DL de la plataforma garantizó una entrada suficiente, cualitativa y registrada de secuencias de fagos/genomas bacterianos vinculados al módulo de IA y el suministro ídem de secuencias de fagos a los clientes, en cumplimiento de las disposiciones del protocolo de Nagoya (Mesa redonda de expertos sobre la aceptación y reimplantación de la terapia con fagos bacterianos et al, 2018). El DL registró de forma inmutable todos los detalles de las partes interesadas (por ejemplo, proveedores de datos, servicios de secuenciación y clientes), de las transacciones y de los contratos. También registró la calidad exacta, las especificaciones y el peso del material suministrado. Un algoritmo determinó la no redundancia y estimó el peso (por ejemplo, la virulencia y el rango de huéspedes de los fagos) y la conveniencia del material enviado. Los fagos dirigidos a patógenos bacterianos emergentes eran, por supuesto, los más buscados. La mayoría de los problemas de patentes se obviaron. El DL actuó como un libro de pagos para asegurar que todas las partes fueran pagadas a tiempo y de forma justa. Se atribuyó un número de PhageCoins (la criptomoneda de la plataforma) a los proveedores en relación con la calidad, el peso y la conveniencia del material suministrado. Los clientes que extraían los resultados de las predicciones (secuencias de fagos) a través del DL pagaban una cantidad de PhageCoins, proporcional al valor estimado de los fagos. Estos PhageCoins se utilizaban para mantener el DL, para asegurar una afluencia suficiente y continua de material, y para ampliar los datos de virulencia de los fagos y de la gama de hospedadores (emparejando los fagos con las bacterias). Una inyección adicional de fondos e incentivos para suministrar material se encontró en los productores y proveedores de todo tipo de bienes. Con los PhageCoins ganados al instante, los proveedores de fagos podían comprar en línea todo tipo de productos a precios muy reducidos, desde material de laboratorio y escolar hasta artículos deportivos. Estos bienes se proporcionaban mediante el patrocinio de empresas. Varias empresas establecidas patrocinaron PhageXchange a cambio de reducciones fiscales, publicidad y la imagen de una marca socialmente responsable. El peso del material suministrado, y por tanto también su valor, fueron inicialmente infravalorados, pero se reevaluaron a intervalos regulares (iteración) y a los proveedores se les atribuyeron más PhageCoins cuando estaba justificado. Aunque fue útil desde el momento en que se introdujo, la plataforma sólo tuvo verdadero éxito cuando se puso bajo la protección de la OMS, en analogía con el sistema mundial de trazabilidad, transparencia, vigilancia y control de los medicamentos de origen humano (Warwick et al., 2013). Un acuerdo formal entre Phage XChange y la OMS aumentó la confianza internacional en la sostenibilidad a largo plazo de la plataforma y la protección contra la explotación comercial no ética. La búsqueda de potentes fagos terapéuticos pronto se convirtió en un esfuerzo comunitario destinado a resolver la crisis de resistencia a los antibióticos, con “cazadores de fagos” independientes, escuelas, grupos de exploradores, aldeas a orillas del río Amazonas, etc., que aislaban y enviaban fagos a Phage XChange, a cambio de PhageCoins. Al margen de esto, varias empresas e instituciones desarrollaron equipos y servicios periféricos, como kits de aislamiento de fagos y plataformas de secuenciación y sintetización de fagos (por ejemplo, el dispositivo Phage-BEAM). Anticipándose a estos dispositivos, se ofrecieron soluciones intermedias, por las que los propios fagos se obtenían a través del DL.
Epilog
Esta visión sobre el futuro de la terapia con fagos ofrece un final optimista a la crisis de resistencia a los antibióticos. La producción ad hoc e in situ de fagos sintéticos, vinculada a un sistema de gestión de fagos global y comunitario, resultó ser un arma adicional bienvenida y asequible (para los sistemas de seguridad social) en la lucha contra las infecciones bacterianas resistentes a los antibióticos. Sin embargo, no se trataba de una bala mágica, sino de un complemento sinérgico a los antimicrobianos establecidos. La producción instantánea y sin células de fagos sintéticos, diseñados o no, tenía ventajas considerables sobre los fagos naturales producidos de forma clásica (en huéspedes bacterianos):
(i) No era necesario mantener bancos físicos de fagos terapéuticos ni enviar los aislados bacterianos del paciente y los fagos terapéuticos correspondientes por todo el mundo.
(ii) Los fagos sintéticos contra bacterias que causan amenazas eminentes para la salud pública, como el brote de E. coli O104:H4 de 2011 en Alemania (Merabishvili et al, 2012), o bacterias (presuntamente) utilizadas para el bioterrorismo (Joñczyk-Matysiak et al., 2014) podrían producirse oportunamente in situ.
(iii) Los fagos contra bacterias que causan enfermedades potencialmente letales, para las que no se disponía de cepas huésped de producción no letal y cuya propagación solía requerir precauciones de biocontención de nivel de bioseguridad 3 (bsl-3), podrían sintetizarse en condiciones bsl-1.
(iv) Cuando no se pudieron aislar fagos de los sitios de muestreo, por ejemplo, porque las cepas de huéspedes bacterianas utilizadas en las técnicas de aislamiento no eran susceptibles a los fagos deseados, las secuencias genómicas de los fagos (predichas), extraídas de los datos metagenómicos (Reyes et al, 2010; Amgarten et al., 2018), podrían utilizarse para producir fagos sintéticos.
(v) Las preparaciones de fagos sintéticos no contenían (o contenían cantidades menores de) moléculas que pudieran tener un impacto negativo en los pacientes (por ejemplo, endotoxinas).
(vi) Se adaptaron dispositivos para producir fagos sintéticos durante los viajes espaciales prolongados y la colonización espacial (Taylor y Sommer, 2005).
Hay pocas posibilidades de que estas predicciones se hagan realidad. Probablemente sea demasiado miope pensar que un esfuerzo comunitario, apoyado por organizaciones de salud pública y gestionado por una plataforma global, sostenible y ética, podría ser el núcleo de una solución a la actual crisis mundial de resistencia a los antibióticos. Algunas partes del sistema propuesto, como la producción sin células de fagos sintéticos mediante un dispositivo de cabecera, tienen una posibilidad razonable de hacerse realidad, mientras que otros elementos, como el patrocinio corporativo, probablemente quedarán limitados al ámbito de la ciencia ficción. Pueden decir que soy un soñador, así que no duden en despertarme en 2035 para enfrentarme a la realidad.
Contribuciones del autor
J-PP concibió la visión y redactó el manuscrito.
Financiación
Los costes de publicación fueron cubiertos por la “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst”.
Conflicto de intereses
El autor declara que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
El editor de manejo declaró la coautoría pasada con el autor.
Agradecimientos
La visión personal, o el sueño, desarrollado en este manuscrito surgió como resultado de las interacciones con muchos colegas investigadores durante los últimos 15 años. Es imposible nombrarlos a todos, pero no sería justo atribuirse todos los méritos en solitario. Por lo tanto, decidí reconocer a algunos de ellos aquí (en orden alfabético), con el riesgo -o mejor, la certeza- de olvidar a algunos influenciadores importantes: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili, Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bossche, Mario Vaneechoutte, Gilbert Verbeken y Kilian Vogele.
Academia Americana de Microbiología (2016). Aplicaciones de la secuenciación clínica microbiana de próxima generación: Informe de un Coloquio de la Academia Americana de Microbiología celebrado en Washington, DC, en abril de 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P., da Silva, A. M., y Setubal, J. C. (2018). MARVEL, una herramienta para la predicción de secuencias de bacteriófagos en bines metagenómicos. Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., and Loessner, M. J. (2018). Reinicio de géneros cruzados de genomas de bacteriófagos sintéticos hechos a medida en bacterias de forma L. Proc. Natl. Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., y Lu, T. K. (2018). Aplicaciones basadas en fagos en biología sintética. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., y Delbrück, M. (1943). Mutaciones de bacterias desde la sensibilidad a los virus hasta la resistencia a los mismos. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “El aprendizaje profundo en el análisis de datos ómicos y la medicina de precisión”, en Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019.ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). Selección y caracterización de un bacteriófago terapéutico candidato que lisa la cepa de Escherichia coli O104:H4 del brote de 2011 en Alemania. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Aspectos clínicos de la terapia con fagos. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., et al. (2018). Síntesis de ADN de novo utilizando conjugados de polimerasa-nucleótido. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., y Lu, T. K. (2016). Fagos modificados genéticamente: una revisión de los avances en la última década. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). El paradigma de la fagoterapia: ¿prêt-à-porter o sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). El fago magistral. Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Virus en la microbiota fecal de gemelos monocigóticos y sus madres. Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P., and Noireaux, V. (2018). Síntesis de TXTL libre de células del bacteriófago T4 infeccioso en una sola reacción de tubo de ensayo. Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernández-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Desarrollo y uso de cócteles terapéuticos personalizados basados en bacteriófagos para tratar a un paciente con una infección diseminada de Acinetobacter baumannii resistente. Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z., y Morris, J. G. Jr. (2001). Bacteriophage therapy. Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Virus: desvelando la mayor biodiversidad de la Tierra. Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., y Sommer, A. P. (2005). Hacia un tratamiento racional de las infecciones bacterianas durante los viajes espaciales prolongados. Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B., and Sunyaev, A. (2020). Tecnología de libro mayor distribuido en la genómica: un llamamiento a Europa. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). Viejo dogma, nuevos trucos: la terapia de fagos del siglo XXI. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Evaluación microbiológica y molecular del bacteriófago ISP para el control de Staphylococcus aureus. PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J. P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Optimización del marco normativo europeo para la terapia bacteriófaga sostenible en medicina humana. Arch. Immunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L., and Wang, H. (2013). Sistemas de codificación globalmente consistentes para productos médicos de origen humano. Bull. World Health Organ. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., y Qimron, U. (2017). Ampliación del rango de huéspedes de las partículas de bacteriófagos para la transducción de ADN. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar
.