Pressure, Volume, and Temperature Relationships in Real Gases
Voor een ideaal gas geeft een plot van \(PV/nRT\) tegen \(P\) een horizontale lijn met een intercept van 1 op de as van \(PV/nRT\). Echte gassen vertonen echter aanzienlijke afwijkingen van het gedrag dat voor een ideaal gas wordt verwacht, vooral bij hoge drukken (figuur \PageIndex{1a}). Alleen bij relatief lage drukken (minder dan 1 atm) benaderen echte gassen het ideale gasgedrag (figuur \PageIndex{1b})).
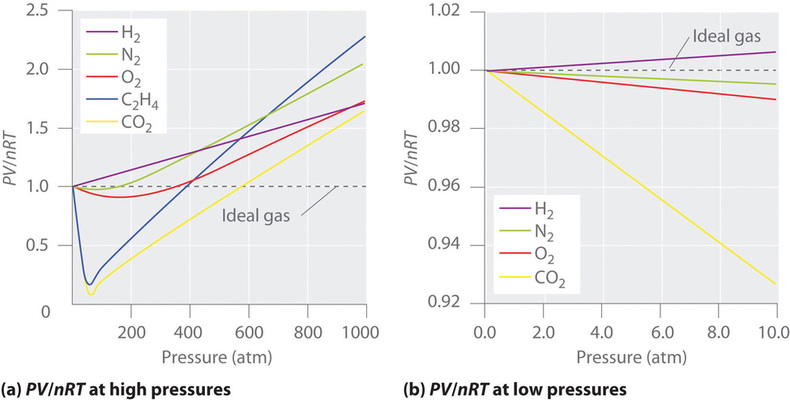
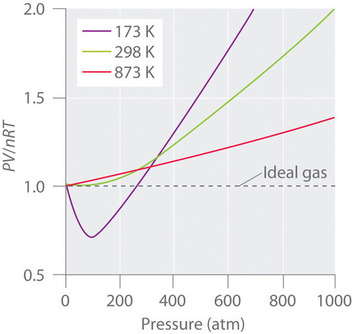
Reële gassen benaderen het ideale gasgedrag ook dichter bij hogere temperaturen, zoals blijkt uit figuur \(\PageIndex{2}) voor \(N_2). Waarom gedragen reële gassen zich zo anders dan ideale gassen bij hoge drukken en lage temperaturen? Onder deze omstandigheden zijn de twee basisveronderstellingen van de ideale gaswet, namelijk dat gasmoleculen een verwaarloosbaar volume hebben en dat intermoleculaire interacties verwaarloosbaar zijn, niet langer geldig.
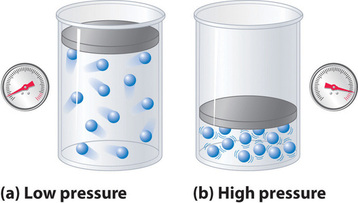
Omdat wordt aangenomen dat de moleculen van een ideaal gas geen volume hebben, is het voor beweging beschikbare volume altijd gelijk aan het volume van de houder. De moleculen van een echt gas hebben daarentegen kleine maar meetbare volumes. Bij lage druk liggen de gasmoleculen relatief ver uit elkaar, maar als de druk van het gas toeneemt, worden de intermoleculaire afstanden steeds kleiner (figuur). Als gevolg daarvan wordt het volume dat door de moleculen wordt ingenomen aanzienlijk groter dan het volume van de houder. Bijgevolg is het totale volume dat door het gas wordt ingenomen groter dan het volume dat wordt voorspeld door de ideale gaswet. Bij zeer hoge drukken is de experimenteel gemeten waarde van PV/nRT dus groter dan de waarde die door de ideale gaswet wordt voorspeld.
Bovendien worden alle moleculen door een combinatie van krachten tot elkaar aangetrokken. Deze krachten worden vooral belangrijk voor gassen bij lage temperaturen en hoge drukken, waar de intermoleculaire afstanden korter zijn. Aantrekkende krachten tussen moleculen verminderen het aantal botsingen met de wand van het vat, een effect dat sterker wordt naarmate het aantal aantrekkende interacties toeneemt. Omdat de gemiddelde afstand tussen de moleculen afneemt, neemt de druk die het gas op de wand van de container uitoefent af, en is de waargenomen druk lager dan verwacht (figuur 4). Zoals blijkt uit figuur P2, is bij lage temperaturen de verhouding PV/nRT lager dan voorspeld voor een ideaal gas, een effect dat vooral duidelijk wordt voor complexe gassen en voor eenvoudige gassen bij lage temperaturen. Bij zeer hoge druk overheerst het effect van het niet-nul moleculaire volume. De competitie tussen deze effecten is verantwoordelijk voor het minimum dat voor veel gassen wordt waargenomen in de grafiek tussen PV en P.285
Niet-nul moleculair volume maakt het werkelijke volume groter dan voorspeld bij hoge drukken; intermoleculaire attracties maken de druk kleiner dan voorspeld.
Bij hoge temperaturen hebben de moleculen voldoende kinetische energie om de intermoleculaire attractiekrachten te overwinnen, en overheersen de effecten van niet-nul moleculair volume. Omgekeerd, als de temperatuur wordt verlaagd, neemt de kinetische energie van de gasmoleculen af. Uiteindelijk wordt een punt bereikt waarop de moleculen de intermoleculaire aantrekkingskrachten niet langer kunnen overwinnen, en het gas vloeibaar wordt (condenseert tot een vloeistof).