- Wat is een polaire covalente binding?
- Eigenschappen van polaire covalente bindingen
- Voorbeelden van polaire covalente bindingen
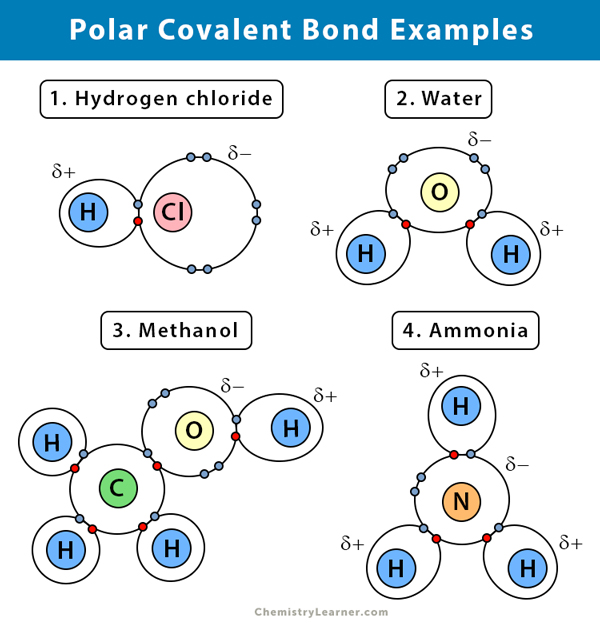
- Water (H2O)
- Waterstofchloride (HCl)
- Ammoniak (NH3)
- Waterstofbromide (HBr)
- Verschil tussen polaire en apolaire covalente bindingen
- Polaire covalente binding vs. Niet-polaire covalente binding
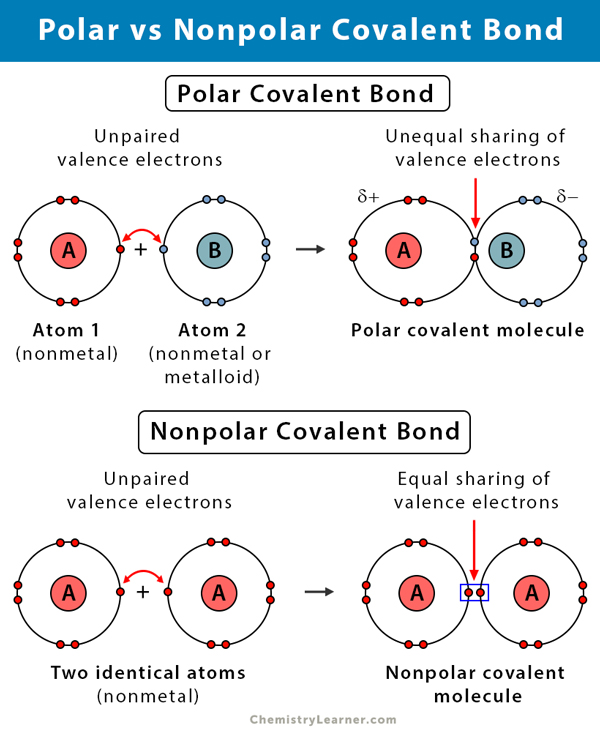
Wat is een polaire covalente binding?
Een covalente binding wordt gevormd wanneer twee atomen elektronen met elkaar delen. De covalente binding zal waarschijnlijk polair zijn wanneer de elektronen ongelijk verdeeld zijn. De scheefheid ontstaat door het verschil in de elektronegativiteit van de twee atomen. Elektronegativiteit is een maat voor de neiging van een atoom om een bindingspaar elektronen aan te trekken. Deze wordt gemeten met behulp van een schaal die bekend staat als de Pauling-schaal en varieert van 0,7 tot 4. De volgende tabel verklaart het type chemische binding dat wordt gevormd als gevolg van dit verschil in elektronegativiteit .
| Type chemische binding | Elektronegativiteitsverschil |
|---|---|
| Niet polaire covalente | 0 |
| Enigszins polaire covalente | 0.1 tot 0,4 |
| Polair covalent | 0,5 tot 2 |
| Ionisch | > 2 |
Hoe groter het verschil in elektronegativiteit, des te groter is de polariteit en de bindingssterkte. Vandaar dat polaire covalente bindingen een intermediaire bindingssterkte hebben.
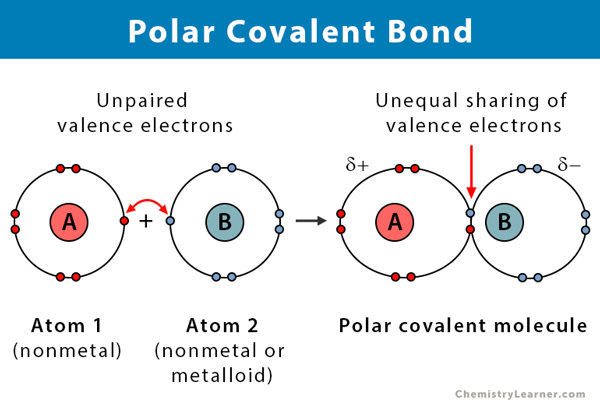
Eigenschappen van polaire covalente bindingen
Hier volgen enkele feiten over polaire covalente bindingen.
- Vindt plaats tussen twee niet-metalen of tussen een niet-metaal en een metalloïde
- Het ongelijk delen van elektronen in een verbinding
- Elektronegativiteitsverschil tussen atomen ligt tussen 0.1 en 2
- Een uiteinde van de binding is positief geladen, en het andere uiteinde is negatief geladen
- Polaire verbindingen lossen op in een polair oplosmiddel
Voorbeelden van polaire covalente bindingen
Hier volgen enkele voorbeelden van een polaire covalente binding met het elektronegativiteitsverschil tussen de twee bindingsatomen :
| Samenstellingsnaam | Moleculaire formule | Binding | Elektronegativiteit verschil |
|---|---|---|---|
|
Water |
H2O |
O-H |
|
| waterstoffluoride | HF | H-F | 1.9 |
| Waterstofchloride | HCl |
H-Cl |
0.9 |
|
waterstofbromide |
HBr |
H-Br |
|
|
Ammonia |
NH3 |
N-H |
|
|
Zwaveldioxide |
SO2 | S=O | 1 |
| Waterstofsulfide | H2S | H-S | 0.4 |
| Methanol | CH3OH | O-H | 1,4 |
Een verklaring van de polaire covalente binding in enkele verbindingen volgt hieronder.
Water (H2O)
Water is een polair oplosmiddel. Een polaire covalente binding ontstaat wanneer het zuurstofatoom (O), dat elektronegatiever is dan waterstof, de gedeelde elektronen naar zich toe trekt. Als gevolg daarvan heeft het zuurstofatoom een gedeeltelijke negatieve lading. De waterstofatomen (H) daarentegen zijn in wezen protonen en hebben een gedeeltelijke positieve lading.
Waterstofchloride (HCl)
Waterstofchloride is een polaire covalente verbinding omdat het chlooratoom (Cl) elektronegatiever is dan het waterstofatoom (H). Dus chloor draagt een gedeeltelijke negatieve lading, terwijl waterstof een gedeeltelijke positieve lading draagt.
Ammoniak (NH3)
Ammoniak is een polaire molecule. Het centrale atoom, stikstof (N), is gebonden aan drie waterstofatomen (H). Aangezien N elektronegatiever is dan H, zullen de elektronen de neiging hebben rond het N-atoom te blijven hangen.
Waterstofbromide (HBr)
Het verschil in elektronegativiteit tussen waterstof (H) en broom (Br) is niet al te groot. Daarom heeft het HBr-gas een covalente gepolariseerde binding, en het waterstofatoom heeft een lichte positieve lading, en broom heeft een lichte negatieve lading. Het gevolg is dat het elektronenpaar wordt aangetrokken door het broom.
Verschil tussen polaire en apolaire covalente bindingen
In de volgende tabel worden polaire en apolaire covalente bindingen vergeleken en tegenover elkaar gesteld.
Polaire covalente binding vs. Niet-polaire covalente binding |
||
| Polair | Niet-polair | |
|---|---|---|
|
Types van atomen |
Tussen twee niet-metalen met verschillende elektronegativiteiten |
tussen twee niet-metalen met dezelfde elektronegativiteiten |
|
Elektronegativiteitsverschil |
0.1 – 2 |
|
|
Elektronenverdeling |
Asymmetrisch. Ongelijke verdeling. |
Symmetrisch. Gelijke verdeling. |
|
Verplaatsing van gedeelde elektronen |
Naar het meer elektronegatieve atoom, waardoor dat deel negatief wordt |
Geen verplaatsing. Elektrisch neutraal. |
|
Dipoolmoment |
Niet-nul |
Nul |
|
Aanwezigheid van andere soorten bindingen in verbindingen |
Hydrogeenbinding |
Van der Waals binding |
|
Affiniteit met water |
Hydrofiel |
Hydrofoob |
|
Fysische eigenschappen van de verbindingen |
Hoog smelt- en kookpunten |
Lage smelt- en kookpunten |
|
Volatiliteit van vloeistoffen |
Lage vluchtigheid |
Hoge vluchtigheid |
|
Oplosbaarheid van verbindingen |
Oplosbaar in polaire oplosmiddelen |
Oplosbaar in apolaire oplosmiddelen |
|
Voorbeelden |
Water (H2O), ammoniak (NH3), en waterstofchloride (HCl) |
waterstof (H2), zuurstof (O2), en stikstof (N2) |