Introduction
Amyotrofe laterale sclerose (ALS) is een progressieve aandoening die gekenmerkt wordt door de betrokkenheid van zowel de bovenste als de onderste motor neuronen (UMNs en LMNs). Bij ALS tast de spierafbraak bij voorkeur de abductor pollicis brevis (APB) en de eerste dorsale interosseus aan, met relatief behoud van de abductor digiti minimi (ADM). Dit specifieke kenmerk van ALS wordt het “split-hand” teken genoemd (Wilbourn, 2000). In het algemeen is de mate van verlies van motorische eenheden significant groter in de APB dan in de ADM bij patiënten met ALS (Kuwabara et al., 1999). Zowel corticale als perifere mechanismen zijn voorgesteld om de verschillende niveaus van atrofie van de kleine handspieren bij ALS te verklaren (Weber et al., 2000; Shibuya et al., 2013). De bevindingen van transcraniële magnetische stimulatie studies hebben aangetoond dat corticomotoneuronale input naar de spinale motoneuronen die het thenar complex innerveren uitgebreider is bij normale deelnemers (Macdonell et al., 1999; Menon et al., 2014). Een dergelijk verschil in inputs zou ertoe kunnen leiden dat deze spinale motoneuronen bij voorkeur degenereren in ALS via een transsynaptisch anterograde excitotoxisch mechanisme. Corticomotoneuronale projecties naar het thenar complex zijn bij voorkeur aangetast in ALS, wat suggereert dat corticomotoneuronale disfunctie bijdraagt aan het split-hand teken in ALS (Weber et al., 2000). Onderzoeken van de exciteerbaarheid van perifere zenuwen hebben gesuggereerd dat de motoneuron axonen die de APB innerveren hyperexciteerbaar zijn en vatbaar voor degeneratie in ALS (Vucic en Kiernan, 2010; Shibuya et al., 2013). Tot op heden zijn er echter weinig studies die het disfunctioneren of de exciteerbaarheid van motoneuronen die de APB en ADM bedienen direct hebben vergeleken. De F-golf is een late en lage-amplitude respons die antidromische activatie van motoneuronen reflecteert (Pastore-Olmedo et al., 2009). F-golven kunnen een onafhankelijke maat zijn voor de exciteerbaarheid van segmentale motoneuronen (Fisher, 1992; Milanov, 1992; Hachisuka et al., 2015). Het primaire doel van deze studie was om de verschillen in disfunctie tussen spinale motoneuronen die de APB en ADM innerveren in ALS te onderzoeken met behulp van F-golven.
Materialen en Methoden
Deelnemers
We onderzochten 40 patiënten met sporadische ALS en 20 leeftijd- en geslachtsgematchte normale deelnemers. Alle patiënten werden gezien op de afdeling Neurologie in het Peking Union Medical College Hospital tussen augustus 2013 en juni 2014. De ALS-patiënten die voldeden aan de gemodificeerde El Escorial-criteria voor definitieve, waarschijnlijke of waarschijnlijke laboratorium-ondersteunde ALS (Brooks et al., 2000) werden achtereenvolgens ingeschreven in de studie. Verschillende elektrofysiologische onderzoeken en klinische kenmerken, zoals leeftijd bij inschrijving en de tijd vanaf het begin van de symptomen, werden geanalyseerd bij deze patiënten. Bij geen van de ALS patiënten werd een genetische mutatie vastgesteld. UMN betrokkenheid in de bovenste ledematen werd gesuggereerd door de aanwezigheid van clonus, verhoogde tonus, brisante peesreflexen, en positieve Hoffman tekenen. De ALS patiënten werden in twee groepen ingedeeld op basis van hun lichamelijke symptomen. De patiënten in groep 1 (20 patiënten met ALS) vertoonden verslapping en zwakte van de intrinsieke handspieren. De patiënten in groep 2 (20 patiënten met ALS) vertoonden geen verslapping of zwakte van de intrinsieke handspieren en vertoonden geen of een milde beperking van discrete vingerbewegingen. De gegevens voor de meer aangetaste hand werden geanalyseerd voor de ALS-patiënten van groep 1, terwijl de gegevens voor de meer intacte hand werden geanalyseerd voor de ALS-patiënten van groep 2. De gegevens voor de linkerhand werden geanalyseerd voor de normale controles (NC’s). De ALS-patiënten werden klinisch geordend met behulp van de ALS functional rating scale-revised (ALSFRS-R; Cedarbaum et al., 1999) en ingedeeld op basis van de plaats waar de ziekte was begonnen. De elektrodiagnostische kenmerken van alle ALS patiënten waren consistent met een diffuse en progressieve degeneratie van de voorste hoorncellen. Ten tijde van het onderzoek nam geen van de patiënten riluzole of andere antispasticiteitsmedicijnen. Deelnemers met een toevallig carpaal of cubitaal tunnelsyndroom, gebaseerd op klinisch onderzoek en zenuwgeleidingsonderzoeken, werden uitgesloten. Alle proefpersonen gaven geïnformeerde schriftelijke toestemming om deel te nemen aan het onderzoek. De studie werd goedgekeurd door de Ethische Commissie van Klinisch Onderzoek van het Peking Union Medical College Hospital (Beijing, China), en alle procedures werden uitgevoerd in overeenstemming met de Verklaring van Helsinki.
Nerve Conduction Study
De elektrofysiologische tests werden uitgevoerd met behulp van een Viking IV electromyografie (EEG) systeem (Nicolet Biomedical, Madison, WI, USA). Samengestelde spieractiepotentialen (CMAPs) werden opgenomen van de APB en ADM spieren na mediane of ulnaire zenuwstimulatie aan de pols. De huidtemperatuur voor de onderzochte ledematen werd gehandhaafd op >32°C. De distale motor latentie (DML), piek-tot-piek CMAP amplitude, motorische geleiding snelheid (MCV) en ADM / APB CMAP amplitude ratio werden gemeten.
F-golf Studie
Alle proefpersonen waren rugligging en ontspannen tijdens de experimenten. De F-golven van de mediane en ulnaire zenuwen werden opgenomen met oppervlakte elektroden bevestigd op de huid boven de APB en ADM spieren. De bestudeerde zenuwen werden gestimuleerd door het toedienen van 100 supramaximale stimuli met een frequentie van 1 Hz op een plaats die 7 cm proximaal was van de actieve opname-elektrode met de kathode proximaal van de anode. Een totaal van 100 stimuli werden geschikt geacht voor het verkennen van het volledige potentieel van F-golven (Fisher et al., 1994). De filter instellingen waren 20 Hz tot 10 kHz, de sweep snelheid was 5 ms per divisie, en de versterker winst was 0,5 mV per divisie. A-golven, die werden gedefinieerd als identieke late responsen met constante latenties die in ten minste 8 van de 20 traces voorkwamen, werden uitgesloten van de F-golf studie (Puksa et al., 2003). De volgende F-golf parameters werden geanalyseerd: minimale latentie, gemiddelde latentie, maximale latentie, F-golf persistentie, gemiddelde amplitude, gemiddelde F/M amplitude ratio, en het aantal herhaalde F-golven. De piek-tot-piek amplitude van een F-golf werd gemeten als de amplitude ten minste 40 μV was. De gemiddelde F / M amplitude ratio werd berekend door het delen van de gemiddelde F-golf amplitude door de overeenkomstige maximale CMAP amplitude. Een repeterende neuron (RN) was een neuron dat aanleiding gaf tot een reeks F-golven met identieke latenties, amplitudes, en vormen, en deze F-golven werden gedefinieerd als repeater F-golven. RNs en repeater F-golven werden gedetecteerd via visuele inspectie en werden handmatig gesuperponeerd op de andere repeater F-golven. De repeater F-golven werden gemeten met behulp van de volgende indices: index RN = 100 × aantal RN/aantal sporen met verschillende F-golfvormen in een reeks van 100 stimuli; index repeater F-golven (Freps) = 100 × aantal repeater F-golven/totaal aantal sporen met F-golven in dezelfde zenuw (Chroni et al., 2012).
Statistische Analyses
De Shapiro-Wilk test werd gebruikt om de normaliteit van de gegevens te beoordelen. Wanneer de P-waarde in de variantieanalyse significantie bereikte, werd de Student-Newman-Keuls test uitgevoerd. De independent-sample t-test werd gebruikt om verschillen tussen twee groepen te beoordelen. Voor niet-parametrische gegevens werden vergelijkingen tussen groepen uitgevoerd met de Kruskal-Wallis H-test. Zodra de nulhypothese was verworpen, werden de paarsgewijze vergelijkingen van de groepen getest met de Mann-Whitney U test en Bonferroni correctie met een significantieniveau van P < 0,017. De verschillen in categorische variabelen werden onderzocht met de Chi-kwadraat toets. De statistische significantie werd vastgesteld op P < 0,05. SPSS voor Windows, versie 21.0 (SPSS, Inc., Chicago, IL, USA), werd gebruikt om de statistische analyses uit te voeren.
Resultaten
De klinische profielen van de ALS patiënten en de NC deelnemers zijn samengevat in Tabel 1. Alle ALS patiënten waren klinisch LMN-predominant. De leeftijd bij onderzoek, geslachtsverhouding en lengte waren vergelijkbaar in de drie groepen. Van de ALS-patiënten had 70% van de patiënten in groep 1 last van de ziekte van de bovenste ledematen en 25% van de patiënten in groep 2. Er waren 11 ALS-patiënten in groep 1 en 10 in groep 2 met twee aangedane lichaamsregio’s, en er waren 9 gegeneraliseerde patiënten in groep 1 en 10 in groep 2. De ziekteduur en de ALSFRS-R scores verschilden niet significant tussen de ALS-patiënten in groep 1 en 2.

Tabel 1. Klinische profielen van de deelnemers.
Tabel 2 toont de resultaten van het zenuwgeleidingsonderzoek voor de ALS patiënten en de NC’s. De ADM/APB CMAP amplitude ratio was significant verhoogd bij de ALS patiënten in groep 1 vergeleken met de NC groep, wat consistent werd waargenomen met het split-hand teken bij ALS patiënten (Kuwabara et al., 2008). De resultaten van het F-golf onderzoek voor de ALS patiënten en NC’s zijn weergegeven in Tabel 3. De gemiddelde F-golf amplitude voor de APB was significant lager in groep 1 dan in groep 2, die vergelijkbaar waren tussen groep 2 en de NC’s. De gemiddelde F-golf amplitudes van de ADM in groep 1 en 2 waren significant hoger vergeleken met die in de NC’s. De F/M amplitude verhoudingen van de APB en ADM in groep 1 waren significant hoger dan die in groep 2 en NC’s, terwijl groep 2 en NC’s vergelijkbare F/M amplitude verhoudingen vertoonden. De F-golf persistentie van de APB, die significant lager was bij de ALS patiënten dan bij NC’s, was vergelijkbaar tussen groep 1 en 2. De F-golf persistentie van de ADM was significant lager in groep 1 dan in groep 2 en NC’s, terwijl de F-golf persistentie van de ADM vergelijkbaar was tussen groep 2 en NC’s. De index RN en de index Freps van APB waren significant verhoogd in groep 1 en 2 vergeleken met de NC’s, maar deze indices waren vergelijkbaar tussen groep 1 en 2. De index RN en de index Freps van de ADM waren significant hoger in groep 1 dan in groep 2 en de NC’s, terwijl groep 2 en de NC’s vergelijkbare waarden vertoonden voor deze indexen. Figuur 1 toont representatieve voorbeelden van F-golfsporen voor de n. medianus en de n. ulnaris, opgenomen bij ALS-patiënten uit groep 1, 2 en de NC’s.

Tabel 2. Resultaten van zenuwgeleidingsonderzoek.

Tabel 3. F-golf studie bij de ALS patiënten en de normale controles.

Figuur 1. Representatieve voorbeelden van F-golven opgenomen van de amyotrofische laterale sclerose (ALS) patiënten en de normale controles (NCs). (A) F-golven opgenomen van een ALS-patiënt hand vertoont verspilling en zwakte. Verminderde F-golf persistentie en een verhoogd aantal repeater F-golven werden waargenomen op F-golven opgenomen van zowel de mediane als de ulnaire zenuwen. (B) F-golven opgenomen van een hand van een ALS-patiënt zonder waarneembare verslapping of zwakte. De F-golf persistentie was verminderd en het aantal herhalende F-golven was verhoogd op de nervus medianus, terwijl parameters van F-golven opgenomen van de nervus ulnaris relatief normaal waren. (C) F-golven opgenomen bij een gezonde proefpersoon aan de linker bovenste ledemaat. F-golf amplitudes, latenties en golfvormen waren variabel, en F-golf persistentie was normaal op zowel de mediane als ulnaire zenuwen. Letters aan de rechterkant van de plaat geven repeater F-golven aan op basis van amplitude, latentie en golfvorm. Kalibraties zijn 0.5 mV en 5 ms voor F-golf opname.
Tabel 4 toont de diagnostische prestaties van de F-golf in ALS vs. NCs. De F-golf zou kunnen worden gebruikt om ALS patiënten te onderscheiden van NCs. De index RN en index Freps van de APB bleken betrouwbare variabelen te zijn voor het onderscheiden van ALS-patiënten van NC’s, aangezien het gebied onder de curve (AUC) voor de index RN (0,998, 95% betrouwbaarheidsinterval (CI) 0,937-1,000) en index Freps (1,000, 95% CI 0,940-1,000) een “zeer goede” diagnostische bruikbaarheid vertoonde. De rest van de F-golf variabelen hadden lagere AUC-waarden dan de index RN en index Freps van de APB en vertoonden dus minder diagnostisch nut. De ADM/APB CMAP amplitude ratio toonde een AUC van 0,766 (95% CI 0,638-0,865, P < 0,001) en kon ALS-patiënten matig onderscheiden van NCs. Het gebruik van een afkapwaarde van ADM/APB > 1,7 (Kim et al., 2015) voor het stellen van de diagnose ALS leverde een matige sensitiviteit (52,5%) en een hoge specificiteit (85,0%) op in vergelijking met controles. De F-golf persistentie (P = 0,002), index RN (P < 0,001) en index Freps (P < 0,001) in de APB bleken ALS-patiënten robuuster te differentiëren van NC’s dan de ADM/APB CMAP amplitude ratio.
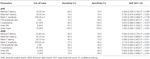
Tabel 4. Diagnostic performance of F-wave in amyotrophic lateral sclerosis (ALS) vs. normal controls (NCs).
Discussie
Het primaire doel van deze studie was om met behulp van F-golf metingen de verschillen in disfunctie tussen APB en ADM motoneuronen vast te stellen bij patiënten met ALS. Volgens een voorgesteld stageringssysteem voor ALS (Roche et al., 2012), waren de stadia van de ziekte vergelijkbaar tussen groep 1 en 2. Het verschil in het percentage van het begin van de ziekte in de bovenste ledematen tussen groep 1 en 2 kan de oorzaak zijn van een verschillend patroon van ziekteprogressie tussen de twee groepen. Het geschatte aantal motor units en CMAP amplitudes zijn nuttige parameters voor het evalueren van motoneuron verlies, terwijl de F-golf een directe probe kan zijn van disfunctie of instabiliteit in anterieure hoorncellen (Hachisuka et al., 2015). De F-golf persistentie is gerelateerd aan het aantal LMNs en motoneuron exciteerbaarheid (Schiller en Stalberg, 1978; de Carvalho et al., 2002; Argyriou et al., 2006). De voorgestelde mechanismen die ten grondslag liggen aan repeater F-golven zijn verhoogde exciteerbaarheid in bepaalde anterieure hoorncellen, verlaagde exciteerbaarheid in sommige motoneuronen, of verlies van motoneuronen (Schiller en Stalberg, 1978; Petajan, 1985; Peioglou-Harmoussi et al., 1987; Hachisuka et al., 2015). Naarmate motoneuronen verloren gaan, kunnen herhalende F-golven van individuele motoneuronen mogelijk gemakkelijker worden herkend; er is echter betoogd dat de lage frequentie van backfiring van individuele motoneuronen dit mechanisme vrij onwaarschijnlijk maakt (Chroni et al., 2012). Fysiologisch waren er significante verschillen in de F-golf persistentie en het aantal herhalende F-golven tussen de APB en ADM. Deze bevindingen kunnen geassocieerd zijn met een lager aantal functionele motoneuronen dat de APB innverveert (Gooch et al., 2014), of een verhoogde corticale inhibitoire modulatie van de APB (Menon et al., 2014).
In ALS ontwikkelt disfunctie van spinale motoneuronen zich geleidelijk voor het begin van de openlijke symptomen (Bradley, 1987). In de huidige studie vertoonden de ALS patiënten die geen aantoonbare verspilling of zwakte in de handen hadden, significant verminderde F-golf persistentie en hogere index RN en index Freps waarden voor de APB vergeleken met die van NCs. Bovendien vertoonden deze ALS patiënten relatief normale F-golf waarden in de ADM. Deze gegevens zijn consistent met een preferentiële disfunctie van spinale motoneuronen die de APB innerveren in ALS (Baumann et al., 2012). In ALS kunnen de spinale motoneuronen die de APB innerveren echter actiever zijn dan de motoneuronen die de ADM innerveren, en de CMAP amplitude kan onvoldoende sensitiviteit hebben voor het detecteren van motoneuron verlies omdat de overgebleven motoneuronen compensatoire collaterale reïnnervatie van gedenerveerde spiervezels kunnen leveren (van Dijk et al., 2010). Het analyseren van F-golven, met name F-golven in de mediane zenuwen, zou kunnen helpen bij het detecteren van subtiele veranderingen van voorste hoorncellen, zelfs bij ALS-patiënten zonder klinische symptomen, en kan dus een nuttige benadering zijn voor het evalueren van de ziekteprogressie.
Er is aangetoond dat beschadiging van de LLMM de amplitude van F-golven vermindert (Fisher, 1992). Spieratrofie kan leiden tot een zwakkere spierrespons door het gedeeltelijk neutraliseren van de hyperexciteerbaarheid van de motoneuronenpool (Drory et al., 1993). In de huidige studie vertoonden de ALS patiënten die zich presenteerden met het split-hand teken significant verminderde F-golf amplitudes, verminderde F-golf persistentie, en een verhoogd aantal repeater F-golven in de APB in vergelijking met de ADM, wat waarschijnlijk wijst op ernstigere schade aan de spinale motoneuronen die de APB innerveren. De vorming van grote post-reïnnervatie motor units zou kunnen bijdragen aan de toename van de F-golf amplitude (Drory et al., 2001). Een significant verhoogde F-golf amplitude in de ADM vergeleken met de APB in de ALS patiënten is consistent met een langzamer verlies van motoneuronen in de ADM motoneuron pool (Baumann et al., 2012). De F/M amplitude ratio kwantificeert het deel van de motoneuron pool dat geactiveerd wordt tijdens een serie van F-golven (Drory et al., 2001). De significant verhoogde F/M amplitude ratio in de APB vergeleken met die in de ADM van ALS patiënten weerspiegelt een verhoogde neiging van de motoneuronen die de APB innerveren om F-golven te genereren. Omgekeerd benadrukt de combinatie van de afgenomen gemiddelde F-golf amplitude en de toegenomen F/M amplitude ratio in de APB de preferentiële betrokkenheid van de APB bij ALS. Herhaalde F-golven wijzen op pathologische veranderingen in motorische eenheden (Hachisuka et al., 2015). De significante toename van het aantal herhalende F-golven in de APB kan een grotere mate van hyperexciteerbaarheid impliceren binnen de spinale motoneuronen die de APB innerveren (Fang et al., 2015).
Intrigerend genoeg vertoonden ALS-patiënten zonder waarneembare handspieratrofie een gemiddelde F-golfamplitude voor de APB die significant hoger was dan die voor de ALS-patiënten die zich presenteerden met het split-hand teken. De gemiddelde F-golf amplitude voor de ADM was echter vergelijkbaar tussen de twee ALS patiëntengroepen, ongeacht de atrofie van de handspieren, maar was significant hoger bij de ALS patiënten dan bij de NCs. De verschillen in de F-golf karakteristieken tussen de APB en ADM kunnen worden toegeschreven aan de concurrerende effecten van degeneratie en regeneratie binnen de motor unit. Bij degeneratie van motorische neuronen compenseren de overlevende motorische neuronen dit door de gedenerveerde spiervezels te reïnnerveren via axonale uitlopers (Ibrahim en el-Abd, 1997). Bij ALS kan het denervatieproces vroeger beginnen en sneller verlopen in de thenar regio. De snelheid van degeneratie was trager in de motoneuronen die de ADM innerveren dan in die welke de APB innerveren. Verdere studies zijn nodig om de mechanismen in ALS op te helderen die bijdragen aan de verschillen in motoneuron dysfunctie tussen motoneuronen die de APB en ADM bedienen. Wij vermoedden dat corticale mechanismen, perifere axonale mechanismen, of spinale segmentale disfunctie, met name in spinale inhibitorische circuits, zouden kunnen bijdragen aan de preferentiële degeneratie van spinale motoneuronen die de APB bedienen (Turner en Kiernan, 2012; Ramírez-Jarquín et al., 2014).
Vorig onderzoek toonde aan dat het split-hand teken vaker wordt waargenomen in ALS, en de verhoogde ADM/APB CMAP amplitude ratio is bijna specifiek voor ALS. De huidige studie toonde aan dat het neurofysiologische criterium voor de ADM/APB van een CMAP amplitude ratio >1.7 (Kuwabara et al., 2008) een matige sensitiviteit en hoge specificiteit heeft in het onderscheiden van ALS van NC’s, wat consistent is met eerdere studies (Kim et al., 2015). In deze studie konden de F-golf parameters helpen om ALS patiënten op een betrouwbare manier te onderscheiden van de normale deelnemers. Bovendien konden de F-golf persistentie, index RN en index Freps in de APB ALS-patiënten betrouwbaar onderscheiden van de NC’s, aangezien deze maten grotere AUC-waarden vertoonden dan de ADM/APB CMAP amplitude ratio.
Onze analyse heeft verschillende beperkingen. Dit was een cross-sectionele studie, en een relatief klein aantal deelnemers werd geïncludeerd. Een follow-up studie met een grotere populatie is nodig om specifiek de mate van spinale disfunctie te bepalen die geassocieerd is met het split-hand teken bij ALS. Een andere potentiële beperking is het ontbreken van een patiënten controlegroep bestaande uit patiënten met syndromen die ALS nabootsen. Een dergelijke groep zou nuttig zijn om de klinische waarde van de F-golf te beoordelen bij het onderscheiden van ALS van aandoeningen die ALS nabootsen. Bovendien zouden verdere elektrofysiologische studies die gebruik maken van de methoden voor het evalueren van UMN disfunctie, evenals de exciteerbaarheid van de motor axonen, moeten worden uitgevoerd op dezelfde patiëntengroepen om meer licht te werpen op de pathofysiologie van dit fenomeen.
Concluderend, onze bevindingen tonen verschillen aan in F-golf karakteristieken tussen de APB en ADM bij patiënten met ALS. Deze veranderingen in de F-golven zijn karakteristiek voor ALS-patiënten en kunnen nuttig zijn om ALS te onderscheiden van bepaalde aandoeningen die ALS nabootsen. Opheldering van de pathofysiologische mechanismen die ten grondslag liggen aan de verschillende niveaus van atrofie in de kleine handspieren zou licht werpen op de pathogenese van ALS.
Author Contributions
JF en LC: bedachten, voerden uit en ontwierpen de experimenten. JF, LC, ML en YG: analyseerden de gegevens. ML, YG, XL, DL, BC, DS en QD: reagentia/materialen/analyse-instrumenten bijgedragen. JF en LC: hebben bijgedragen aan het schrijven van het manuscript.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek is uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Aankondigingen
Wij danken de ALS patiënten en de gezonde vrijwilligers die aan deze studie hebben deelgenomen.
Argyriou, A. A., Polychronopoulos, P., Talelli, P., and Chroni, E. (2006). F-wave study in amyotrophic lateral sclerosis: assessment of balance between upper and lower motor neuron involvement. Clin. Neurophysiol. 117, 1260-1265. doi: 10.1016/j.clinph.2006.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Baumann, F., Henderson, R. D., Gareth Ridall, P., Pettitt, A. N., and McCombe, P. A. (2012). Quantitative studies of lower motor neuron degeneration in amyotrophic lateral sclerosis: evidence for exponential decay of motor unit numbers and greatest rate of loss at the site of onset. Clin. Neurophysiol. 123, 2092-2098. doi: 10.1016/j.clinph.2012.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bradley, W. G. (1987). Recent views on amyotrophic lateral sclerosis with emphasis on electrophysiological studies. Muscle Nerve 10, 490-502. doi: 10.1002/mus.880100603
PubMed Abstract | CrossRef Full Text | Google Scholar
Brooks, B. R., Miller, R. G., Swash, M., and Munsat, T. L. (2000). El escorial revisited revised criteria for the diagnosis of amyotrophic lateral sclerosis. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 1, 293-299. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedarbaum, J. M., Stambler, N., Malta, E., Fuller, C., Hilt, D., Thurmond, B., et al. (1999). The ALSFRS-R a revised ALS functional rating scale that incorporates assessments of respiratory function. J. Neurol. Sci. 169, 13-21. doi: 10.1016/s0022-510x(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Chroni, E., Tendero, I. S., Punga, A. R., and Stålberg, E. (2012). Usefulness of assessing repeater F-waves in routine studies. Muscle Nerve 45, 477-485. doi: 10.1002/mus.22333
PubMed Abstract | CrossRef Full Text | Google Scholar
de Carvalho, M., Scotto, M., Lopes, A., and Swash, M. (2002). F-golven en de corticospinale laesie in amyotrofe laterale sclerose. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 3, 131-136. doi: 10.1080/146608202760834139
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Kovach, I., and Groozman, G. B. (2001). Electrophysiologic evaluation of upper motor neuron involvement in amyotrophic lateral sclerosis. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 2, 147-152. doi: 10.1080/146608201753275616
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Neufeld, M. Y., and Korczyn, A. D. (1993). F-wave characteristics following acute and chronic upper motor neuron leisions. Electromyogr. Clin. Neurophysiol. 33, 441-446.
PubMed Abstract | Google Scholar
Fang, J., Cui, L.-Y., Liu, M.-S., Guan, Y.-Z., Li, X.-G., Cui, B., et al. (2015). F-golf studie in amyotrofe laterale sclerose: beoordeling van segmentale motoneuronale disfunctie. Chin. Med. J. 128, 1738-1742. doi: 10.4103/0366-6999.159346
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A. (1992). H-reflexen en F-golven: fysiologie en klinische indicaties. Muscle Nerve 15, 1223-1233. doi: 10.1002/mus.880151102
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A., Hoffen, B., and Hultman, C. (1994). Normative F-wave values and the number of recorded F-waves. Muscle Nerve 17, 1185-1189. doi: 10.1002/mus.880171009
PubMed Abstract | CrossRef Full Text | Google Scholar
Gooch, C. L., Doherty, T. J., Chan, K. M., Bromberg, M. B., Lewis, R. A., Stashuk, D. W., et al. (2014). Motor unit number estimation: a technology and literature review. Muscle Nerve 50, 884-893. doi: 10.1002/mus.24442
PubMed Abstract | CrossRef Full Text | Google Scholar
Hachisuka, A., Komori, T., Abe, T., and Hachisuka, K. (2015). Repeater F-golven zijn tekenen van motor unit pathologie in polio overlevenden. Muscle Nerve 51, 680-685. doi: 10.1002/mus.24428
PubMed Abstract | CrossRef Full Text | Google Scholar
Ibrahim, I. K., and el-Abd, M. A. (1997). Reusachtige repeater F-golf bij patiënten met anterieure hoorncelstoornissen. Rol van de grootte van de motor unit. Am. J. Phys. Med. Rehabil. 76, 281-287. doi: 10.1097/00002060-199707000-00006
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J.-E., Hong, Y.-H., Lee, J.-H., Ahn, S.-W., Kim, S.-M., Park, K.-S., et al. (2015). Patroonverschil van gedissemineerde handspieratrofie in amyotrofische laterale sclerose en varianten. Muscle Nerve 51, 333-337. doi: 10.1002/mus.24323
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Mizobuchi, K., Ogawara, K., and Hattori, T. (1999). Dissociated small hand muscle involvement in amyotrophic lateral sclerosis detected by motor unit number estimates. Muscle Nerve 22, 870-873. doi: 10.1002/(sici)1097-4598(199907)22:7<870::aid-mus9>3.0.co;2-o
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Sonoo, M., Komori, T., Shimizu, T., Hirashima, F., Inaba, A., et al. (2008). Dissociated small hand muscle atrophy in amyotrophic lateral sclerosis: frequency, extent and specificity. Muscle Nerve 37, 426-430. doi: 10.1002/mus.20949
PubMed Abstract | CrossRef Full Text | Google Scholar
Macdonell, R. A. L., Jackson, G. D., Curatolo, J. M., Abbott, D. F., Berkovic, S. F., Carey, L. M., et al. (1999). Lokalisatie van de motorische cortex met behulp van functionele MRI en transcraniële magnetische stimulatie. Neurology 53, 1462-1467. doi: 10.1212/wnl.53.7.1462
PubMed Abstract | CrossRef Full Text | Google Scholar
Menon, P., Kiernan, M. C., and Vucic, S. (2014). Corticale excitabiliteitsverschillen in handspieren volgen een split-hand patroon bij gezonde controles. Muscle Nerve 49, 836-844. doi: 10.1002/mus.24072
PubMed Abstract | CrossRef Full Text | Google Scholar
Milanov, I. G. (1992). F-golf voor de beoordeling van de exciteerbaarheid van segmentale motoneuronen. Electromyogr. Clin. Neurophysiol. 32, 11-15.
PubMed Abstract | Google Scholar
Pastore-Olmedo, C., Gonzáez, O., and Geijo-Barrientosc, E. (2009). Een studie van F-golven bij patiënten met unilaterale lumbosacrale radiculopathie. Eur. J. Neurol. 16, 1233-1239. doi: 10.1111/j.1468-1331.2009.02764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Peioglou-Harmoussi, S., Fawcett, P. R. W., Howel, D., and Barwick, D. D. (1987). F-respons frequentie in motor neuron disease en cervicale spondylose. J. Neurol. Neurosurg. Psychiatry 50, 593-599. doi: 10.1136/jnnp.50.5.593
PubMed Abstract | CrossRef Full Text | Google Scholar
Petajan, J. H. (1985). F-golven in neurogene atrofie. Muscle Nerve 8, 690-696. doi: 10.1002/mus.880080811
PubMed Abstract | CrossRef Full Text | Google Scholar
Puksa, L., Stålberg, E., and Falck, B. (2003). Het voorkomen van A-golven in F-golf studies van gezonde zenuwen. Muscle Nerve 28, 626-629. doi: 10.1002/mus.10448
PubMed Abstract |Ref Full Text | Google Scholar
Ramírez-Jarquín, U. N., Lazo-Gómez, R., Tovar-y-Romo, L. B., and Tapia, R. (2014). Spinale remmende circuits en hun rol in motor neuron degeneratie. Neuropharmacology 82, 101-107. doi: 10.1016/j.neuropharm.2013.10.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Roche, J. C., Rojas-Garcia, R., Scott, K. M., Scotton, W., Ellis, C. E., Burman, R., et al. (2012). A proposed staging system for amyotrophic lateral sclerosis. Brain 135, 847-852. doi: 10.1093/brain/awr351
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, H. H., and Stalberg, E. (1978). F responses studied with single fibre EMG in normal subjects and spastic patients. J. Neurol. Neurosurg. Psychiatry 41, 45-53. doi: 10.1136/jnnp.41.1.45
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibuya, K., Misawa, S., Nasu, S., Sekiguchi, Y., Mitsuma, S., Beppu, M., et al. (2013). Split hand syndrome in amyotrofe laterale sclerose: verschillende exciteerbaarheidsveranderingen in de thenar en hypothenar motor axonen. J. Neurol. Neurosurg. Psychiatry 84, 969-972. doi: 10.1136/jnnp-2012-304109
PubMed Abstract | CrossRef Full Text | Google Scholar
Turner, M. R., and Kiernan, M. C. (2012). Draagt interneuronale disfunctie bij aan neurodegeneratie in amyotrofe laterale sclerose. Amyotroph. Lateral Scler. 13, 245-250. doi: 10.3109/17482968.2011.636050
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dijk, J. P., Schelhaas, H. J., Van Schaik, I. N., Janssen, H. M. H. A., Stegeman, D. F., and Zwarts, M. J. (2010). Monitoring disease progression using high-density motor unit number estimation in amyotrophic lateral sclerosis. Muscle Nerve 42, 239-244. doi: 10.1002/mus.21680
PubMed Abstract | CrossRef Full Text | Google Scholar
Vucic, S., and Kiernan, M. C. (2010). Upregulatie van persisterende natriumgeleiders in familiaire ALS. J. Neurol. Neurosurg. Psychiatry 81, 222-227. doi: 10.1136/jnnp.2009.183079
PubMed Abstract | CrossRef Full Text | Google Scholar
Weber, M., Eisen, A., Stewart, H., and Hirota, N. (2000). De gespleten hand bij ALS heeft een corticale basis. J. Neurol. Sci. 180, 66-70. doi: 10.1016/s0022-510x(00)00430-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilbourn, A. J. (2000). Het gespleten hand syndroom. Muscle Nerve 23:138. doi: 10.1002/(sici)1097-4598(200001)23:1<138::aid-mus22>3.0.co;2-7
PubMed Abstract | CrossRef Full Text | Google Scholar