Dit is een kort overzicht van de informatie met betrekking tot de goedkeuring van de FDA om dit product op de markt te brengen. Zie de links hieronder naar de samenvatting van de veiligheids- en doeltreffendheidsgegevens (SSED) en de productetikettering voor meer volledige informatie over dit product, de indicaties voor gebruik en de basis voor de goedkeuring door de FDA.
Productnaam: Axonics Sacraal Neuromodulatiesysteem
PMA Aanvrager: Axonics Modulation Technologies, Inc.
Adres: 26 Technology Drive, Irvine, CA 92618
Goedkeuringsdatum: November 13, 2019
Goedkeuringsbrief: Approval Order
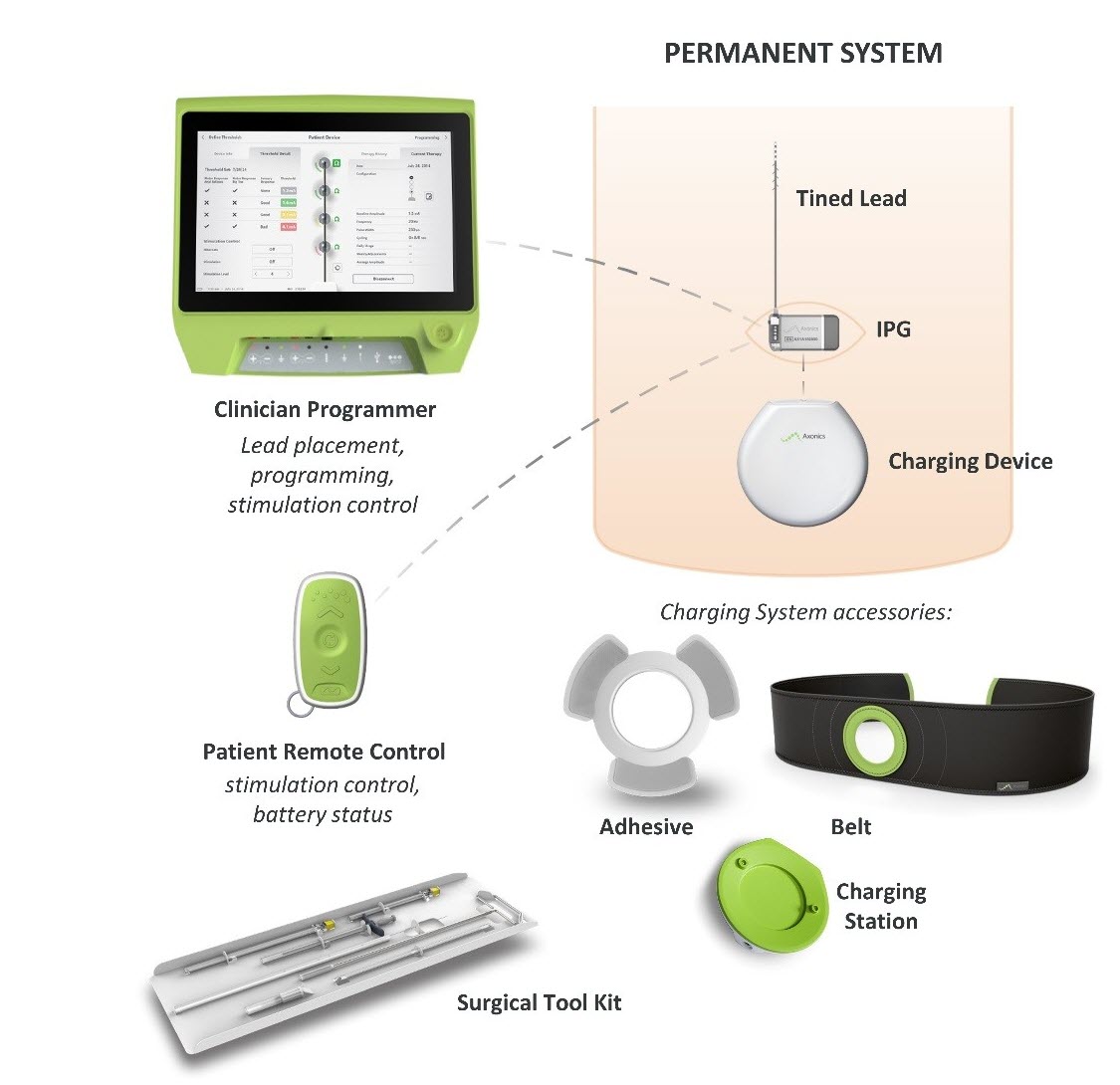
Wat is het? Het Axonics Sacrale Neuromodulatie (SNM) Systeem is een sacrale zenuwstimulatie (SNS) systeem dat bedoeld is voor de behandeling van urineretentie en de symptomen van een overactieve blaas. Het maakt gebruik van een geïmplanteerde stimulator die elektrische impulsen afgeeft via een afleidingsdraad aan elektroden die zich in de buurt van de nervus sacralis bevinden.
Hoe werkt het? Een implanteerbare pulsgenerator (IPG) wordt operatief onder de huid in de bovenbilstreek geplaatst en bevestigd aan een afleidingsdraad die tussen de heupbeenderen van het bekken doorgaat en eindigt bij de sacrale zenuw. De IPG zendt elektrische impulsen via de afleidingsdraad naar de sacrale zenuw die van het ruggenmerg naar de blaas loopt om de urinecontrole te helpen verbeteren.
Wanneer wordt het gebruikt? Het Axonics SNM-systeem voor urinecontrole wordt gebruikt voor de behandeling van urineretentie en de symptomen van een overactieve blaas bij patiënten bij wie andere behandelingen, zoals verandering van levensstijl, bekkenbodemoefeningen of medicatie, niet zijn gelukt of niet worden verdragen. Indien onbehandeld, kunnen urineretentie en een overactieve blaas de kwaliteit van leven van een patiënt verminderen en resulteren in aanzienlijke uitdagingen bij het handhaven van activiteiten van het dagelijks leven.
Wat zal het bereiken? De resultaten van een klinische studie van het Axonics SNM-systeem in combinatie met aanvullende klinische gegevens uit een systematisch literatuuroverzicht van een vergelijkbaar SNM-apparaat tonen aan dat de meeste patiënten met urineretentie en de symptomen van een overactieve blaas, die andere behandelingen niet hebben kunnen verdragen of niet hebben kunnen verdragen, er baat bij hebben. In het klinisch onderzoek van Axonics bij patiënten met aandrangincontinentie bereikte 90% (116/129) van de patiënten met het geïmplanteerde SNM-systeem na 6 maanden een vermindering van het aantal urineverlies met ten minste 50% ten opzichte van het aantal urineverliesgevallen zonder het SNM-systeem. In een langer lopende studie (van Kerrebroeck, 2007) werden 152 patiënten bij wie een soortgelijk SNM-systeem was geïmplanteerd, gedurende 5 jaar gevolgd. Na 5 jaar had 58% (56/96) van de patiënten met aandrangincontinentie ten minste een verbetering van 50% (gemeten in termen van het aantal urineverlies per dag). Bovendien had na 5 jaar 40% (10/25) van de patiënten met urgentie-frequentie ten minste een verbetering van 50% (gemeten in termen van het aantal urinelozingen per dag), en had 58% (18/31) van de patiënten met urineretentie ten minste een verbetering van 50% (gemeten in termen van het aantal katheterisaties per dag). Gezien de overeenkomsten in ontwerp, technologie, prestaties, indicaties voor gebruik, uitvoerkarakteristieken en de patiëntenpopulatie die het moet behandelen, is de FDA van mening dat het Axonics SNM-systeem vergelijkbare prestaties zal leveren als het in de handel verkrijgbare SNM-systeem dat in de gepubliceerde studies is geëvalueerd.
Wanneer mag het niet worden gebruikt? Het Axonics SNM-systeem mag niet worden gebruikt bij:
- Patiënten die geen adequate respons op de teststimulatie hebben laten zien; of
- Patiënten die niet in staat zijn om het Axonics SNM-systeem te bedienen
Aanvullende informatie (inclusief waarschuwingen, voorzorgsmaatregelen en ongewenste voorvallen):
- Samenvatting van gegevens over veiligheid en doeltreffendheid
- Patiëntetikettering
- Physician Labeling
- PMA Database Entry