Förord
Denna artikel ger en personlig vision av vad som kan behövas för att fagterapi äntligen ska slå igenom som ett vanligt antibakteriellt verktyg. Den påverkas av historiska och nyligen inträffade misslyckanden och osäkerheter inom området för fagterapi och syftar till att hitta lösningar baserade på framtida och framväxande teknik som är tänkt att modellera morgondagens vetenskap och samhälle.
Fagterapi
Bakteriofager (fager) är bakteriers virus. Sedan urminnes tider har de kontrollerat tillväxten och spridningen av sina bakteriella värdar. Bakterievirus är de mest allestädes närvarande levande enheterna i vår biosfär. Det finns uppskattningsvis 10 miljoner gånger fler virus i haven än det finns stjärnor i universum och om alla virus på jorden staplades på varandra skulle detta torn sträcka sig längre än de närmaste 60 galaxerna (Suttle, 2013). De kan lätt hittas överallt där bakterier trivs: i avlopp, floder eller patienters urin och avföring. Fager från bakteriella patogener från människor består oftast av ett isosaedriskt huvud, en sfär med 20 platta ytor som består av proteiner och innehåller ett nukleinsyragenom, till vilket en proteinsvans är fäst. När en strikt lytisk fage fäster med sina svansfibrer och spikar på ytan av sin målbakterie drar den sprutliknande svansskidan ihop sig och svanskärnan drivs genom bakteriens cellvägg och injicerar faggenomet i bakteriecellens periplasma. Genast kapas bakteriens DNA- och proteinsyntesmaskineri för att bygga kopior av fagen. Vissa fager skär bakteriens DNA i bitar. Efter en latent period på minuter till timmar sprängs de nybildade fagen ut ur sina bakteriella värdar, som dödas i processen. Fagernas avkomma, som kan uppgå till hundratals per bakterie, går sedan iväg för att hitta nya värdbakterier att infektera. Fager kan därför betraktas som självreproducerande antimikrobiella medel. Viktigt är att fager har utvecklats för att endast infektera vissa målbakterier och är ofarliga för däggdjursceller.
Första bevis på virusliknande agens med antibakteriell aktivitet rapporterades av den engelske bakteriologen Frederick Twort och av den fransk-kanadensiske mikrobiologen Felix d’Hérelle 1915 respektive 1917 (Sulakvelidze et al., 2001). År 1919 utnyttjade d’Hérelle för första gången fagernas terapeutiska potential när han använde dem för att bota en pojke som led av dysenteri i Paris. Fagterapi erkändes omedelbart som ett terapeutiskt tillvägagångssätt för att behandla bakterieinfektioner och kommersialisering av preparat för fagterapi genomfördes av flera företag, t.ex. L’Oréal i Europa och Eli Lilly Company i USA (Sulakvelidze et al., 2001). År 1923 grundade den georgiske mikrobiologen Giorgi Eliava Eliava Institute i Tbilisi, Georgien, som ägnade sig åt forskning om fagterapi. Det var starten på en omfattande forskning och utveckling av fagterapi i f.d. Sovjetunionen. De tidiga användningarna av fagterapi var dock ofta opålitliga och forskning om antibiotika hade också pågått. Den framgångsrika användningen av penicillin under andra världskriget och dess efterföljande världsomspännande marknadsföring ledde till att västerländska forskare tappade intresset för fagterapi. Sovjetiska forskare fortsatte däremot att utveckla fagterapi och publicera sina resultat, men på grund av järnridån spreds deras kunskaper och erfarenheter inte över världen (Sulakvelidze et al., 2001). I början av det tredje årtusendet väckte den ökande hälsobördan av infektioner med antibiotikaresistenta bakterier (Cassini et al., 2019) ett förnyat världsomspännande intresse för fagterapi som ett livskraftigt ytterligare verktyg för den kliniska hanteringen av bakterieinfektioner (Thiel, 2004). Över hela världen inrättas centra för fagterapi som följer i fotspåren av Eliava-institutet och fagterapienheten vid Hirszfeld-institutet i Wrocław, Polen (Miêdzybrodzki et al, 2012).
Året 2035
Fast forward till den framtida jorden år 2035, en dyster värld som kännetecknas av mänsklig överbefolkning, stora störningar i ekosystemen, global uppvärmning och främlingsfientlighet.
När han badade i sitt bad kände Dr. John Iverian, en pensionerad mikrobiolog, plötsligt ett extremt smärtsamt stick i nacken, följt av ett ljud som liknade en propeller från ett litet flygplan. Han screenade omgivningen och i ögonvrån såg han en konstig stor insekt med långa läskiga ben och antenner sitta på väggen bredvid hans designade badkar. Osuri, hemförvaltningssystemet i Iverians loft i centrala Antwerpen, identifierade insekten som den brunmarmorerade stinkbuggen Halyomorpha halys, som hade spridit sig över hela världen. Osuris rapport, som projicerades på en av badrummets videoskärmar, nämnde att människor som blev bitna till en början fick ett litet rött sår i bettområdet på huden. När bettsåret lämnades obevakat svullnade det upp och producerade vätska. Trött och lurig klev den nonchalanta Iverian ut ur sitt bad och gick till sängs. Han hade bestämt sig för att inte utföra den utstuderade sårbehandlingsproceduren, som Osuri starkt hade rekommenderat. Tidigt nästa morgon hade dock bettet förvandlats till ett nekrotiskt sår som visade tydliga tecken på infektion.
Angstigt aktiverade Iverian sin Phage-BEAM-enhet. BEAM stod för “Bedside Energized Anti-Microbial”. Apparaten hade storleken och formen av en skokartong, men med ett mer elegant och polerat utseende. Apparatens namn och dess tillverkare var utformade med färgglada bokstäver på sidan av den sömlösa vita emaljerade lådan. Iverian tog ut en svabb ur sin sterila förpackning och förde den försiktigt över hela sårområdet, och såg till att sårexsudatet fuktade svabbens bomullsspets ordentligt. När svabben närmade sig området “insätt prov” på lådan öppnades en liten dörr som genom ett trollslag och frigjorde ett 10 tum högt hologram av en laboratorietekniker som hette Marcia. Hon visade Iverian var provet skulle läggas. Marcia utvecklades för att vägleda kunderna genom testförfarandet. “För bästa resultat, sätt in en ny fage-biotryckspatron, dr Iverian”, sade Marcia. Precis som det brukade vara för gårdagens 2D-skrivare var kostnaden för biotryckspatronerna nästan lika hög som kostnaden för själva Phage-BEAM-enheten. Enligt “Business Insider” var fage-bio-bläck den näst dyraste vätskan på jorden, efter Chanel No. 8. Som tur var hade Iverian, som en av uppfinnarna, fått rätten att alltid ha den senaste versionen av denna apparat till sitt förfogande, inklusive ett kontinuerligt utbud av reagens, gratis.
Iverian visste helt och hållet hur apparaten fungerade, så han behövde inte Marcias hjälp. Först extraherades DNA från svabbspetsen och metagenomet – allt genetiskt material som fanns i provet, inklusive de infekterande bakterierna – bestämdes. Därefter skickades dessa genetiska data till en säker “Phage XChange”-server där en komplex AI-driven algoritm förutspådde genomsekvensen för den fage som med största sannolikhet skulle lysa de infekterande bakterier som identifierats i metagenomet och som skulle framkalla den svagaste immunreaktionen hos patienten. Faggenomdata skickades till Phage-BEAM-enheten, som först syntetiserade faggenomet och sedan faggen med hjälp av ett patenterat bakteriefritt fagproduktionssystem.
Inom en timme efter provtagning skulle enheten producera en färdig terapeutisk fagprodukt som var redo att användas. Resultaten av den stegvisa proceduren skulle överföras till den enorma hemvideoskärmen i Iverians vardagsrum. Iverian satt i sin LC2-fåtölj och lyssnade på Mozarts stora mässa i c-moll och väntade med spänning på att resultaten skulle komma in. Han hade en dålig känsla inför detta. Resultatet gav Iverian rysningar längs ryggraden. Bakteriell patogen identifierad: Streptococcus pyogenes stam FE-2033! Osuri aktiverade omedelbart protokollet för infektionsvarning, skickade ett meddelande till World Center for Disease Control och projicerade oroande bakgrundsinformation om den dödliga köttätande bakteriestammen, som ansågs vara ett överhängande hot mot folkhälsan sedan 2033. För ett ögonblick övervägde Iverian att skära upp det infekterade såret och en del av den omgivande friska vävnaden med en kökskniv, men han lugnade ner sig och bestämde sig för att vänta och applicera den förestående Phage-BEAM-produkten. En timme senare hade Phage-BEAM-apparaten producerat syntetiska fager. Dessa fager blandades sedan med de isolerade bakterierna i en valideringsmodul för att testa deras effektivitet in vitro. Femton minuter senare gavs grönt ljus för Iverian att påbörja behandlingen. Iverian applicerade fagerna i ett hydrogelbaserat sårförband med långsam frisättning, som först hade blandats med den koncentrerade fagsuspension som producerats av Phage-BEAM-enheten och som också innehöll synergistiska antibiotika. Hydrogelen lindrade tillfälligt smärtan, vilket ytterligare lugnade honom. Iverian upprepade appliceringen av den fage- och antibiotikaladdade hydrogelen en gång om dagen. Sårinfektionen förbättrades inom 24 timmar och efter 7 dagar var såret nästan helt läkt. Iverians potentiellt livshotande infektion behandlades framgångsrikt, i rätt tid och utan att han behövde lämna sitt hem. Men under många tidigare decennier hade det inte varit säkert att fagterapi skulle slå igenom och bli ett brett tillämpat och kliniskt användbart antibakteriellt verktyg. Det hade tagit ett tag för den medicinska världen att inse att fagterapi inte behövde vara identisk med antibiotikabehandling, och detta främst på grund av särdragen hos de aktiva agenserna, fagerna.
Några relevanta särdrag hos fager
Fager uppvisar ett antal egenskaper som skiljer sig från antibiotika och som har försvårat deras utveckling som farmaceutiska produkter och deras tillämpning i terapi. För det första tenderar de att vara specifika när det gäller vilka bakterier de infekterar. De kommer i bästa fall att angripa en betydande del av en enda bakterieart, men i värsta fall kommer de att infektera endast ett litet antal stammar inom en art. Terapeutiska fager kan därför väljas så att de huvudsakligen dödar en bakterieart, eller en kliniskt relevant undergrupp av denna, och skonar patientens nyttiga bakterier (t.ex. tarm-, hud- eller munfloran). De flesta rutinmässigt använda antibiotika har däremot ett brett spektrum av aktivitet, vilket kan orsaka “kollateral skada” på patientens gemensamma mikrobiom, vilket i sin tur kan leda till negativa effekter, t.ex. urval av antibiotikaresistenta bakteriearter (t.ex. Clostridium difficile) eller antibiotikaassocierad diarré (Jernberg et al., 2010). Nackdelen med fagspecificitet är att de infekterande bakterierna måste identifieras innan man påbörjar fagterapi. Vid empirisk antibiotikabehandling används däremot vanligtvis bredspektrumantibiotikacocktails som påverkar en mängd grampositiva och gramnegativa bakterier och olika svampar. När mer information är känd (t.ex. från bakteriekultur) kan behandlingen bestå av smalspektrumantibiotika som mer specifikt riktar sig mot de bakterier eller svampar som identifierats som sjukdomsorsakande.
För det andra är bakterier och fager involverade i ett värd-parasitförhållande. Strikt lytiska fager är allestädes närvarande i miljön och kräver att deras bakteriella värd dör för att slutföra sin livscykel. Utan värdar kan fager inte existera. Fagerna selekterar resistenta värddjur, som i sin tur selekterar effektiva fager. Detta resulterar i vad som kallas “antagonistisk samevolution”, en kapprustning mellan bakterier och fager, som kännetecknas av en ömsesidig utveckling av bakteriernas resistens och fagernas infektionsförmåga (Buckling och Rainey, 2002). Precis som med de flesta antimikrobiella medel kommer bakterier således också att bli resistenta mot fager (Luria och Delbrück, 1943; Schooley et al., 2017), men i motsats till statiska antibiotika har fager förmågan att övervinna bakteriell resistens (Buckling och Rainey, 2002). Det finns dock indikationer på att bakterier och fager inte kommer att öka sin respektive resistens och infektionsförmåga i all oändlighet (Fortuna et al., 2019).
Fagterapiförfaranden
När fagterapin fick nytt liv i början av 2000-talet hade två olika fagterapiförfaranden utvecklats (Pirnay et al., 2011). I vad som skulle kunna kallas den enhetliga metoden tillämpades definierade fagecocktails med brett spektrum, som skulle rikta sig mot majoriteten av de bakterier som misstänktes orsaka vissa infektionssjukdomar. Dessa fördefinierade fagcocktails med brett spektrum utvecklades, producerades och testades inom ramen för de nuvarande farmakoekonomiska modellerna, som hade utformats för att tillgodose “statiska” läkemedel som t.ex. antibiotika. Verkligt bredspektriga fagecocktails som är aktiva mot de flesta grampositiva och/eller gramnegativa bakterier som ofta förekommer vid infektionssjukdomar måste dock innehålla stora mängder fager, vilket visade sig vara mycket svårt att utveckla. Det var möjligt att utveckla fagecocktails med ett smalare spektrum som är aktiva mot en eller ett fåtal bakteriearter och som kan användas vid vissa indikationer, förutsatt att de infekterande bakteriearterna är kända i förväg. För vissa bakteriearter, t.ex. Staphylococcus aureus, har fager med ett exceptionellt brett värdområde isolerats och karakteriserats (Vandersteegen et al., 2011). I PhagoBurn, en randomiserad kontrollerad studie, var framgången när det gällde att uppnå en hållbar minskning av Pseudomonas aeruginosas belastning i brännskadade sår kopplad till den initiala känsligheten för fagcocktailen (Jault et al., 2019). En tredjedel av de inkluderade patienterna visade sig dock hysa redan existerande P. aeruginosa-stammar som var resistenta mot fagcocktailen, som bestod av inte mindre än 12 lytiska P. aeruginosa-fager. Dessutom behövde de fagecocktails som ursprungligen utformades för att vara effektiva regelbundet uppdateras (t.ex. kompletteras med nya fager) som svar på uppkomsten av fagerresistens eller inblandning av nya cirkulerande kliniskt relevanta stammar. Slutligen visste man inte om det faktum att bakterier konfronteras med höga koncentrationer av fasta fagcocktails skulle leda till att bakteriell fagresistens skulle uppstå, spridas och kvarstå på sjukhusen och i miljön, i likhet med vad som hade hänt vid den massiva användningen av antibiotika.
I konceptet för personlig fagterapi valdes en eller flera fager ut från en fagbank eller från miljön och anpassades eventuellt (in vitro-urval av fagmutanter som uppvisar ökad infektionsförmåga) för att mer effektivt infektera de bakterier som isolerats från patientens infektionsställe (Friman et al, 2016). Vissa centra för fagterapi inrättade och upprätthöll stora terapeutiska fagbanker, som regelbundet uppdaterades med nya fager, vilket breddade och anpassade bankens värdområde till de ständigt föränderliga bakteriepopulationerna. Personliga metoder för fagterapi var potentiellt mer hållbara, eftersom endast den infekterande bakterien är måltavla, vilket resulterar i mindre selektionstryck mot bakteriell fagresistens. De var dock också mer utarbetade och logistiskt komplexa än de metoder som är avsedda att passa alla, med bakteriestammar och matchande fager som skickades över hela världen (figur 1). Dessutom var precisionsmedicinska koncept i allmänhet inte kompatibla med de flesta utvecklings- och licensieringsvägar för läkemedel (läkemedel i USA), som krävde flera år och miljontals euro (dollar) för att slutföra, och detta för varje fage i banken (Verbeken et al., 2012).
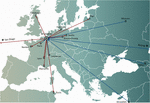
Figur 1. Internationella överföringar av fager från (röda pilar) och till (blå pilar) Drottning Astrids militärsjukhus (QAMH) i Bryssel med tanke på kliniska tillämpningar under perioden 2015-2020. På nationell nivå skickades fager från QAMH till fem universitetssjukhus (visas inte). Dessutom omfattade valet av matchande fager ofta överföring av patienternas bakterieisolat, och fem internationella patienter (två från Frankrike, två från Nederländerna och en från Tunisien) överfördes till Bryssel för fagterapi.
Enter Synthetic Biology
Med början av det tredje årtusendet hade metoder inom den syntetiska biologin utvecklats i allt större utsträckning för att minska fagernas specificitet och uppkomsten av bakteriell fagresistens (t.ex, strukturstyrd design) (Pires et al., 2016; Dunne et al., 2019). Till exempel utarbetades jästbaserade plattformar för byte av fagenas svansfiberprotein för att konstruera hybridfager med ett mer förutsägbart och utökat värdområde (Ando et al., 2015; Yosef et al., 2017) och gentekniska strategier (t.ex, CRISPR-Cas-redigeringsverktyg) utvecklades för att ta itu med andra aspekter, t.ex. negativa interaktioner mellan patient och fager (t.ex. immunsvar mot fager) (Brown et al., 2017), den potentiella uppkomsten och spridningen av resistensmekanismer för bakteriella fager och frigörandet av skadligt bakterieinnehåll som endotoxiner (Hwang et al., 2018). Syntetiska faggenom behövde startas om för att producera avkommor av fager (Barbu et al., 2016; Pires et al., 2016), genom transformation av Escherichia coli eller Listeria monocytogenes L-former (Kilcher et al., 2018) eller med hjälp av cellfria transkriptions-translationssystem (TXTL) (Rustad et al., 2018). De västerländska regelverken hade gradvis börjat tillgodose precisions- och personaliserade metoder för fagterapi med hjälp av naturligt förekommande fager (Pirnay et al., 2018), konstruerade fager (Dedrick et al., 2019) och syntetiska fager.
Utvecklingen av ad hoc och på plats tillverkningsanordningar för terapeutisk fagterapi, såsom Phage-BEAM, gick inte smidigt, påminde Iverian. Till att börja med krävdes det artificiell intelligens (AI)-baserad in silico-matchning och design av fager. Djupinlärning (Martorell-Marugán et al., 2019), en delmängd av maskininlärning, valdes för att söka efter kopplingar mellan bakteriegenom och infekterande faggenom, eftersom det var lättare att skala till ett större antal prover. Djupinlärningsmetoderna krävde till exempel inte så kallad feature extraktion, vilket skulle kräva annotering på gen-/proteinnivå av fag- och bakteriegenom och skulle begränsa förutsägelserna till vissa kända relationer mellan bakterie- och fagegenskaper, till exempel fagens svansfiberstrukturer som binder till specifika bakteriella cellväggsreceptorer. En nackdel är att den måste drivas av en kontinuerlig tillförsel av enorma datamängder som kopplar samman lytiska faggenom med värdbakteriegenom, och det är där skon klämde. Sekvensering av hela genomet hade långsamt sipprat in i den kliniska mikrobiologins praktik (American Academy of Microbiology, 2016), men forskningsinstitut och läkemedelsföretag var inte angelägna om att lämna in sina data till en enda centraliserad databas, och inga investerare hittades som var villiga och kapabla att förvärva de tillgängliga data och/eller att producera tillräckliga mängder nya data. Ett andra hinder som måste övervinnas var att det inte fanns tillgång till snabb, tillförlitlig och prisvärd syntes av stora DNA-molekyler. De första DNA-syntesmetoderna var baserade på organisk kemi och producerade relativt små DNA-molekyler. De novo-syntesen av faggenom krävde att man samlade ihop flera genomfragment (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) i jästen Saccharomyces cerevisiae, med hjälp av konstgjorda kromosomer från jäst (Ando et al., 2015) eller kemisk sammansättning (Gibson et al., 2009). Utvecklingen av en ny teknik för att syntetisera DNA, baserad på DNA-syntetiserande enzymer som finns i celler i immunsystemet (Palluk et al., 2018), underlättade syntesen av faggenom. Slutligen måste vissa hinder övervinnas för att utveckla generiska cellfria system för produktion av fager som kan producera fager i höga titrar och som uppvisar samma nivåer av bakteriell infektionsförmåga som deras naturliga analoger.
Genombrottet
Det stora problemet var att det visade sig vara mycket svårt att samla in de massiva mängder länkade fager- och bakteriegenomsekvenser som är nödvändiga för att AI-algoritmerna för djupinlärning ska kunna förutsäga och/eller designa fagersekvenser med en terapeutiskt godtagbar noggrannhetsnivå. Iverian mindes att det verkliga genombrottet kom när den ideella organisationen “Phage XChange” lanserade sin globala plattform med samma namn för styrning av fager för att skapa en effektiv, standardiserad, hållbar och etisk försörjningskedja för fager (figur 2). Phage XChange bestod huvudsakligen av en AI-modul och en distribuerad huvudbok (DL) (Thiebes et al., 2020). Plattformens AI-modul analyserade länkade fager- och bakteriegenom för att förutsäga och utforma potenta fager för kunderna. Den förutspådde också vilka bakteriella patogener som behövde den mest brådskande uppmärksamheten, baserat på sakernas internet (IoT) och Big Data samt information från internationella folkhälsoorganisationer, t.ex. världshälsoorganisationen (WHO) och nationella centra för sjukdomsbekämpning (Centers for Disease Control). Dessa uppgifter styrde systemet mot isolering och karakterisering av de mest brådskande fagerna.
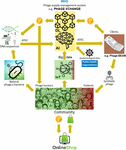
Figur 2. Vision av hur fagerförsörjningskedjan kan vara organiserad år 2035. AI, artificiell intelligens; ATGC, DNA-sekvens; BEAM, bedside energized anti-microbial; DL, distributed ledger; IoT, Internet of Things; P, PhageCoin; WHO, World Health Organization.
Plattformens DL-modul säkerställde en tillräcklig, kvalitativ och registrerad inmatning av länkade fager/bakteriegenomsekvenser till AI-modulen och dito leverans av fagsekvenser till kunderna, i enlighet med bestämmelserna i Nagoya-protokollet (Expert round table on acceptance and re-implementation of bacteriophage therapy et al, 2018). DL registrerade på ett oföränderligt sätt alla uppgifter om intressenter (t.ex. leverantörer av data, sekvenseringstjänster och kunder), transaktioner och kontrakt. Den registrerade också den exakta kvaliteten, specifikationerna och vikten av det levererade materialet. En algoritm fastställde att materialet inte var redundant och uppskattade vikten (t.ex. fagernas virulens och värdområde) och önskvärdheten hos det inlämnade materialet. Fager som är inriktade på nya bakteriella patogener var naturligtvis mest eftertraktade. De flesta patentfrågorna kunde undvikas. DL fungerade som betalningsbok för att se till att alla parter fick betalt i tid och på ett rättvist sätt. Ett antal PhageCoins (plattformens kryptovaluta) tilldelades leverantörerna i förhållande till det inlämnade materialets kvalitet, vikt och önskvärdhet. Kunder som extraherade prediktionsresultat (fagersekvenser) genom DL betalade ett antal PhageCoins som stod i proportion till det uppskattade värdet av fagerna. Dessa PhageCoins användes för att upprätthålla DL, för att säkerställa ett tillräckligt och kontinuerligt inflöde av material och för att utöka data om fags virulens och värdområde (för att matcha fager med bakterier). En ytterligare injektion av medel och incitament för att leverera material hittades hos producenter och leverantörer av alla typer av varor. Med de omedelbart intjänade PhageCoins kunde fagerleverantörerna köpa alla typer av produkter online till kraftigt reducerade priser, från laboratorie- och skolutrustning till sportartiklar. Dessa varor tillhandahölls genom företagssponsring. Flera etablerade företag sponsrade PhageXchange i utbyte mot skattelättnader, publicitet och bilden av ett socialt ansvarstagande varumärke. Vikten av det levererade materialet, och därmed också dess värde, undervärderades till en början, men omvärderades med jämna mellanrum (iteration) och leverantörerna tilldelades fler PhageCoins när det var motiverat. Även om plattformen var användbar från det ögonblick den infördes blev den riktigt framgångsrik först när den ställdes under WHO:s beskydd, i analogi med det världsomspännande systemet för spårbarhet, öppenhet, vaksamhet och övervakning av humanläkemedel (Warwick et al., 2013). Ett formellt avtal mellan Phage XChange och WHO ökade det internationella förtroendet för plattformens långsiktiga hållbarhet och skyddet mot oetiskt kommersiellt utnyttjande. Sökandet efter potenta terapeutiska fager blev snart en gemenskapsinsats som syftade till att lösa antibiotikaresistenskrisen, med oberoende “fagerjägare”, skolor, scoutgrupper, byar vid Amazonasflodens stränder etc., som isolerade och skickade in fager till Phage XChange, i utbyte mot PhageCoins. I anslutning till detta utvecklade olika företag och institutioner kringutrustning och tjänster, t.ex. kit för isolering av fager och plattformar för sekvensering och syntes av fager (t.ex. Phage-BEAM-apparaten). I väntan på dessa anordningar erbjöds mellanliggande lösningar, där själva fagen erhölls via DL.
Epilog
Denna syn på framtiden för fagterapi ger ett optimistiskt slut på antibiotikaresistenskrisen. Ad hoc- och platstillverkning av syntetiska fager, kopplad till ett globalt, gemenskapsbaserat system för hantering av fager, visade sig vara ett välkommet och prisvärt (för socialförsäkringssystemen) extra vapen i kampen mot antibiotikaresistenta bakterieinfektioner. Det var dock ingen magisk kula, utan ett synergistiskt komplement till etablerade antimikrobiella medel. Den omedelbara och cellfria produktionen av syntetiska fager, oavsett om de är designade eller inte, hade betydande fördelar jämfört med klassiskt producerade (i bakteriella värdar) naturliga fager:
(i) Det fanns inget behov av att upprätthålla fysiska terapeutiska fagerbanker och att skicka patientens bakterieisolat och de matchande terapeutiska fagerna över hela världen.
(ii) Syntetiska fager mot bakterier som orsakar eminenta hot mot folkhälsan, t.ex. 2011 års utbrott av E. coli O104:H4 i Tyskland (Merabishvili et al, 2012), eller bakterier som (misstänks) användas för bioterrorism (Joñczyk-Matysiak et al, 2014) skulle kunna produceras i tid på plats.
(iii) Fager mot bakterier som orsakar potentiellt dödliga sjukdomar, för vilka det inte fanns några icke-dödliga produktionsvärdsstammar tillgängliga och vars förökning tidigare krävde försiktighetsåtgärder för biosäkerhetsnivå 3 (bsl-3) i biokontainern, skulle kunna syntetiseras under bsl-1-förhållanden.
(iv) När inga fager kunde isoleras från provtagningsplatser, t.ex. på grund av att de bakteriella värdstammar som användes i isoleringsmetoderna inte var mottagliga för de önskade fagerna, kan (förutspådda) fagergenomsekvenser, extraherade från metagenomiska data (Reyes et al, 2010; Amgarten et al., 2018), kunde användas för att producera syntetiska fager.
(v) Syntetiska fagepreparat innehöll inga (eller mindre mängder av) molekyler som skulle kunna ha en negativ inverkan på patienterna (t.ex. endotoxiner).
(vi) Anordningar anpassades för att producera syntetiska fager under förlängda rymdresor och rymdkolonisering (Taylor och Sommer, 2005).
Det finns liten chans att dessa förutsägelser kommer att bli verklighet. Det är förmodligen alltför kortsiktigt att tro att en samhällsbaserad insats, som stöds av folkhälsoorganisationer och förvaltas av en global, hållbar och etisk plattform, skulle kunna vara kärnan i en lösning på den nuvarande världsomspännande antibiotikaresistenskrisen. Vissa delar av det föreslagna systemet, t.ex. cellfri produktion av syntetiska fager med hjälp av en sängutrustning, har en rimlig chans att förverkligas, medan andra delar, t.ex. företagssponsring, sannolikt kommer att förbli begränsade till science fiction. Man kan säga att jag är en drömmare, så väck mig gärna år 2035 för att konfrontera mig med verkligheten!
Författarbidrag
J-PP tänkte ut visionen och utarbetade manuskriptet.
Finansiering
Publikationskostnaderna täcktes av “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst”.
Intressekonflikter
Författaren förklarar att forskningen genomfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Den behandlande redaktören förklarade tidigare samförfattande med författaren.
Acknowledgments
Den personliga visionen, eller drömmen, som utvecklas i det här manuskriptet uppstod som ett resultat av interaktioner med många forskarkollegor under de senaste 15 åren. Det är omöjligt att nämna dem alla, men det skulle inte vara rättvist att ta alla krediter ensam. Därför bestämde jag mig för att erkänna några av dem här (i alfabetisk ordning), med risken – eller bättre, vissheten – att glömma några viktiga påverkare: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili, Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bossche, Mario Vaneechoutte, Gilbert Verbeken och Kilian Vogele.
American Academy of Microbiology (2016). Tillämpningar av klinisk mikrobiell nästa generationssekvensering: Report on an American Academy of Microbiology Colloquium Held in Washington, DC, in April 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P. P., da Silva, A. M. och Setubal, J. C. (2018). MARVEL, ett verktyg för prediktion av bakteriofagsekvenser i metagenomiska bins. Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J. och Loessner, M. J. (2018). Genusöverskridande omstart av skräddarsydda, syntetiska bakteriofaggenom i L-formiga bakterier. Proc. Natl. Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., and Lu, T. K. (2018). Fagebaserade tillämpningar inom syntetisk biologi. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., and Delbrück, M. (1943). Mutationer av bakterier från viruskänslighet till virusresistens. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine”, i Computational Biology, red. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019..ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). Urval och karakterisering av en terapeutisk kandidatbakteriofag som lyserar Escherichia coli O104:H4-stammen från 2011 års utbrott i Tyskland. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Kliniska aspekter av fagterapi. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., et al. (2018). De novo DNA-syntes med hjälp av polymeras-nukleotidkonjugat. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J. och Lu, T. K. (2016). Genetiskt manipulerade fager: en översyn av framstegen under det senaste decenniet. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). Fagterapiparadigmet: prêt-à-porter eller sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). Den magistrala fagen. Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossMed Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Virus i den fekala mikrobiotan hos monozygota tvillingar och deras mödrar. Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P. och Noireaux, V. (2018). Cellfri TXTL-syntes av infektiös bakteriofag T4 i en enda provrörsreaktion. Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Utveckling och användning av personliga bakteriofagbaserade terapeutiska cocktails för att behandla en patient med en spridd resistent Acinetobacter baumannii-infektion. Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z. och Morris, J. G. Jr. (2001). Bakteriofagterapi. Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Virus: att låsa upp den största biologiska mångfalden på jorden. Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., and Sommer, A. P. (2005). Mot en rationell behandling av bakterieinfektioner under längre rymdresor. Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B. och Sunyaev, A. (2020). Distribuerad huvudboksteknik inom genomik: en uppmaning till Europa. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). Gamla dogmer, nya knep – 21:a århundradets fagterapi. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Mikrobiologisk och molekylär bedömning av bakteriofagen ISP för bekämpning av Staphylococcus aureus. PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J.-P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Optimering av det europeiska regelverket för hållbar bakteriofagterapi inom humanmedicin. Arch. Immunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L. och Wang, H. (2013). Globalt konsekventa kodningssystem för medicinska produkter av mänskligt ursprung. Bull. Världshälsoorganisationen. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S. och Qimron, U. (2017). Utvidgning av värdområdet för bakteriofagpartiklar för DNA-transduktion. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar