
La précipitation du carbonate de calcium (chaux) est un problème de colmatage courant dans les systèmes de micro-irrigation. L’eau avec un pH de 7,5 ou plus et un niveau de bicarbonate d’au moins 2 meq/l (120 ppm) est susceptible de précipiter du carbonate de calcium si des niveaux comparables de calcium sont présents naturellement dans le système ou si un composé qui contient du calcium est injecté dans le système.
Causes de la précipitation du carbonate de calcium
Le degré auquel le carbonate de calcium se produit dans l’eau à la pression atmosphérique dépend du pH et de la température de l’eau. À des valeurs de pH inférieures à environ 6, il existe dans l’eau principalement du dioxyde de carbone dissous et une petite quantité d’acide carbonique. À des valeurs de pH comprises entre 6,5 et 10 environ, le bicarbonate est dominant. À des valeurs de pH supérieures à environ 10,5, l’ion carbonate domine. Les causes des précipitations sont notamment les suivantes.
- Pour les eaux souterraines, le pompage réduit la pression de l’eau lorsqu’elle s’écoule dans le puits. Cette réduction libère du gaz carbonique dissous, ce qui entraîne une augmentation du pH de l’eau souterraine et qui, à son tour, peut provoquer une précipitation de carbonate de calcium.
- L’évaporation augmente la concentration de produits chimiques dissous dans l’eau qui reste dans l’émetteur. En raison de sa faible solubilité dans l’eau, le carbonate de calcium précipite facilement pendant l’évaporation.
- Le degré de solubilité du carbonate de calcium diminue lorsque la température de l’eau augmente. La température de l’eau dans les systèmes de micro-irrigation de surface peut augmenter au fur et à mesure que l’eau s’écoule dans les latéraux.
- L’injection de certains produits chimiques tels que l’aqua ammoniaque et l’eau de Javel ou l’injection d’engrais ou de matériaux contenant du calcium tels que le gypse peuvent provoquer des précipitations.
Prévention et correction des problèmes de colmatage
L’abaissement du pH de l’eau dissout tout précipité de carbonate de calcium existant et empêche la formation de sels de carbonate supplémentaires. Le traitement habituel des précipitations de carbonate de calcium consiste à injecter un acide pour acidifier l’eau, en abaissant le pH à 7 ou moins. Les acides couramment utilisés à cette fin sont l’acide sulfurique, l’acide muriatique et l’acide chlorhydrique. D’autres acides comme l’acide citrique et l’acide nitrique peuvent être utilisés, mais ils sont plus coûteux.
Un composé acide-engrais comme l’acide urée-sulfurique est plus sûr à utiliser qu’un acide pur. Cependant, l’injection continue de produits acides contenant de l’azote peut causer des problèmes au cours d’une saison pour les cultures qui sont sensibles aux applications excessives d’azote, comme les pommes et les raisins de cuve.
Les chercheurs ont évalué d’autres composés tels qu’un phosphonate et des matériaux d’acide phosphonique et les ont trouvés efficaces pour empêcher la précipitation du carbonate de calcium.
Les traitements recommandés pour prévenir le colmatage sont les suivants.
- Injecter de l’acide en continu pour maintenir le pH de l’eau entre 5 et 7.
- Injecter de l’acide par intermittence pour maintenir le pH de l’eau en dessous de 4 pendant au moins 30 à 60 minutes. La fréquence d’injection dépend de la vitesse à laquelle se produit la précipitation des carbonates. Lorsque vous utilisez des émetteurs à compensation de pression, vérifiez auprès du fabricant avant d’abaisser le pH à 4 ou moins. Le laiton et tout autre raccord en métal non inoxydable peuvent être piqués.
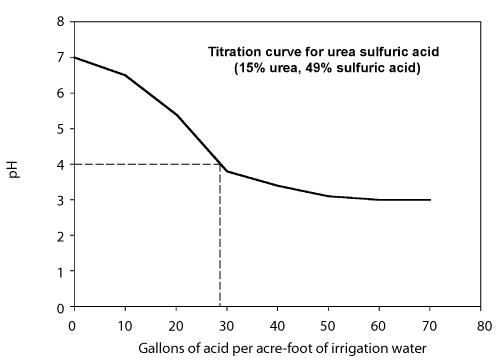
La quantité d’acide nécessaire pour abaisser le pH au niveau souhaité dépend de l’alcalinité de l’eau et du pH cible. Deux approches peuvent être utilisées pour déterminer la quantité d’acide nécessaire. - Développer une courbe de titrage qui montre la quantité d’acide nécessaire pour abaisser le pH de l’eau à une valeur désirée pour une eau d’irrigation particulière. Ceci est généralement fait par un laboratoire et nécessite que vous fournissiez des échantillons de l’eau et de l’acide. Le comportement du titrage dépend de l’alcalinité de l’eau d’irrigation et la courbe de titrage peut donc varier d’une source d’eau à l’autre. La figure 8 montre une courbe de titrage utilisant une solution d’urée et d’acide sulfurique contenant 49 pour cent d’acide sulfurique.
- Utilisez une approche par essais et erreurs en ajoutant de l’acide à l’eau par incréments et en mesurant le pH, en répétant jusqu’à ce que vous atteigniez le niveau de pH souhaité. Le papier tournesol, les trousses d’analyse colormétrique pour aquariums et piscines et les pH-mètres portables peuvent être utilisés pour déterminer le pH de l’eau. De nombreuses sources vendent des pH-mètres de poche ; ils nécessitent un étalonnage périodique à l’aide de solutions standard qui peuvent également être achetées.
Figure 8. Courbe de titrage de l’acide sulfurique de l’urée avec de l’acide sulfurique à 49%.
Calcul du taux d’injection
Une fois que vous avez déterminé la quantité d’acide dont vous avez besoin, vous pouvez calculer le taux d’injection d’acide en utilisant l’équation suivante :
IR = (A × Q × 60) ÷ 326 000
où
IR = le taux d’injection en gallons par heure (gph)
A = les gallons d’acide par acre-pied d’eau nécessaire pour abaisser le pH
Q = le débit du système d’irrigation en gallons par minute (gpm)
Les acre-pieds d’eau peuvent être déterminés par la formule Q × T × 60 ÷ 326,000, où T est la durée de réglage de l’irrigation en heures.
Surveillez le pH de l’eau pendant le processus d’injection pour vous assurer qu’il ne descend pas beaucoup en dessous de 4. Toutes les eaux sont ” tamponnées ” différemment par les sels qu’elles contiennent ; une eau peut nécessiter 10 gph alors qu’une autre ne nécessitera que 2 gph.
Exemple
Calculez le taux d’injection nécessaire pour abaisser le pH à 4 en utilisant un acide urée-sulfurique (49%). La figure ci-dessus représente la courbe de titrage. Le débit du système est de 1 000 gallons par minute.
Étape 1. A partir de la courbe de titrage, notez que 26 gallons d’acide urée-sulfurique par acre-pied d’eau sont nécessaires pour abaisser le pH à 4.
Etape 2.
IR = (26 × 1 000 × 60) ÷ 326 000 = 4,8 gph
Mesures de sécurité
- Ne pas mélanger directement l’acide et le chlore. Cela entraînera la formation de gaz chloré toxique.
- Ne pas ajouter d’eau à l’acide. Au lieu de cela, ajoutez toujours l’acide à l’eau.