Mi a kúrium
A kúrium (ejtsd: KYOOR-ee-em) az aktinidák családjába tartozó radioaktív fém, melyet a Cm kémiai szimbólummal jelölünk.

Curium szimbólum
Curium izotópok
15 izotópja van, amelyek közül a legstabilabb a curium-247, amelynek felezési ideje kb. 15 600 000 év, amely alfa-bomlással plutónium-243-at képez .
története
Nevének eredete:
Ki fedezte fel.
Mi után kapta a nevét: Pierre Curie és Marie Curie, a rádium felfedezői: Az elemet Glenn Seaborg, Albert Ghiorso és Ralph James kutatócsoportja szintetizálta .

Kúrium
Hol fedezték fel a kúriumot
1944-ben Seaborg, Ghiorso és James a kaliforniai Berkeleyben egy ciklotronban alfa-részecskékkel bombázták a plutónium-239-et. Ezt követően a Chicagói Egyetem Metallurgiai Laboratóriumába küldték, hogy izolálják és elemezzék az új elemet. 1945. november 11-én, a 2. világháború befejezése után a felfedezést Seaborg egy rádióműsorban fedte fel, ahová vendégkutatóként meghívták. A felfedezést a következő héten hivatalossá tették.
Az elem besorolása és helyzete a periódusos rendszerben
| Csoportszám | Nem ismert |
| Periódus | 7 |
| Blokk | f |
A kúrium helye a periódusos rendszerben
A kúrium tulajdonságai
Általános tulajdonságok |
|||
| Relatív atomtömeg | 247 | ||
| Atomi tömeg | 247 atomi tömegegység | ||
Fizikai tulajdonságok |
|||
| Szín/megjelenés | ezüstfehér | ||
| csillogás | nem ismert | ||
| szag | nem ismert | ||
| olvadáspont/fagyáspont | 1345 °C (2453°F) | ||
| forraláspont | nem ismert | ||
| sűrűség | 13.51 g/cm3 | ||
| Ármazállapot szobahőmérsékleten (szilárd/folyékony/gáz) | Szilárd | ||
| Keménység | Nem ismert | ||
| Elektromos vezetőképesség | Nem ismert | ||
| Thermikus (hő)vezetőképesség | Nem ismert | ||
| Specifikus hő | Nem ismert | ||
Kémiai tulajdonságok |
|||
| Gyúlékonyság | Nem ismert | ||
| Oxidációs állapotok | 4 | 3 | |
Kúrium atomi adatai
| atomszám | 96 | |||||||||||||
| Valenciaelektronok | 2 | |||||||||||||
| Kvantumszám | ||||||||||||||
| – n | 5 | |||||||||||||
| – ℓ | 3 | |||||||||||||
| – m ℓ | – | -3 | ||||||||||||
| – m s | -1/2 | |||||||||||||
| Elektronkonfiguráció (nemesgázkonfiguráció) | 5f76d17s2 | |||||||||||||
| Atomszerkezet | ||||||||||||||
| – Elektronok száma | 99 | |||||||||||||
| – A neutronok száma | 151 | |||||||||||||
| – A protonok száma | 99 | |||||||||||||
| Atomsugár | ||||||||||||||
| – Atomsugár | 2.45 Å | |||||||||||||
| – kovalens sugár | 1.68 Å | |||||||||||||
| Elektronegativitás | Nem ismert | |||||||||||||
| Ionizációs energia
(kJmol-1) |
1. | 2. | 3. | 4. | 5. | 6. | 7. | |||||||
| 578.082 | – | – | – | – | – | – | ||||||||
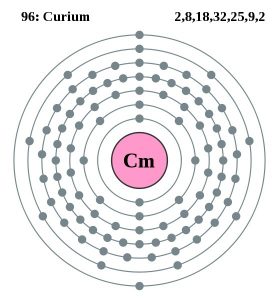
Kúrium Bohr-modell
Mire használják a kúriumot
Mert a földkéregben a természetben nem fordul elő, a radioaktív elemet csak alapkutatásokban használják, mivel laboratóriumi előállítása korlátozott. Emellett nem lép reakcióba más vegyületekkel. A karbium-244 azonban alkalmazható lehet energiaforrásként az űrhajókban használt radioizotópos termoelektromos generátorok működtetéséhez.
Érdekes tények a kuriumról
- A kurium-244-et alfa-proton röntgenspektrométerben használták a Mars légkörében és kőzetfelszíni vegyületeiben lévő kémiai elemek jelenlétének kimutatására
- Az elem radioaktív jellege miatt vörösen világít a sötétben
Mennyibe kerül a kurium
A radioaktív elem a laboratóriumi előállításon kívül kereskedelmi forgalomban nem kapható.