Che cosa è Curium
Curium (pronunciato come KYOOR-ee-em) è un metallo radioattivo appartenente alla famiglia dei metalli attinidi e denotato dal simbolo chimico Cm .

Simbolo del Curio
Isotopi del Curio
Ha 15 isotopi di cui il più stabile è il Curio-247 con un’emivita di circa 15.600.000 anni che subisce il decadimento alfa per formare plutonio-243.
Storia
Origine del suo nome: Prende il nome dai famosi scienziati Pierre Curie e Marie Curie, gli scopritori del radio.
Chi l’ha scoperto: L’elemento fu sintetizzato dal team di ricerca di Glenn Seaborg, Albert Ghiorso e Ralph James.

Curio
Dove fu scoperto il Curio
Nel 1944, Seaborg, Ghiorso e James bombardarono il plutonio-239 con particelle alfa in un ciclotrone a Berkeley, California. Fu poi inviato al Laboratorio Metallurgico dell’Università di Chicago per isolare e analizzare il nuovo elemento. L’11 novembre 1945, dopo la fine della seconda guerra mondiale, la scoperta fu rivelata da Seaborg in un programma radiofonico dove era stato invitato come scienziato ospite. Fu resa ufficiale la settimana successiva.
Classificazione e posizione dell’elemento sulla tavola periodica
| Numero del gruppo | ignoto |
| Periodo | 7 |
| Block | f |
Posizione del curio nella tavola periodica
Proprietà del curio
Proprietà generali |
|||
| Massa atomica relativa | 247 | ||
| Massa atomica | 247 unità di massa atomica | ||
Proprietà fisiche |
|||
| Colore/aspetto | Bianco argento | ||
| Lucentezza | Non nota | ||
| Odore | Sconosciuto | ||
| Punto di fusione/punto di congelamento | 1345 °C (2453°F) | ||
| Punto di ebollizione | Non conosciuto | ||
| Densità | 13.51 g/cm3 | ||
| Stato della materia a temperatura ambiente (solido/liquido/gas) | Solido | ||
| Durezza | ignota | ||
| Conducibilità elettrica | ignota | ||
| Conducibilità termica (calore) | Sconosciuto | ||
| Calore specifico | Sconosciuto | ||
Proprietà chimiche |
|||
| Infiammabilità | Non conosciuto | ||
| Stati di ossidazione | 4 | 3 | |
Dati atomici del Curio
| Numero atomico | 96 | ||||||
| Elettroni di valenza | 2 | ||||||
| Numero quantico | |||||||
| – n | 5 | ||||||
| – ℓ | 3 | ||||||
| – m ℓ | -3 | ||||||
| – m s | -1/2 | ||||||
| Configurazione degli elettroni (configurazione dei gas nobili) | 5f76d17s2 | ||||||
| Struttura atomica | |||||||
| – Numero di elettroni | 99 | ||||||
| – Numero di neutroni | 151 | ||||||
| – Numero di protoni | 99 | ||||||
| Raggio dell’atomo | |||||||
| – Raggio atomico | 2.45 Å | ||||||
| – Raggio covalente | 1.68 Å | ||||||
| Elettronegatività | Non nota | ||||||
| Energia di ionizzazione
(kJmol-1) |
1° | 2° | 3° | 4° | 5° | 6° | 7° |
| 578.082 | – | – | – | – | – | – | |
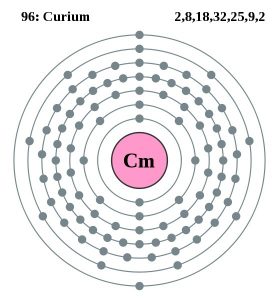
Modello Bohr del Curio
A cosa serve il Curio
Poiché non si trova naturalmente nella crosta terrestre, l’elemento radioattivo è stato usato solo in studi di ricerca di base a causa della sua limitata produzione di laboratorio. Inoltre, non reagisce con altri composti. Tuttavia, il curium-244 potrebbe essere applicabile come fonte di energia per il funzionamento dei generatori termoelettrici a radioisotopi utilizzati nei veicoli spaziali.
Fatti interessanti sul curio
- Il curio-244 è stato usato nell’Alpha Proton X-ray Spectrometer per rilevare la presenza di elementi chimici nell’atmosfera e nei composti della superficie rocciosa di Marte
- Si crede che l’elemento brilli di rosso al buio a causa della sua natura radioattiva
Quanto costa il curio
L’elemento radioattivo non è disponibile in commercio al di fuori della produzione di laboratorio.