Qué es el curio
El curio (pronunciado como KYOOR-ee-em) es un metal radiactivo perteneciente a la familia de los metales actínidos y denotado por el símbolo químico Cm .

Símbolo del Curio
Isótopos del Curio
Tiene 15 isótopos de los cuales el más estable es el Curio-247 con una vida media de unos 15.600.000 años que sufre desintegración alfa para formar plutonio-243.
Historia
Origen de su nombre: Lleva el nombre de los reconocidos científicos, Pierre Curie y Marie Curie, los descubridores del radio.
Quién lo descubrió: El elemento fue sintetizado por el equipo de investigación de Glenn Seaborg, Albert Ghiorso y Ralph James.

Curio
¿Dónde se descubrió el curio
En 1944, Seaborg, Ghiorso y James bombardearon el plutonio-239 con partículas alfa en un ciclotrón en Berkeley, California. A continuación lo enviaron al Laboratorio Metalúrgico de la Universidad de Chicago para aislar y analizar el nuevo elemento. El 11 de noviembre de 1945, tras el final de la Segunda Guerra Mundial, Seaborg reveló el descubrimiento en un programa de radio al que había sido invitado como científico. Se hizo oficial a la semana siguiente .
Clasificación y posición del elemento en la tabla periódica
| Número de grupo | Desconocido |
| Período | 7 |
| Bloque | f |
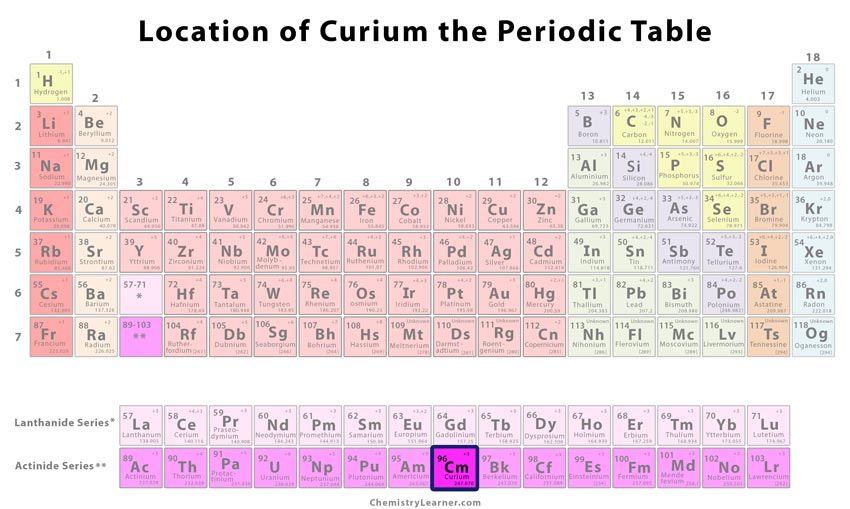
Ubicación del curio en la tabla periódica
Propiedades del curio
Propiedades generales |
|||
| Masa atómica relativa | 247 | ||
| Masa atómica | 247 unidades de masa atómica | ||
Propiedades físicas |
|||
| Color/apariencia | Blanco plateado | ||
| Brillo | Desconocido | ||
| Olor | Desconocido | ||
| Punto de fusión/punto de congelación | 1345 °C (2453°F) | ||
| Punto de ebullición | Desconocido | ||
| Densidad | 13.51 g/cm3 | ||
| Estado de la materia a temperatura ambiente (sólido/líquido/gas) | Sólido | ||
| Dureza | Desconocida | ||
| Conductividad eléctrica | Desconocida | ||
| Conductividad térmica | Desconocida | ||
| Calor específico | Desconocido | ||
Propiedades químicas |
|||
| Inflamabilidad | Desconocido | ||
| Estados de oxidación | 4 | 3 | |
Datos atómicos del curio
| Número atómico | 96 | ||||||
| Electrones de valencia | 2 | ||||||
| Números cuánticos | |||||||
| – n | 5 | ||||||
| – ℓ | 3 | ||||||
| – m ℓ | -3 | ||||||
| – m s | -1/2 | ||||||
| Configuración de los electrones (configuración de los gases nobles) | 5f76d17s2 | ||||||
| Estructura atómica | |||||||
| – Número de electrones | 99 | ||||||
| – Número de neutrones | 151 | ||||||
| – Número de protones | 99 | ||||||
| Radio del átomo | |||||||
| – Radio atómico | 2.45 Å | ||||||
| – Radio covalente | 1.68 Å | ||||||
| Electronegatividad | Desconocida | ||||||
| Energía de ionización
(kJmol-1) |
1ª | 2ª | 3ª | 4ª | 5ª | 6ª | 7ª |
| 578.082 | – | – | – | – | – | – | |
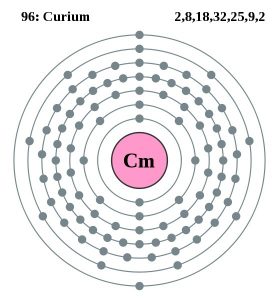
Modelo Bohr del Curio
Para qué se utiliza el Curio
Como no se encuentra de forma natural en la corteza terrestre, el elemento radiactivo sólo se ha utilizado en estudios de investigación básica debido a su limitada producción en laboratorio. Además, no reacciona con otros compuestos. Sin embargo, el curio-244 podría ser aplicable como fuente de energía para el funcionamiento de los generadores termoeléctricos de radioisótopos utilizados en las naves espaciales.
Hechos interesantes sobre el curio
- El curio-244 se ha utilizado en el Espectrómetro de Rayos X de Protones Alfa para detectar la presencia de elementos químicos en la atmósfera y los compuestos de la superficie de las rocas de Marte
- Se cree que el elemento brilla en rojo en la oscuridad debido a su naturaleza radiactiva
Cuánto cuesta el curio
El elemento radiactivo no está disponible comercialmente fuera de la producción de laboratorio.