Ce este Curiul
Curiul (pronunțat KYOOR-ee-em) este un metal radioactiv care aparține familiei metalelor actinide și este desemnat prin simbolul chimic Cm .

Simbolul Curiului
Izotopii de Curiu
Are 15 izotopi dintre care cel mai stabil este Curiu-247 cu un timp de înjumătățire de aproximativ 15.600.000 de ani care suferă o descompunere alfa pentru a forma plutoniu-243 .
Istorie
Originea numelui său: Este numit după renumiții oameni de știință, Pierre Curie și Marie Curie, descoperitorii radiului.
Cine l-a descoperit: Elementul a fost sintetizat de echipa de cercetători formată din Glenn Seaborg, Albert Ghiorso și Ralph James .

Curiu
Unde a fost descoperit curiul
În 1944, Seaborg, Ghiorso și James au bombardat plutoniu-239 cu particule alfa într-un ciclotron la Berkeley, California. Acesta a fost apoi trimis la Laboratorul Metalurgic de la Universitatea din Chicago pentru a izola și analiza noul element. La 11 noiembrie 1945, după încheierea celui de-al Doilea Război Mondial, descoperirea a fost dezvăluită de Seaborg la o emisiune radiofonică la care fusese invitat în calitate de om de știință. Ea a fost oficializată în săptămâna următoare .
Clasificarea și poziția elementului în tabelul periodic
| Numărul grupei | Nu se știe |
| Perioada | 7 |
| Bloc | f |
Localizarea curului în tabelul periodic
Proprietăți ale curului
Proprietăți generale |
|||
| Masa atomică relativă | 247 | ||
| Masa atomică | 247 unități de masă atomică | ||
Proprietăți fizice |
|||
| Culoare/aparență | Alb-argintiu | ||
| Lustru | Nu se știe | ||
| Odor | Necunoscut | ||
| Punctul de topire/punctul de congelare | 1345 °C (2453°F) | ||
| Punctul de fierbere | Nu se cunoaște | ||
| Densitatea | 13.51 g/cm3 | ||
| Stare a materiei la temperatura camerei (solid/lichid/gaz) | Solid | ||
| Duritate | Nu se știe | ||
| Conductibilitate electrică | Nu se știe | ||
| Conductivitate termică (căldură) | Nu se știe | ||
| Căldura specifică | Nu se știe | ||
Proprietăți chimice |
|||
| Inflamabilitate | Nu se știe | ||
| State de oxidare | 4 | 3 | |
Date atomice ale curului
| Numărul atomic | 96 | ||||||
| Electronii de valență | 2 | ||||||
| Numele cuantelor | |||||||
| – n | 5 | ||||||
| – ℓ | 3 | ||||||
| – m ℓ | -3 | ||||||
| – m s | -1/2 | ||||||
| Configurația electronilor (configurația gazelor nobile) | 5f76d17s2 | ||||||
| Structura atomică | |||||||
| – Numărul de electroni | 99 | ||||||
| – Numărul de neutroni | 151 | ||||||
| – Numărul de protoni | 99 | ||||||
| Radia atomului | |||||||
| – Raza atomică | 2.45 Å | ||||||
| – Raza covalentă | 1.68 Å | ||||||
| Electronegativitatea | Nu se știe | ||||||
| Energia de ionizare
(kJmol-1) |
1-a | 2-a | 3-a | 4-a | 5-a | 6-a | 7-a |
| 578.082 | – | – | – | – | – | – | |
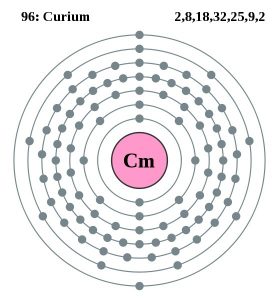
Modelul Bohr al Curiului
La ce se folosește Curiul
Pentru că nu se găsește în mod natural în scoarța terestră, elementul radioactiv a fost utilizat doar în studii de cercetare fundamentală din cauza producției sale limitate în laborator. De asemenea, el nu reacționează cu alți compuși. Cu toate acestea, curiul-244 ar putea fi aplicabil ca sursă de energie pentru funcționarea generatoarelor termoelectrice cu radioizotopi utilizate în navele spațiale .
Fapte interesante despre curiu
- Curiul-244 a fost folosit în spectrometrul cu raze X Alpha Proton pentru a detecta prezența elementelor chimice în atmosfera și în compușii de la suprafața rocilor de pe Marte
- Se crede că elementul strălucește roșu în întuneric datorită naturii sale radioactive
Cât costă curiul
Elementul radioactiv nu este disponibil în comerț în afara producției de laborator.