Preface
Dit artikel biedt een persoonlijke visie op wat nodig zou kunnen zijn voor faagtherapie om eindelijk door te breken als een mainstream antibacterieel hulpmiddel. Het is beïnvloed door historische en recente mislukkingen en onzekerheden op het gebied van faagtherapie en beoogt oplossingen te vinden op basis van toekomstige en opkomende technologieën die model moeten staan voor de wetenschap en de samenleving van morgen.
Faagtherapie
Bacteriofagen (fagen) zijn de virussen van bacteriën. Sinds onheuglijke tijden beheersen zij de groei en verspreiding van hun bacteriële gastheren. Bacteriële virussen zijn de meest alomtegenwoordige levensechte entiteiten in onze biosfeer. Er zijn naar schatting 10 miljoen keer meer virussen in de oceanen dan er sterren zijn in het heelal en als alle fagen op aarde op elkaar gestapeld zouden worden, zou deze toren zich verder uitstrekken dan de dichtstbijzijnde 60 melkwegstelsels (Suttle, 2013). Ze zijn gemakkelijk te vinden overal waar bacteriën gedijen: in riolen, rivieren, of de urine en ontlasting van patiënten. Fagen van menselijke bacteriële pathogenen bestaan meestal uit een icosahedrale kop, een bol met 20 platte vlakken gemaakt van eiwitten en die een nucleïnezuurgenoom bevat, waaraan een eiwitstaart is bevestigd. Wanneer een strikt lytische faag zich met zijn staartvezels en stekels hecht aan het oppervlak van zijn doelbacterie, trekt de spuitvormige staartschede samen en wordt de staartkern door de bacteriële celwand gedreven, waardoor het faaggenoom in het periplasma van de bacteriecel wordt geïnjecteerd. Onmiddellijk worden de bacteriële DNA- en eiwitsynthesemachines gekaapt om kopieën van de faag te maken. Sommige fagen knippen het bacteriële DNA in stukken. Na een latente periode van minuten tot uren barsten de nieuw gevormde fagen uit hun bacteriële gastheren, die tijdens dit proces worden gedood. De nakomelingen van de fagen, die per bacterie in de honderden kunnen lopen, gaan dan op zoek naar nieuwe gastheerbacteriën om te infecteren. Als zodanig kunnen fagen worden beschouwd als zelfreplicerende antimicrobiële stoffen. Belangrijk is dat fagen zijn geëvolueerd om alleen bepaalde doelbacteriën te infecteren en onschadelijk zijn voor zoogdiercellen.
Eerste bewijzen van virusachtige agentia met antibacteriële activiteit werden gemeld door de Engelse bacterioloog Frederick Twort, en door de Frans-Canadese microbioloog Felix d’Hérelle, respectievelijk in 1915 en 1917 (Sulakvelidze et al., 2001). In 1919 maakte d’Hérelle voor het eerst gebruik van het therapeutisch potentieel van fagen toen hij ze gebruikte om een jongen te genezen die leed aan dysenterie in Parijs. Faagtherapie werd onmiddellijk erkend als een therapeutische benadering om bacteriële infecties te behandelen en de commercialisering van faagtherapie-preparaten werd ondernomen door verschillende bedrijven, zoals L’Oréal in Europa en Eli Lilly Company in de Verenigde Staten (Sulakvelidze et al., 2001). In 1923 stichtte de Georgische microbioloog Giorgi Eliava het Eliava Instituut in Tbilisi, Georgië, gewijd aan onderzoek naar faagtherapie. Dit was het begin van uitgebreid onderzoek en ontwikkeling op het gebied van faagtherapie in de voormalige Sovjet-Unie. De vroege toepassingen van faagtherapie waren echter vaak onbetrouwbaar en er was ook onderzoek naar antibiotica gaande. Het succesvolle gebruik van penicilline tijdens de Tweede Wereldoorlog en de daaropvolgende wereldwijde commercialisering ervan deden Westerse wetenschappers hun belangstelling voor faagtherapie verliezen. Sovjet onderzoekers daarentegen bleven faagtherapie ontwikkelen en hun resultaten publiceren, maar door het IJzeren Gordijn verspreidden hun kennis en ervaring zich niet over de wereld (Sulakvelidze et al., 2001). Aan het begin van het derde millennium wekte de toenemende gezondheidslast van infecties met antibiotica-resistente bacteriën (Cassini et al., 2019) een hernieuwde wereldwijde belangstelling voor faagtherapie als een levensvatbaar aanvullend instrument voor de klinische behandeling van bacteriële infecties (Thiel, 2004). Over de hele wereld worden faagtherapiecentra opgericht, in navolging van het Eliava Instituut en de faagtherapie-eenheid van het Hirszfeld Instituut in Wrocław, Polen (Miêdzybrodzki et al, 2012).
Het jaar 2035
Snel vooruit naar de toekomstige aarde van 2035, een sombere wereld die wordt gekenmerkt door menselijke overbevolking, grote verstoringen van het ecosysteem, opwarming van de aarde en xenofobie.
Terwijl hij in zijn bad lag te weken, voelde Dr. John Iverian, een gepensioneerd microbioloog, plotseling een uiterst pijnlijke steek achter in zijn nek, gevolgd door een geluid als van de propeller van een klein vliegtuig. Hij screende de omgeving en in zijn ooghoek zag hij een vreemd groot insect met lange griezelige poten en antennes op de muur naast zijn design badkuip zitten. Osuri, het thuisbeheersysteem van Iverians loft in het centrum van Antwerpen, identificeerde het insect als de bruine gemarmoreerde stinkwants Halyomorpha halys, die zich over de hele wereld had verspreid. Osuri’s verslag, geprojecteerd op een van de videoschermen in de badkamer, vermeldde dat mensen die gebeten waren, aanvankelijk een kleine rode zweer in de bijtzone van hun huid hadden. Als ze er niets aan deden, zwol de bijtwond op en kwam er pus uit. Moe en duizelig stapte Iverian uit zijn bad en ging naar bed. Hij had besloten de uitgebreide wondbehandeling, die hem door Osuri sterk was aangeraden, niet uit te voeren. De volgende ochtend vroeg was de beet echter veranderd in een necrotische wond met duidelijke tekenen van infectie.
Angstig activeerde Iverian zijn Phage-BEAM apparaat. BEAM stond voor “Bedside Energized Anti-Microbial.” Het apparaat had de grootte en vorm van een schoenendoos, maar met een eleganter en gepolijster uiterlijk. De naam van het apparaat en de fabrikant waren in kleurige letters op de zijkant van de naadloze witte geëmailleerde doos gedrukt. Iverian haalde een wattenstaafje uit de steriele verpakking en ging er voorzichtig mee over het hele wondgebied, waarbij hij ervoor zorgde dat het wondexsudaat de wattenpunt van het wattenstaafje goed nat maakte. Toen het wattenstaafje in de buurt kwam van het gedeelte “monster inbrengen” van de doos, ging er als bij toverslag een deurtje open, waardoor een 10 centimeter hoog hologram van een laborante, Marcia genaamd, vrijkwam. Zij liet Iverian zien waar hij het monster moest plaatsen. Marcia was ontwikkeld om de klanten door de testprocedure te leiden. “Voor de beste resultaten moet u een nieuwe faag-bio-inktpatroon inbrengen, Dr. Iverian,” zei Marcia. Net zoals bij de 2D printers van vroeger, waren de kosten van de bio-inkt cartridges bijna even hoog als de kostprijs van het Phage-BEAM toestel zelf. Volgens “Business Insider,” was faag bio-inkt de tweede duurste vloeistof op aarde, na Chanel No. 8. Gelukkig had Iverian, als een van de uitvinders, het recht verkregen om altijd gratis over de meest recente versie van dit apparaat te beschikken, inclusief een continue voorraad reagentia.
Iverian wist perfect hoe het apparaat werkte, dus hij had de hulp van Marcia niet nodig. Eerst werd DNA uit de swab-tip gehaald en het metagenoom – al het genetisch materiaal in het monster, inclusief de besmettelijke bacteriën – werd bepaald. Vervolgens werden deze genetische gegevens naar een beveiligde “Phage XChange” server gestuurd, waar een complex AI-gestuurd algoritme de genoomsequentie voorspelde van de faag die het meest waarschijnlijk de in het metagenoom geïdentificeerde infectiebacterie zou lyseren en de zwakste immuunreactie bij de patiënt zou opwekken. De faaggenoomgegevens werden naar het Phage-BEAM-apparaat gestuurd, dat eerst het faaggenoom en vervolgens de faag synthetiseerde, met behulp van een eigen bacterievrij faagproductiesysteem.
Binnen 1 uur na bemonstering zou het apparaat een gebruiksklaar therapeutisch faagproduct produceren. De resultaten van de stap-voor-stap procedure zouden worden doorgegeven op het enorme videoscherm in Iverian’s woonkamer. Zittend in zijn LC2 fauteuil, luisterend naar Mozart’s Grote Mis in C mineur, wachtte Iverian met spanning op de resultaten. Hij had hier een slecht gevoel over. De uitslag liet Iverian rillen over zijn rug lopen. Bacteriële ziekteverwekker geïdentificeerd: Streptococcus pyogenes stam FE-2033! Osuri activeerde onmiddellijk het infectie-alarmprotocol, stuurde een bericht naar het World Center for Disease Control en projecteerde zorgwekkende achtergrondinformatie over de dodelijke vleesetende bacteriestam, die sinds 2033 werd beschouwd als een onmiddellijke bedreiging voor de volksgezondheid. Even overwoog Iverian de geïnfecteerde wond en wat omringend gezond weefsel weg te snijden met een keukenmes, maar hij kalmeerde en besloot te wachten en het op handen zijnde Phage-BEAM product aan te brengen. Een uur later had het Phage-BEAM apparaat synthetische fagen geproduceerd. Deze fagen werden vervolgens gemengd met de geïsoleerde bacteriën, in een validatiemodule, om hun in vitro doeltreffendheid te testen. Vijftien minuten later werd het groene licht gegeven voor Iverian om met de behandeling te beginnen. Iverian bracht de fagen aan in een hydrogel-wondverband met langzame afgifte, dat eerst was gemengd met de geconcentreerde fageensuspensie die was geproduceerd door het Phage-BEAM-apparaat, en dat ook synergetische antibiotica bevatte. De hydrogel verlichtte tijdelijk de pijn, wat hem verder kalmeerde. Iverian herhaalde de toepassing van de met faag en antibiotica geladen hydrogel eenmaal per dag. De wondinfectie verbeterde binnen 24 uur en na 7 dagen was de wond bijna volledig genezen. Iverian’s potentieel levensbedreigende infectie werd met succes behandeld, tijdig en zonder zijn huis te verlaten. Maar gedurende vele voorafgaande decennia was het niet zeker geweest dat faagtherapie zou doorbreken om een breed toegepast en klinisch bruikbaar antibacterieel hulpmiddel te worden. De medische wereld had een tijd nodig gehad om te beseffen dat faagtherapie niet identiek hoefde te zijn aan antibiotische therapie, en dit voornamelijk omwille van de eigenaardigheden van de actieve agentia, de fagen.
Enkele relevante eigenaardigheden van fagen
Fagen vertonen een aantal eigenschappen die verschillen van antibiotica en die hun ontwikkeling als farmaceutisch product en toepassing in therapie belemmerden. Ten eerste hebben zij de neiging specifiek te zijn over welke bacteriën zij infecteren. In het beste geval zullen zij een aanzienlijk deel van één enkele bacteriesoort treffen, maar in het slechtste geval zullen zij slechts een klein aantal stammen binnen één soort infecteren. Therapeutische fagen kunnen dus zo worden geselecteerd dat zij hoofdzakelijk één bacteriesoort, of een klinisch relevante subgroep daarvan, doden en de nuttige bacteriën van de patiënt (b.v. de darm-, huid-, of orale commensale flora) sparen. De meeste routinematig gebruikte antibiotica hebben daarentegen een breed werkingsspectrum, wat “nevenschade” kan veroorzaken aan de commensale microbiomen van de patiënt, wat op zijn beurt kan resulteren in nadelige effecten zoals de selectie van antibiotica-resistente bacteriesoorten (bv. Clostridium difficile) of antibiotica-geassocieerde diarree (Jernberg et al., 2010). Het nadeel van faagspecificiteit is dat de infecterende bacteriën moeten worden geïdentificeerd alvorens faagtherapie te starten. Bij empirische antibioticatherapie worden daarentegen meestal breedspectrumcocktails van antibiotica gebruikt die een veelheid van Gram-positieve en Gram-negatieve bacteriën en diverse schimmels beïnvloeden. Wanneer meer informatie bekend is (b.v. uit een bacteriële cultuur), kan de behandeling bestaan uit smal-spectrum antibiotica, die meer specifiek gericht zijn op de bacteriën of schimmels waarvan is vastgesteld dat zij de ziekte veroorzaken.
Ten tweede zijn bacteriën en fagen betrokken in een gastheer-parasiet relatie. Strikt lytische fagen zijn alomtegenwoordig in het milieu en vereisen de dood van hun bacteriële gastheer om hun levenscyclus te voltooien. Zonder gastheren kunnen fagen niet bestaan. Fagen zorgen voor selectie op resistente gastheren, die op hun beurt selectie opleggen op effectieve fagen. Dit resulteert in wat “antagonistische co-evolutie” wordt genoemd, een wapenwedloop tussen bacteriën en fagen, die wordt gekenmerkt door de wederzijdse evolutie van bacteriële resistentie en faaginfectiviteit (Buckling en Rainey, 2002). Net als bij de meeste antimicrobiële middelen zullen bacteriën dus ook resistent worden tegen fagen (Luria en Delbrück, 1943; Schooley et al., 2017), maar, in tegenstelling tot statische antibiotica, hebben fagen het vermogen om bacteriële resistentie te overwinnen (Buckling en Rainey, 2002). Er zijn niettemin aanwijzingen dat bacteriën en fagen hun respectieve resistentie en infectiviteit niet oneindig zullen verhogen (Fortuna et al., 2019).
Faagtherapiebenaderingen
Ten tijde van de opleving van de faagtherapie in het begin van de jaren 2000 waren er twee verschillende faagtherapiebenaderingen ontwikkeld (Pirnay et al., 2011). In wat de one-size-fits-all benadering zou kunnen worden genoemd, werden gedefinieerde breedspectrum faagcocktails toegepast, die verondersteld werden de meerderheid van de bacteriën aan te pakken waarvan vermoed werd dat ze bepaalde infectieziekten veroorzaakten. Deze vooraf gedefinieerde breedspectrum faagcocktails werden ontwikkeld, geproduceerd en getest binnen de huidige farmaco-economische modellen, die waren ontworpen voor “statische” geneesmiddelen zoals antibiotica. Echt breedspectrum faagcocktails, die werkzaam zijn tegen de meeste Gram-positieve en/of Gram-negatieve bacteriën die vaak voorkomen bij infectieziekten, moesten echter grote hoeveelheden fagen bevatten en bleken zeer moeilijk te ontwikkelen. Het was wel mogelijk om faagcocktails met een beperkter spectrum te ontwikkelen, die actief zijn tegen één of enkele bacteriesoorten, voor gebruik bij bepaalde indicaties en op voorwaarde dat de infecterende bacteriesoorten van tevoren bekend waren. Voor sommige bacteriesoorten, zoals Staphylococcus aureus, werden fagen met een uitzonderlijk breed gastheerbereik geïsoleerd en gekarakteriseerd (Vandersteegen et al., 2011). In PhagoBurn, een gerandomiseerde gecontroleerde studie, werd het succes in het bereiken van een blijvende vermindering van de Pseudomonas aeruginosa-belasting in brandwonden gekoppeld aan de initiële gevoeligheid voor de fagencocktail (Jault et al., 2019). Een derde van de geïncludeerde patiënten bleek echter reeds bestaande P. aeruginosa-stammen te herbergen die resistent waren tegen de fagencocktail, die bestond uit niet minder dan 12 lytische P. aeruginosa-fagen. Bovendien moesten faagcocktails die initieel ontworpen waren om effectief te zijn, regelmatig bijgewerkt worden (bv. aangevuld met nieuwe fagen) als reactie op het ontstaan van faagresistentie of de betrokkenheid van nieuw circulerende klinisch relevante stammen. Tenslotte was het niet bekend of de confrontatie van bacteriën met hoge concentraties van vaste faagcocktails zou leiden tot het ontstaan, de verspreiding en de persistentie van bacteriële faagresistentie in ziekenhuizen en in het milieu, vergelijkbaar met wat er was gebeurd bij het massale gebruik van antibiotica.
In gepersonaliseerde faagtherapieconcepten werden een of meer fagen geselecteerd uit een faagbank, of uit de omgeving, en eventueel aangepast (in vitro selectie van faagmutanten die een verhoogde infectiviteit vertonen) om de bacteriën geïsoleerd uit de infectieplaats van de patiënt efficiënter te infecteren (Friman et al, 2016). Sommige faagtherapiecentra hebben grote therapeutische faagbanken opgezet en onderhouden, die regelmatig werden bijgewerkt met nieuwe fagen, waardoor het gastheerbereik van de bank werd verbreed en aangepast aan de steeds veranderende bacteriepopulaties. Gepersonaliseerde faagtherapiebenaderingen waren potentieel duurzamer, aangezien alleen de infecterende bacterie het doelwit was, wat resulteerde in minder selectiedruk in de richting van resistentie tegen bacteriële fagen. Zij waren echter ook ingewikkelder en logistiek complexer dan een standaardaanpak, waarbij bacteriestammen en bijpassende fagen over de hele wereld moesten worden verzonden (figuur 1). Bovendien waren de concepten voor precisiegeneeskunde over het algemeen niet verenigbaar met de meeste ontwikkelings- en vergunningstrajecten voor geneesmiddelen (drugs in de Verenigde Staten), die meerdere jaren en miljoenen euro’s (dollars) vergden om te voltooien, en dit voor elke faag in de bank (Verbeken et al., 2012).
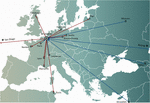
Figuur 1. Internationale transfers van fagen van (rode pijlen) en naar (blauwe pijlen) het Militair Hospitaal Koningin Astrid (QAMH) in Brussel met het oog op klinische toepassingen over de periode 2015-2020. Op nationaal niveau werden fagen verzonden van het QAMH naar vijf universitaire ziekenhuizen (niet afgebeeld). Bovendien ging de selectie van geschikte fagen vaak gepaard met de overdracht van de bacteriële isolaten van de patiënten, en werden vijf internationale patiënten (twee uit Frankrijk, twee uit Nederland, en één uit Tunesië) naar Brussel overgebracht voor faagtherapie.
Enter Synthetische Biologie
Bij het begin van het derde millennium werden steeds meer synthetische biologische benaderingen ontwikkeld om de specificiteit van fagen en het ontstaan van bacteriële faagresistentie te verminderen (bv, structure-guided design) (Pires et al., 2016; Dunne et al., 2019). Zo werden op gist gebaseerde platforms voor faagstaartvezelproteïneswitching uitgewerkt om hybride fagen te engineeren met een meer voorspelbaar en uitgebreid gastheerbereik (Ando et al., 2015; Yosef et al., 2017) en genetische engineeringstrategieën (bv, CRISPR-Cas editing tools) werden ontwikkeld om andere aspecten aan te pakken, zoals negatieve patiënt-faag interacties (bijv. anti-faag immuunrespons) (Brown et al., 2017), de mogelijke opkomst en verspreiding van bacteriële faag resistentiemechanismen, en het vrijkomen van schadelijke bacteriële inhoud zoals endotoxinen (Hwang et al., 2018). Synthetische faaggenomen moesten opnieuw worden opgestart om faagnakomelingen te produceren (Barbu et al., 2016; Pires et al., 2016), door transformatie van Escherichia coli of Listeria monocytogenes L-vormen (Kilcher et al., 2018), of met behulp van celvrije transcriptie-translatie (TXTL) systemen (Rustad et al., 2018). Westerse regelgevingskaders waren geleidelijk aan begonnen om tegemoet te komen aan precisie- en gepersonaliseerde faagtherapiebenaderingen met behulp van natuurlijk voorkomende fagen (Pirnay et al., 2018), gemanipuleerde fagen (Dedrick et al., 2019), en synthetische fagen.
De ontwikkeling van ad hoc en on-site therapeutische faagproductieapparaten, zoals Phage-BEAM, verliep niet soepel, herinnerde Iverian zich. Om te beginnen was er een op kunstmatige intelligentie (AI) gebaseerde in silico faagmatching en -ontwerp nodig. Deep learning (Martorell-Marugán et al., 2019), een subset van Machine Learning, werd gekozen om te zoeken naar verbanden tussen bacteriële genomen en infecterende faaggenen, omdat het gemakkelijker te schalen was naar een groter aantal monsters. Bijvoorbeeld, deep learning methoden vereisen geen zogenaamde feature-extractie, die gen/eiwitniveau annotatie van faag- en bacteriële genomen zou vereisen en voorspellingen zou beperken tot bepaalde bekende relaties tussen bacteriële en faagkenmerken, zoals faagstaartvezelstructuren die binden aan specifieke bacteriële celwandreceptoren. Als keerzijde moest het gevoed worden door een continue aanvoer van enorme hoeveelheden gegevens, die de genomen van lytische fagen koppelden aan de genomen van de gastheerbacterie, en daar wringt de schoen. Whole genome sequencing was langzaam doorgedrongen in de praktijk van de klinische microbiologie (American Academy of Microbiology, 2016), maar onderzoeksinstellingen en farmaceutische bedrijven stonden niet te springen om hun gegevens in te dienen bij één gecentraliseerde database, en er werden geen investeerders bereid en in staat gevonden om de beschikbare gegevens te verwerven en/of om voldoende hoeveelheden nieuwe gegevens te produceren. Een tweede obstakel dat moest worden overwonnen, was de onbeschikbaarheid van snelle, betrouwbare en betaalbare synthese van grote DNA-moleculen. De eerste DNA-synthesetechnieken waren gebaseerd op organische chemie en produceerden relatief kleine DNA-moleculen. De de novo synthese van faaggenomen vereiste het assembleren van verschillende genoomfragmenten (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) in de gist Saccharomyces cerevisiae, met behulp van kunstmatige chromosomen van gist (Ando et al., 2015), of chemische assemblage (Gibson et al., 2009). De ontwikkeling van een nieuwe techniek om DNA te synthetiseren, gebaseerd op DNA-synthetiserende enzymen die worden aangetroffen in cellen van het immuunsysteem (Palluk et al., 2018), vergemakkelijkte de synthese van faaggenomen. Ten slotte moesten enkele hindernissen worden overwonnen om generieke celvrije faagproductiesystemen te ontwikkelen die fagen in hoge titers kunnen produceren en dezelfde niveaus van bacteriële infectiviteit vertonen als hun natuurlijke analogen.
De doorbraak
Het grootste probleem was dat het erg moeilijk bleek te zijn om de enorme hoeveelheden gekoppelde faag- en bacteriële genoomsequenties te verzamelen die nodig zijn voor de deep learning AI-algoritmen om faagsequenties te voorspellen en/of te ontwerpen met een therapeutisch aanvaardbaar nauwkeurigheidsniveau. Iverian herinnerde zich dat de echte doorbraak kwam toen de non-profitorganisatie “Phage XChange” haar gelijknamige wereldwijde faagbesturingsplatform lanceerde om een efficiënte, gestandaardiseerde, duurzame en ethische faagtoevoerketen te creëren (Figuur 2). Phage XChange bestond voornamelijk uit een AI-module en een Distributed Ledger (DL) (Thiebes et al., 2020). De AI-module van het platform analyseerde gekoppelde faag- en bacterie-genomen om krachtige fagen voor klanten te voorspellen en te ontwerpen. Het voorspelde ook welke bacteriële pathogenen de meest dringende aandacht nodig hadden, op basis van het Internet of Things (IoT) en Big Data en informatie van internationale volksgezondheidsorganisaties, zoals de Wereldgezondheidsorganisatie (WHO) en nationale Centers for Disease Control. Deze gegevens stuurden het systeem in de richting van de isolatie en karakterisering van de meest dringend benodigde fagen.
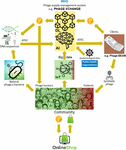
Figuur 2. Visie op hoe de toeleveringsketen van fagen er in 2035 zou kunnen uitzien. AI, kunstmatige intelligentie; ATGC, DNA-sequentie; BEAM, bedside energized anti-microbial; DL, distributed ledger; IoT, internet der dingen; P, PhageCoin; WHO, Wereldgezondheidsorganisatie.
De DL-module van het platform zorgde voor een voldoende, kwalitatieve en geregistreerde invoer van gekoppelde faag/bacterie genoomsequenties naar de AI-module en dito levering van faagsequenties aan cliënten, in overeenstemming met de bepalingen van het Nagoya-protocol (Expert round table on acceptance and re-implementation of bacteriophage therapy et al, 2018). Het DL registreerde onwrikbaar alle belanghebbenden (bv. leveranciers van gegevens, sequencingdiensten en klanten), transactie- en contractdetails. Het registreerde ook de exacte kwaliteit, specificaties, en het gewicht van het geleverde materiaal. Een algoritme bepaalde de niet-redundantie en schatte het gewicht (bv. de virulentie en het gastheerbereik van de fagen) en de wenselijkheid van het aangeleverde materiaal. Fagen gericht tegen opkomende bacteriële pathogenen waren uiteraard het meest gewild. De meeste octrooiproblemen werden vermeden. Het DL fungeerde als een betalingsgrootboek om te verzekeren dat alle partijen tijdig en eerlijk betaald werden. Een aantal PhageCoins (de cryptomunt van het platform) werden toegekend aan de leveranciers in verhouding tot de kwaliteit, het gewicht en de wenselijkheid van het geleverde materiaal. Klanten die voorspellingsresultaten (faagsequenties) via de DL extraheerden, betaalden een bedrag aan PhageCoins, evenredig met de geschatte waarde van de fagen. Deze PhageCoins werden gebruikt om het DL te onderhouden, om een voldoende en continue instroom van materiaal te verzekeren, en om de virulentie- en gastheerbereikgegevens van fagen uit te breiden (het matchen van fagen met bacteriën). Een extra injectie van fondsen en stimulans om materiaal te leveren werd gevonden in producenten en leveranciers van allerlei goederen. Met de direct verdiende PhageCoins konden faagleveranciers online allerlei producten kopen tegen sterk gereduceerde prijzen, van laboratorium- en schoolmateriaal tot sportartikelen. Deze goederen werden geleverd via bedrijfssponsoring. Verschillende gevestigde bedrijven sponsorden PhageXchange in ruil voor belastingvermindering, publiciteit, en het imago van een maatschappelijk verantwoord merk. Het gewicht van het geleverde materiaal, en dus ook de waarde ervan, werden aanvankelijk ondergewaardeerd, maar werden op regelmatige tijdstippen opnieuw geëvalueerd (iteratie) en leveranciers kregen meer PhageCoins toegekend wanneer dat gerechtvaardigd was. Hoewel nuttig vanaf het moment dat het werd geïntroduceerd, werd het platform pas echt succesvol toen het onder de bescherming van de WHO werd geplaatst, naar analogie met het wereldwijde systeem van traceerbaarheid, transparantie, waakzaamheid en bewaking van geneesmiddelen van menselijke oorsprong (Warwick et al., 2013). Een formele overeenkomst tussen Phage XChange en de WHO verhoogde het internationale vertrouwen in de duurzaamheid op lange termijn van het platform en de bescherming tegen onethische commerciële exploitatie. De zoektocht naar krachtige therapeutische fagen werd al snel een gemeenschapsinspanning gericht op het oplossen van de antibioticaresistentiecrisis, met onafhankelijke “faagjagers”, scholen, scoutinggroepen, dorpen aan de oevers van de Amazonerivier, enz. die fagen isoleerden en indienden bij Phage XChange, in ruil voor PhageCoins. In de marge hiervan ontwikkelden verschillende bedrijven en instellingen randapparatuur en diensten, zoals faagisolatiekits en sequencing- en fage-syntheseplatforms (bv. het Phage-BEAM-apparaat). Vooruitlopend op deze apparaten werden intermediaire oplossingen aangeboden, waarbij de fagen zelf via de DL werden verkregen.
Epilog
Deze kijk op de toekomst van de faagtherapie biedt een optimistisch einde aan de antibioticaresistentiecrisis. De ad hoc en ter plaatse productie van synthetische fagen, gekoppeld aan een wereldwijd, op de gemeenschap gebaseerd, fagenbeheerssysteem, bleek een welkom en betaalbaar (voor de sociale zekerheid) extra wapen te zijn in de strijd tegen antibioticaresistente bacteriële infecties. Het was echter geen wondermiddel; het was een synergetische aanvulling op gevestigde antimicrobiële stoffen. De onmiddellijke en celvrije productie van synthetische fagen, al dan niet ontworpen, had aanzienlijke voordelen ten opzichte van klassiek geproduceerde (in bacteriële gastheren) natuurlijke fagen:
(i) Het was niet nodig om fysieke therapeutische faagbanken in stand te houden en de bacteriële isolaten van de patiënt en de bijpassende therapeutische fagen over de hele wereld te verzenden.
(ii) Synthetische fagen tegen bacteriën die een eminente bedreiging vormen voor de volksgezondheid, zoals de uitbraak van E. coli O104:H4 in 2011 in Duitsland (Merabishvili et al, 2012), of bacteriën die (vermoedelijk) worden gebruikt voor bioterrorisme (Joñczyk-Matysiak et al, 2014) tijdig ter plaatse konden worden geproduceerd.
(iii) Fagen tegen bacteriën die potentieel dodelijke ziekten veroorzaken, waarvoor geen niet-dodelijke gastheerstammen voor de productie beschikbaar waren en waarvan de vermeerdering vroeger bioveiligheidsniveau-3 (bsl-3) bio-inperkingsvoorzorgsmaatregelen vereiste, konden worden gesynthetiseerd in bsl-1-omstandigheden.
(iv) Wanneer geen fagen uit bemonsteringsplaatsen konden worden geïsoleerd, bijvoorbeeld omdat de bij de isolatietechnieken gebruikte bacteriële gastheerstammen niet gevoelig waren voor de gewenste fagen, konden (voorspelde) faaggenomische sequenties, geëxtraheerd uit metagenomische gegevens (Reyes et al, 2010; Amgarten et al., 2018), konden worden gebruikt om synthetische fagen te produceren.
(v) Synthetische faagpreparaten bevatten geen (of kleinere hoeveelheden) moleculen die een negatieve impact op patiënten zouden kunnen hebben (bijv. endotoxinen).
(vi) Apparaten werden aangepast om synthetische fagen te produceren tijdens langdurige ruimtereizen en ruimtekolonisatie (Taylor en Sommer, 2005).
Er is weinig kans dat deze voorspellingen zullen uitkomen. Het is waarschijnlijk te kortzichtig om te denken dat een op de gemeenschap gebaseerde inspanning, gesteund door volksgezondheidsorganisaties en beheerd door een mondiaal, duurzaam en ethisch platform, de kern zou kunnen vormen van een oplossing voor de huidige wereldwijde antibioticaresistentiecrisis. Sommige onderdelen van het voorgestelde systeem, zoals de celvrije produktie van synthetische fagen met behulp van een bedside-apparaat, hebben een redelijke kans om gerealiseerd te worden, terwijl andere elementen, zoals bedrijfssponsoring, waarschijnlijk beperkt zullen blijven tot het domein van de science fiction. Je mag zeggen dat ik een dromer ben, dus voel je vrij om me in 2035 wakker te maken om me met de realiteit te confronteren!
Bijdragen van de auteur
J-PP bedacht de visie en stelde het manuscript op.
Financiering
De publicatiekosten werden gedekt door de “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst”.
Belangenverstrengeling
De auteur verklaart dat het onderzoek werd uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
De behandelende redacteur verklaarde in het verleden co-auteurschap te hebben met de auteur.
Acknowledgments
De persoonlijke visie, of droom, ontwikkeld in dit manuscript kwam tot stand als gevolg van interacties met vele collega-onderzoekers gedurende de afgelopen 15 jaar. Het is onmogelijk om ze allemaal te noemen, maar het zou ook niet eerlijk zijn om alle credits alleen te geven. Daarom heb ik besloten een aantal van hen hier te noemen (in alfabetische volgorde), met het risico – of beter, de zekerheid – dat ik enkele belangrijke beïnvloeders vergeet: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili, Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bossche, Mario Vaneechoutte, Gilbert Verbeken, en Kilian Vogele.
American Academy of Microbiology (2016). Toepassingen van Klinische Microbiële Next-Generation Sequencing: Report on an American Academy of Microbiology Colloquium Held in Washington, DC, in April 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P., da Silva, A. M., and Setubal, J. C. (2018). MARVEL, een tool voor voorspelling van bacteriofaagsequenties in metagenomische bins. Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., and Loessner, M. J. (2018). Cross-genus rebooting van op maat gemaakte, synthetische bacteriofaag-genomen in L-vorm bacteriën. Proc. Natl. Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., and Lu, T. K. (2018). Op fagen gebaseerde toepassingen in de synthetische biologie. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., and Delbrück, M. (1943). Mutaties van bacteriën van virusgevoeligheid naar virusresistentie. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine,” in Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019.ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). Selectie en karakterisatie van een kandidaat therapeutische bacteriofaag die de Escherichia coli O104:H4 stam van de 2011 uitbraak in Duitsland lyseert. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Klinische aspecten van faagtherapie. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., et al. (2018). De novo DNA synthese met behulp van polymerase-nucleotide conjugaten. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., and Lu, T. K. (2016). Genetisch gemanipuleerde fagen: een overzicht van de vooruitgang in het afgelopen decennium. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). Het faagtherapieparadigma: prêt-à-porter of sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). De magistrale faag. Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Virussen in de fecale microbiota van monozygote tweelingen en hun moeders. Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P., and Noireaux, V. (2018). Celvrije TXTL synthese van infectieuze bacteriofaag T4 in een enkele reageerbuisreactie. Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Ontwikkeling en gebruik van gepersonaliseerde bacteriofaag-gebaseerde therapeutische cocktails voor de behandeling van een patiënt met een gedissemineerde resistente Acinetobacter baumannii infectie. Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z., and Morris, J. G. Jr. (2001). Bacteriofaag therapie. Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Virussen: het ontsluiten van de grootste biodiversiteit op aarde. Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., and Sommer, A. P. (2005). Towards rational treatment of bacterial infections during extended space travel. Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B., and Sunyaev, A. (2020). Distributed ledger technology in genomics: a call for Europe. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). Oude dogma’s, nieuwe trucs – faagtherapie van de 21e eeuw. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Microbiologische en moleculaire evaluatie van bacteriofaag ISP voor de bestrijding van Staphylococcus aureus. PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J. P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Optimalisering van het Europees regelgevend kader voor duurzame bacteriofaagtherapie in de humane geneeskunde. Arch. Immunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L., and Wang, H. (2013). Wereldwijd consistente coderingssystemen voor medische producten van menselijke oorsprong. Bull. World Health Organ. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., and Qimron, U. (2017). Uitbreiding van het gastheerbereik van bacteriofaagdeeltjes voor DNA-transductie. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar