Zależności ciśnienia, objętości i temperatury w gazach rzeczywistych
Dla gazu idealnego, wykres \(PV/nRT\) w stosunku do \(P\) daje linię poziomą z punktem przecięcia 1 na osi \(PV/nRT\). Rzeczywiste gazy wykazują jednak znaczne odchylenia od zachowania oczekiwanego dla gazu idealnego, szczególnie przy wysokich ciśnieniach (Rysunek \PageIndex{1a}}). Jedynie przy stosunkowo niskich ciśnieniach (poniżej 1 atm) gazy rzeczywiste są zbliżone do gazu idealnego (Rysunek ‖).
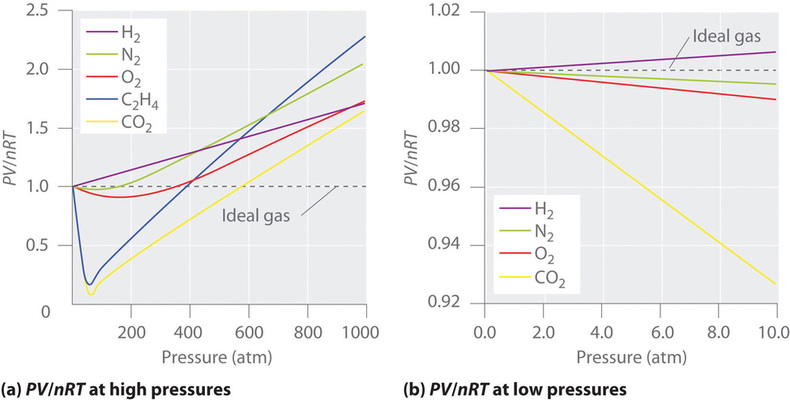
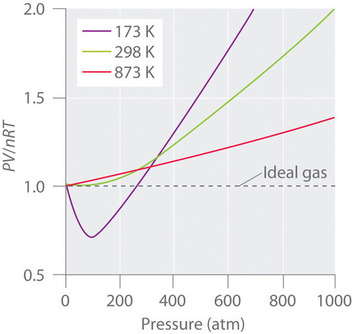
Gazy rzeczywiste również bardziej zbliżają się do zachowania gazu idealnego w wyższych temperaturach, jak pokazano na rysunku ¨PageIndex{2}¨ dla ¨N_2¨. Dlaczego gazy rzeczywiste zachowują się tak różnie od gazów idealnych przy wysokich ciśnieniach i niskich temperaturach? W tych warunkach dwa podstawowe założenia leżące u podstaw prawa gazu idealnego – mianowicie, że cząsteczki gazu mają pomijalną objętość i że oddziaływania międzycząsteczkowe są pomijalne – przestają obowiązywać.
Ponieważ zakłada się, że cząsteczki gazu idealnego mają zerową objętość, objętość dostępna dla nich do ruchu jest zawsze taka sama jak objętość zbiornika. W przeciwieństwie do tego, cząsteczki gazu rzeczywistego mają małe, ale mierzalne objętości. Przy niskich ciśnieniach cząsteczki gazu są stosunkowo daleko od siebie, ale wraz ze wzrostem ciśnienia gazu odległości międzycząsteczkowe stają się coraz mniejsze (rysunek rzedu). W rezultacie objętość zajmowana przez molekuły staje się znacząca w porównaniu z objętością zbiornika. W konsekwencji całkowita objętość zajmowana przez gaz jest większa niż objętość przewidywana przez prawo gazu idealnego. Tak więc przy bardzo wysokich ciśnieniach, eksperymentalnie zmierzona wartość PV/nRT jest większa niż wartość przewidywana przez prawo gazu idealnego.
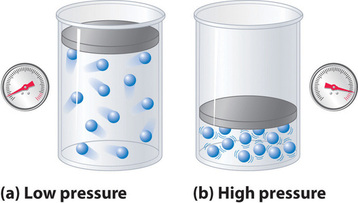
Co więcej, wszystkie molekuły są przyciągane do siebie przez kombinację sił. Siły te stają się szczególnie ważne dla gazów w niskich temperaturach i wysokich ciśnieniach, gdzie odległości międzycząsteczkowe są mniejsze. Oddziaływania przyciągające między cząsteczkami zmniejszają liczbę zderzeń ze ściankami zbiornika, a efekt ten staje się tym wyraźniejszy, im większa jest liczba oddziaływań przyciągających. Ponieważ średnia odległość między cząsteczkami maleje, ciśnienie wywierane przez gaz na ściankę zbiornika maleje, a obserwowane ciśnienie jest mniejsze od oczekiwanego (rysunek \(\)). Jak widać na rysunku, w niskich temperaturach stosunek ∗ PV/nRT jest niższy niż przewidywany dla gazu idealnego, co jest szczególnie widoczne w przypadku gazów złożonych i prostych w niskich temperaturach. Przy bardzo wysokich ciśnieniach dominuje efekt niezerowej objętości molekularnej. Konkurencja pomiędzy tymi efektami jest odpowiedzialna za minimum obserwowane na wykresie zależności objętości cząsteczkowej od ciśnienia dla wielu gazów.
Niezerowa objętość cząsteczkowa sprawia, że rzeczywista objętość jest większa niż przewidywana przy wysokich ciśnieniach; przyciąganie międzycząsteczkowe sprawia, że ciśnienie jest mniejsze niż przewidywane.
W wysokich temperaturach cząsteczki mają wystarczającą energię kinetyczną, aby pokonać międzycząsteczkowe siły przyciągania, a efekty niezerowej objętości cząsteczkowej przeważają. I odwrotnie, w miarę obniżania temperatury, energia kinetyczna cząsteczek gazu maleje. W końcu osiąga się punkt, w którym cząsteczki nie mogą już pokonać międzycząsteczkowych sił przyciągających i gaz skrapla się (kondensuje do postaci ciekłej).