- Co to jest polarne wiązanie kowalencyjne?
- Właściwości polarnych wiązań kowalencyjnych
- Przykłady polarnych wiązań kowalencyjnych
- Woda (H2O)
- chlorek wodoru (HCl)
- Ammonia (NH3)
- Bromek wodoru (HBr)
- Różnica między polarnymi i niepolarnymi wiązaniami kowalencyjnymi
- Polarne wiązanie kowalencyjne vs. Wiązanie kowalencyjne niepolarne
Co to jest polarne wiązanie kowalencyjne?
Wiązanie kowalencyjne jest tworzone, gdy dwa atomy dzielą się elektronami między sobą. Wiązanie kowalencyjne może być polarny, gdy elektrony są nierówno podzielone. The skewness powstaje z powodu różnicy w electronegativities dwóch atomów. Elektronegatywność jest miarą skłonności atomu do przyciągania pary elektronów. Jest ona mierzona za pomocą skali znanej jako skala Paulinga i waha się od 0,7 do 4. Poniższa tabela wyjaśnia typ wiązania chemicznego utworzonego z powodu tej różnicy elektronegatywności .
| Typ wiązania chemicznego | Różnica elektroujemności |
|---|---|
| Kowalencyjne niepolarne | 0 |
| Kowalencyjne lekko polarne | 0.1 do 0,4 |
| Polarne kowalencyjne | 0,5 do 2 |
| Jonowe | > 2 |
Im bardziej znacząca jest różnica w elektroujemności, tym większa jest polarność i siła wiązania. Stąd, polarne wiązania kowalencyjne mają pośrednią siłę wiązania.
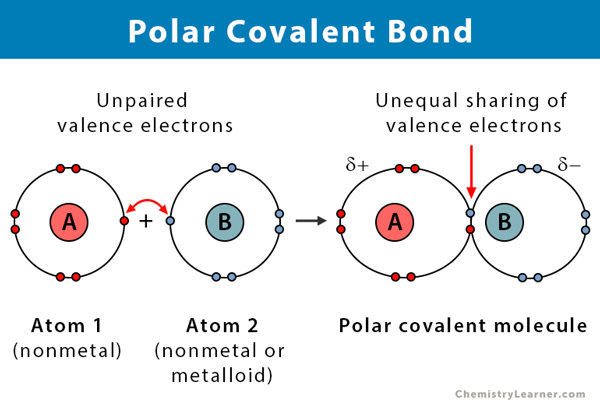
Właściwości polarnych wiązań kowalencyjnych
Oto kilka faktów na temat polarnych wiązań kowalencyjnych.
- Mają miejsce pomiędzy dwoma niemetalami lub pomiędzy niemetalem a metaloidem
- Nierówne dzielenie się elektronami w związku
- Różnica elektroujemności pomiędzy atomami wynosi od 0.1 i 2
- Jeden koniec wiązania jest dodatnio naładowany, a drugi ujemnie naładowany
- Związki polarne rozpuszczają się w polarnym rozpuszczalniku
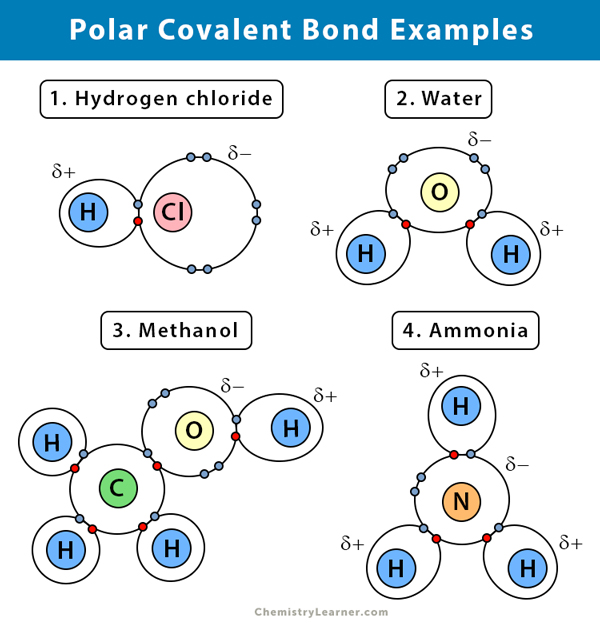
Przykłady polarnych wiązań kowalencyjnych
Oto kilka przykładów polarnych wiązań kowalencyjnych z różnicą elektroujemności pomiędzy dwoma wiążącymi się atomami :
| Nazwa związku | Wzór cząsteczkowy | Wiązanie | Różnica elektroujemności Różnica |
|---|---|---|---|
|
Woda |
H2O |
O-.H |
|
| Fluorowodór | HF | H-F | 1.9 |
| Chlorek wodoru | HCl |
H-Cl |
0.9 |
|
Bromek wodoru |
HBr |
H-.Br |
|
|
Amoniak |
NH3 |
N-.H |
|
|
Dwutlenek siarki |
SO2 | S=O | 1 |
| Siarkowodór | H2S | H-.S | 0.4 |
| Metanol | CH3OH | O-H | 1.4 |
Wyjaśnienie polarnego wiązania kowalencyjnego w niektórych związkach podano poniżej.
Woda (H2O)
Woda jest polarnym rozpuszczalnikiem. Polarne wiązanie kowalencyjne jest tworzone, gdy atom tlenu (O), będąc bardziej elektronegatywny niż wodór, przyciąga wspólne elektrony do siebie. W rezultacie, atom tlenu ma częściowo ujemny ładunek związany z nim. Hydrogeny (H), z drugiej strony, są zasadniczo protonami i mają częściowy ładunek dodatni związany z nimi.
chlorek wodoru (HCl)
chlorek wodoru jest polarnym związkiem kowalencyjnym, ponieważ atom chloru (Cl) jest bardziej elektronegatywny niż atom wodoru (H). Tak więc, chlor niesie częściowy ładunek ujemny, podczas gdy wodór niesie częściowy ładunek dodatni.
Ammonia (NH3)
Ammonia jest cząsteczką polarną. Centralny atom, azotu (N), jest połączony z trzema atomami wodoru (H). Ponieważ N jest bardziej elektroujemny niż H, elektrony będą miały tendencję do zawieszania się wokół atomu N.
Bromek wodoru (HBr)
Różnica w elektroujemności pomiędzy wodorem (H) i bromem (Br) nie jest zbyt duża. Dlatego gaz HBr ma wiązanie kowalencyjne spolaryzowane, a atom wodoru ma niewielki ładunek dodatni, a brom ma niewielki ładunek ujemny. W rezultacie para elektronów jest przyciągana do bromu.
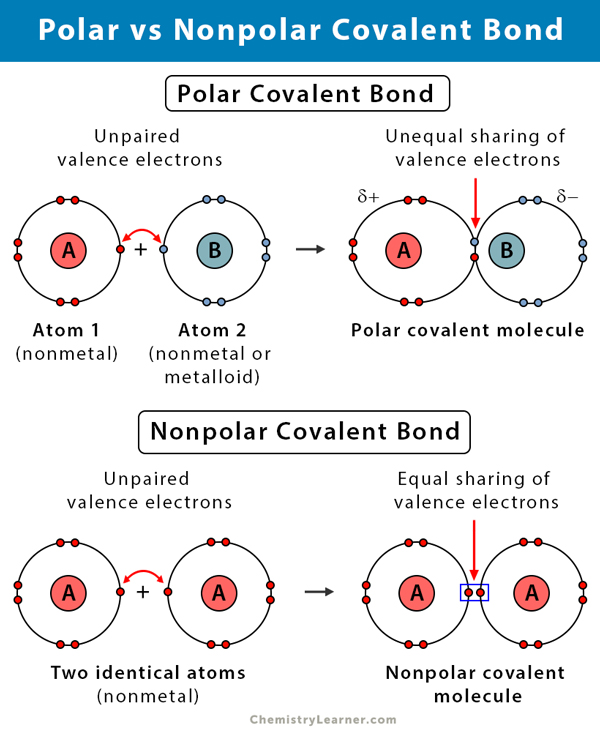
Różnica między polarnymi i niepolarnymi wiązaniami kowalencyjnymi
W poniższej tabeli porównano i skontrastowano polarne i niepolarne wiązania kowalencyjne.
Polarne wiązanie kowalencyjne vs. Wiązanie kowalencyjne niepolarne |
||
| Polarne | Niepolarne | |
|---|---|---|
|
Typy atomów |
Pomiędzy dwoma niemetalami o różnej elektronegatywności |
Między dwoma niemetalami o tej samej elektronegatywności |
|
Różnica elektronegatywności |
0.1 – 2 |
|
|
Rozkład elektronów |
Asymetryczny. Nierówny podział. |
Symetryczny. Równy podział. |
|
Przemieszczenie współdzielonych elektronów |
W kierunku bardziej elektronegatywnego atomu, czyniąc tę część ujemną |
Bez przemieszczenia. Elektrycznie neutralny. |
|
Moment dipolowy |
Nie-.zero |
Zero |
|
Występowanie innych typów wiązań w związkach |
Wiązanie wodorowe |
Wiązanie Van der Waalsa |
|
Przynależność do wody |
Hydrofilowy |
Hydrofobowy |
|
Właściwości fizyczne związków |
Wysokie temperatury topnienia i wrzenia temperatury topnienia i wrzenia |
Niskie temperatury topnienia i wrzenia |
|
Wolność cieczy |
Niska lotność |
Wysoka lotność |
Właściwości fizyczne związków |
|
Rozpuszczalność związków |
Rozpuszczalne w rozpuszczalnikach polarnych |
Rozpuszczalne w rozpuszczalnikach niepolarnych |
|
Przykłady |
Woda (H2O), amoniak (NH3), i chlorowodór (HCl) |
Wodór (H2), tlen (O2), i azot (N2) |
.