- Introduction
- Metody
- Distribution Data and Biome Classification
- Species Composition Among Biomes
- Dane o cechach
- Pomiar hiperwoluminów cech
- Funkcjonalna odrębność i powszechność
- Przestrzeń funkcjonalna i podobieństwo biome
- Wyniki
- Dyskusja
- Braki w wiedzy
- Wspólne wzorce w obrębie biomów
- Porównania między biomami
- Wnioski
- Dostępność danych
- Author Contributions
- Funding
- Oświadczenie o konflikcie interesów
- Podziękowania
- Materiały uzupełniające
Introduction
Ekologowie i biogeografowie organizują bioróżnorodność roślin lądowych w klimatycznie zdeterminowane biomy, o fizjonomiach charakteryzowanych przez formy wzrostu i cechy funkcjonalne dominujących gatunków (Moncrieff et al., 2016). Rzeczywiście, koncepcja biomu ma długą historię sięgającą Carla Ludwiga Willdenowa i Alexandra von Humboldta. Willdenow zauważył, że podobne klimaty wspierają podobne formy roślinności, a Humboldt zaobserwował powszechny związek między rozmieszczeniem roślin, fizjonomią i czynnikami środowiskowymi. Ogólnie rzecz biorąc, koncepcja biomu odzwierciedla założenie, że podobne presje środowiskowe wybierają gatunki o podobnych cechach funkcjonalnych, niezależnie od ich historii ewolucyjnej. Jednocześnie, istniejące na Ziemi biomy są do pewnego stopnia filogenetycznie odrębne, z wieloma/większością charakterystycznych gatunków pochodzących z określonych linii wykazujących kluczowe adaptacje nie tylko do selekcji klimatycznej, ale także do dodatkowych presji, takich jak ogień czy megaherbivores (Woodward i in., 2004; Pennington i in., 2006; Donoghue i Edwards, 2014). Ponieważ biomy reprezentują szerokoskalowe prawidłowości w roślinności Ziemi, zrozumienie różnic funkcjonalnych między biomami jest krytycznie ważne dla modelowania globalnego obiegu węgla i funkcjonowania systemu ziemskiego, w tym odpowiedzi na antropogeniczne zmiany globalne (Bonan i in., 2012; van Bodegom et al., 2014; Xia et al., 2015).
W ciągu ostatnich dwóch dekad nastąpił szybki wzrost w zrozumieniu funkcjonalnego wymiaru różnorodności biologicznej roślin w skalach kontynentalnych (Swenson et al., 2012; Lamanna et al., 2014; Šímová et al., 2018). Szeroko zakrojone wysiłki w zakresie syntezy i analizy danych określiły ograniczoną przestrzeń cech funkcjonalnych obejmującą zmienność w ogólnym rozmiarze roślin, ekonomice liści i hydraulice, znaną jako spektra cech funkcjonalnych (Wright i in., 2004; Díaz i in., 2016). Spektra cech funkcjonalnych określają fizjologiczne i ekologiczne kompromisy, które determinują strategie życiowe roślin (Westoby, 1998; Reich et al., 2003; Craine, 2009) i ich wpływ na tworzenie się zbiorowisk (Kraft et al., 2008), funkcjonowanie ekosystemów (Lavorel i Garnier, 2002; Garnier et al., 2004; Kerkhoff et al., 2005; Cornwell et al., 2008), a nawet tempo ewolucji (Smith i Donoghue, 2008; Smith i Beaulieu, 2009). Ogólność i użyteczność spektrów cech funkcjonalnych roślin przyspieszyła ich włączenie do modeli globalnego rozmieszczenia roślinności (van Bodegom i in., 2014), cykli biogeochemicznych (Bonan i in., 2012) i usług ekosystemowych (Díaz i in., 2007; Cadotte i in., 2011; Lavorel i in., 2011). Jednak niewiele badań dotyczyło kompleksowych miar różnorodności funkcjonalnej w skali biomu, zarówno w odniesieniu do gatunków dominujących, jak i podrzędnych oraz form życia.
Istnieją dwa kontrastujące zestawy przewidywań na temat tego, jak różnorodność funkcjonalna różni się wśród klimatycznie i fizjonomicznie odmiennych biomów. Z jednej strony, jeśli różnorodność biologiczna biomów odzwierciedla zróżnicowanie w dostępnej przestrzeni nisz ekologicznych, mniej zróżnicowane taksonomicznie biomy powinny reprezentować mniejszy, w dużej mierze zagnieżdżony podzbiór przestrzeni funkcjonalnej zajmowanej przez bardziej zróżnicowane biomy. Z drugiej strony, ze względu na globalny charakter podstawowych kompromisów w strukturze i funkcji roślin oraz podobne presje selekcyjne działające podobnie na gatunki, zespoły zajmujące różne środowiska mogą w rzeczywistości dzielić podobne obszary przestrzeni cech (Reich i in., 2003; Wright i in., 2004; Díaz i in., 2016). Ostatnie badania potwierdzają, że relacje między klimatem a różnorodnością funkcjonalną i taksonomiczną (tj. bogactwem gatunkowym) są złożone i zależne od skali. W niektórych przypadkach różnorodność funkcjonalna ściśle podąża za gradientami klimatycznymi, z niższą różnorodnością funkcjonalną w bardziej zmiennych i ekstremalnych warunkach (Swenson i in., 2012; de la Riva i in., 2018), a objętość przestrzeni funkcjonalnej w lokalnych zespołach rozszerza się wraz ze wzrostem bogactwa taksonomicznego (Lamanna i in., 2014; Li i in., 2018). Jednak analizy puli gatunków w skali regionalnej sugerują, że duże zmiany w bogactwie gatunkowym mogą być związane z minimalnym wpływem na różnorodność funkcjonalną (Lamanna i in., 2014; Šímová i in., 2015). Ponadto, reakcje różnorodności taksonomicznej i funkcjonalnej na klimat mogą się różnić wśród głównych form wzrostu roślin (Šímová et al., 2018), a względna różnorodność różnych form wzrostu może się znacząco zmieniać wzdłuż gradientów klimatycznych, które definiują różne biomy (Engemann et al., 2016).
Postęp w analizie różnorodności funkcjonalnej w skalach od kontynentalnej do globalnej został ograniczony częściowo przez braki danych w katalogowaniu taksonomicznych, dystrybucyjnych, filogenetycznych i funkcjonalnych aspektów różnorodności biologicznej (Hortal et al., 2015). Ponadto, nawet biorąc pod uwagę ograniczoną ilość dostępnych danych, istotne wyzwania informatyczne wiążą się ze standaryzacją i integracją dużych, rozbieżnych zbiorów danych opisujących geograficzne rozmieszczenie, cechy funkcjonalne i relacje filogenetyczne gatunków (Violle i in., 2014). Tutaj badamy rozmieszczenie różnorodności funkcjonalnej gatunków roślin w biomach Ameryki Północnej i Południowej przy użyciu bazy danych Botanical Information and Ecology Network (BIEN; Enquist i in., 2016; Maitner i in., 2018), która gromadzi informacje o rozmieszczeniu i cechach funkcjonalnych >100 000 gatunków roślin lądowych. W szczególności badamy zmienność w różnorodności funkcjonalnej i odrębności biomów, w oparciu o mapy rozmieszczenia gatunków roślin lądowych w skali 100 × 100 km komórek siatki i kompleksowy zestaw danych sześciu cech funkcjonalnych, które odzwierciedlają główne osie zmienności w strategiach ekologicznych.
Nasze cele w tym badaniu są 3-krotne. Po pierwsze, w celu podkreślenia trwałych braków danych, dokumentujemy zakres dostępnych danych charakteryzujących funkcjonalną różnorodność i odrębność biomów. Po drugie, biorąc pod uwagę dostępne dane, charakteryzujemy dystrybucję różnorodności funkcjonalnej w obrębie biomów, zarówno wśród dominujących, jak i podrzędnych form wzrostu. Analizy te pozwalają nam na lepszą kwantyfikację funkcjonalnej odrębności biomu poprzez identyfikację najczęstszych strategii funkcjonalnych najbardziej rozpowszechnionych w nim gatunków. Po trzecie, pytamy, czy biomy faktycznie charakteryzują się funkcjonalnie odrębnymi zbiorami gatunków, w oparciu o nakładanie się wielowymiarowych hiperwoluminów w przestrzeni cech funkcjonalnych.
Metody
Distribution Data and Biome Classification
Aby zredukować efekty tendencyjności próbkowania charakterystycznej dla zbiorów danych o występowaniu skompilowanych z wielu źródeł, wykorzystaliśmy mapy zasięgu BIEN 2.0 dla 88 417 gatunków roślin rozmieszczonych w Ameryce Północnej i Południowej (Goldsmith i in., 2016). Baza danych BIEN integruje standaryzowane obserwacje roślin pochodzące z okazów zielnikowych i inwentaryzacji powierzchni roślinnych. Mapy zasięgu gatunków w bazach danych BIEN zostały oszacowane przy użyciu jednego z trzech podejść, w zależności od dostępnych wystąpień dla każdego gatunku. Dla gatunków, które występują tylko jeden lub dwa razy (ok. 35% gatunków), zasięg geograficzny został zdefiniowany jako kwadratowy obszar o powierzchni 75 000 km2 otaczający każdy punkt danych. Zasięgi geograficzne dla gatunków występujących trzy lub cztery razy określono przy użyciu kadłuba wypukłego (ok. 15% gatunków). Ostatecznie, mapy zasięgów dla gatunków z co najmniej pięcioma wystąpieniami uzyskano przy użyciu algorytmu modelowania rozmieszczenia gatunków Maxent, wykorzystując 19 warstw klimatycznych jako zmiennych predykcyjnych i 19 przestrzennych wektorów własnych jako filtrów ograniczających przewidywania modeli (zob. Goldsmith i in, 2016 dla dalszych szczegółów na temat metodologii map zasięgu).
Nałożyliśmy mapy gatunków roślin BIEN 2.0 na mapę siatki 100 × 100 km z projekcją Lambert Azimuthal Equal Area, aby uzyskać macierz obecności/nieobecności gatunków dla każdej komórki siatki. W oparciu o klasyfikację biomów Olsona et al. (2001), przypisaliśmy każdą komórkę macierzy do jednej z kategorii biomów. Ze względu na ograniczenia obliczeniowe dla późniejszych analiz, połączyliśmy niektóre biomy w oparciu o ich podobieństwa w klimacie, roślinności i literaturze, aby uzyskać szeroką klasyfikację opisaną w Tabeli 1 (z wyłączeniem wód śródlądowych, skał i lodu oraz namorzynów). Ekoregiony Chaco i Caatinga zostały sklasyfikowane jako Xeric Woodlands i Dry forest, odpowiednio, za Prado i Gibbs (1993), Pennington et al. (2000), Banda et al. (2016), Silva de Miranda et al. (2018).
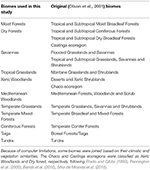
Tabela 1. Przegląd klasyfikacji biomów przyjętej w tym badaniu i równoważnej (Olson et al., 2001) klasyfikacji biomów (z wyłączeniem Inland Water, Rock and Ice, and Mangroves).
Species Composition Among Biomes
Aby zrozumieć zróżnicowanie przestrzeni cech funkcjonalnych wśród biomów, najpierw zbadaliśmy różnice w składzie gatunkowym roślin wśród nich. W oparciu o listę gatunków dla każdej komórki siatki i biomu, zdefiniowaliśmy charakterystyczne gatunki każdego biomu jako te, które mają maksymalną część ich zasięgu w tym biomie. Te listy gatunków geograficznie dominujących w danym biomie zostały porównane z listami gatunków w innych biomach. To porównanie parami zapewnia prosty sposób na wnioskowanie o kierunkowym taksonomicznym nakładaniu się biomów (tj. proporcja gatunków dominujących w danym biomie dzielona z innym biomem). Spośród 88 417 gatunków z dostępnymi mapami zasięgu, 44 899 gatunków ma zasięgi obejmujące więcej niż jeden bios, a 43 518 gatunków jest endemicznych dla konkretnego biosu.
Dane o cechach
Wyekstrahowaliśmy wszystkie informacje o cechach dla gatunków roślin w Nowym Świecie dostępne w zbiorze danych BIEN 3.0 (pobrane 7 lutego 2018 r.), dając w sumie 80 405 obserwacji cech poziomów gatunkowych. Następnie przefiltrowaliśmy informacje dla sześciu cech funkcjonalnych: maksymalna wysokość roślin (m), masa nasion (mg), gęstość drewna (mg/cm3), powierzchnia właściwa liści SLA (cm2/g) oraz stężenie fosforu i azotu w liściach na jednostkę masy (mg/g). W sumie po filtrowaniu pozostało 18 192 obserwacji na poziomie gatunku. Spośród nich, podzbiór 8 820 gatunków z mapami zasięgu i informacjami o cechach został wykorzystany do dalszych analiz.
Aby oszacować przestrzeń cech funkcjonalnych dla każdego biomu, potrzebowaliśmy kompletnych danych o cechach. Z tego powodu dokonaliśmy imputacji filogenetycznej brakujących danych o cechach (Bruggeman i in., 2009; Penone i in., 2014; Swenson, 2014; Swenson i in., 2017) przy użyciu pakietu R “Rphylopars” v 0.2.9 (Goolsby i in., 2017) oraz niedawno opublikowanej filogenezy roślin nasiennych autorstwa Smitha i Browna (2018) jako linii bazowej. Imputacja filogenetyczna jest narzędziem do przewidywania brakujących danych w zestawach danych cech funkcjonalnych w oparciu o założenie, że blisko spokrewnione gatunki mają tendencję do posiadania podobnych wartości cech (Swenson, 2014). Użyliśmy drzewa ALLBM (tj. banku genów i taksonów Open Tree of life ze szkieletem dostarczonym przez Magallón et al., 2015), ponieważ maksymalizowało ono nakładanie się gatunków z dostępną informacją o cechach i dystrybucji. Po imputacji cech, w sumie 7 842 gatunki z kompletną informacją o cechach i mapami zasięgu pozostały do dalszej analizy.
Pomiar hiperwoluminów cech
Pomierzyliśmy względną różnorodność funkcjonalną biomów poprzez obliczenie hiperwoluminów cech z puli gatunków w obrębie komórek biomów. Ze względu na ograniczenia obliczeniowe, skonstruowaliśmy hiperwolumeny cech używając losowej próbki 20% komórek w każdym biomie. Hiperwoluminy dla każdej komórki siatki zostały oszacowane przy użyciu wyodrębnionych sześciu cech funkcjonalnych i pakietu R “hypervolume” (Blonder i in., 2014, 2018), przy użyciu gaussowskiej metody KDE z domyślnym estymatorem szerokości pasma Silvermana. Masa nasienna, wysokość i gęstość drewna zostały przekształcone w log-transformację, podczas gdy SLA została przekształcona w kwadrat-root. Wszystkie cechy zostały przeskalowane i wyśrodkowane przed analizą. Hiperwolumeny podano w jednostkach odchylenia standardowego (sd) do potęgi liczby użytych cech (tj. sd6).
Funkcjonalna odrębność i powszechność
Ponieważ biomy są charakteryzowane przez ich dominującą roślinność, zbadaliśmy również geograficzną powszechność i funkcjonalną odrębność gatunków w obrębie biomów. Wykorzystując mapy zasięgu gatunków i informacje o cechach funkcjonalnych, oszacowaliśmy odrębność funkcjonalną i rozpowszechnienie każdego gatunku w każdym biomie, zgodnie z ramami koncepcyjnymi rzadkości funkcjonalnej autorstwa Violle et al. (2017). Wykorzystując cały zestaw (zmierzonych i imputowanych) cech, najpierw zmierzyliśmy odległość euklidesową w standaryzowanej przestrzeni cech pomiędzy wszystkimi parami gatunków. Następnie obliczyliśmy odrębność funkcjonalną (Di) dla każdego gatunku w każdym biome’ie jako średnią odległość funkcjonalną gatunku do N innych gatunków w ramach puli gatunkowej danego biome’u. Di było skalowane pomiędzy 0 a 1 w każdym biome, gdzie niższe wartości reprezentowały gatunki, które są funkcjonalnie wspólne (redundantne), a wyższe wartości reprezentowały gatunki, które są funkcjonalnie wyróżniające się, w porównaniu z innymi gatunkami w danym biome. Oszacowaliśmy również geograficzną powszechność (Wi) gatunku w danym biome, mierzoną jako liczba komórek siatki zajmowanych przez gatunek w danym biome w stosunku do całkowitej liczby komórek w tym biome. Wartość 1 wskazuje, że gatunek główny jest obecny we wszystkich komórkach siatki objętych danym biosomem. Zarówno odrębność funkcjonalna, jak i geograficzna powszechność zostały obliczone przy użyciu pakietu R “funrar” (Grenié i in., 2017).
Ponieważ brakuje nam kompleksowych miar dominacji opartych na lokalnej liczebności lub biomasie, użyliśmy miar Di i Wi, aby zidentyfikować dla każdego biomu najbardziej “powszechne” gatunki jako te, które są zarówno geograficznie powszechne (Wi > 0,5), jak i funkcjonalnie podobne (Di < 0,25). Ten ostatni próg został zastosowany, ponieważ trzeci kwantyl wartości funkcjonalnej odrębności wśród biomów wahał się od 0,2 do 0,3. Aby rozróżnić gatunki funkcjonalnie odrębne od gatunków funkcjonalnie podobnych w kolejnych analizach, zastosowaliśmy wartość 0,25 jako próg odcięcia (tzn, gatunki o wartości rozróżnialności < 0.25 uznano za funkcjonalnie wspólne lub redundantne w obrębie danego biomu).
Przestrzeń funkcjonalna i podobieństwo biome
Aby oszacować nakładanie się hiperwoluminów biomów zastosowaliśmy indeks podobieństwa Sørensena wykorzystując (i) całkowitą liczbę gatunków oraz (ii) listę gatunków uznanych za funkcjonalnie wspólne i geograficznie szeroko rozpowszechnione dla każdego biomu. Podobieństwo przestrzeni cech funkcjonalnych zostało obliczone jako ułamkowe nakładanie się hiperwoluminów pomiędzy biomami. Ułamkowe nakładanie się obliczono dzieląc dwukrotną objętość przecięcia dwóch hiperwoluminów przez objętość ich związków. Wszystkie hiperwolumeny zostały oszacowane przy użyciu pakietu R “hypervolume” (Blonder i in., 2014, 2018), przy użyciu gaussowskiej metody KDE z domyślnym estymatorem szerokości pasma Silvermana.
Wyniki
Znaleźliśmy znaczne nakładanie się składu gatunkowego roślin w różnych biomach, w oparciu o przecięcie modelowanych zasięgów gatunków (patrz Ryc. 1 i Tabela uzupełniająca 1). To taksonomiczne nakładanie się jest większe w obrębie biomów tropikalnych i umiarkowanych, przy czym stosunkowo niewiele gatunków jest wspólnych dla tych dwóch stref klimatycznych. Co ciekawe, lasy kserotermiczne dzielą gatunki zarówno z biomami tropikalnymi, jak i umiarkowanymi. Pomimo wysokiego udziału gatunków charakterystycznych dla tropikalnego lasu wilgotnego (83%), biosystem ten dzieli również dużą liczbę gatunków z innymi biomami tropikalnymi, takimi jak lasy suche, sawanny, lasy kserotermiczne i tropikalne łąki. Wysoki stopień pokrywania się taksonomicznego biomów umiarkowanych, takich jak umiarkowane obszary trawiaste, śródziemnomorskie obszary leśne, tajga i tundra sugeruje możliwość niskiej odrębności funkcjonalnej, z niektórymi biomami umiarkowanymi reprezentującymi uboższy podzbiór bardziej bogatych w gatunki, zróżnicowanych funkcjonalnie biomów tropikalnych.
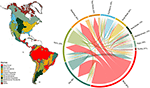
Rysunek 1. Pokrywanie się gatunków roślin w biomach Nowego Świata. Wartości procentowe wyrażają frakcję gatunków występujących w danym biomie, które mają największą część swojego zasięgu geograficznego w tym biomie, N = 84,413. Podstawa każdej rozgałęzionej strzałki jest ustawiona tak, aby wskazywała biosom, który obejmuje największą część zasięgu gatunku, podczas gdy szerokość reprezentuje liczbę gatunków wspólnych z biomami na końcach strzałki. Zobacz tabelę uzupełniającą 1 dla podstawowej matrycy.
Przy mniej niż 10% odwzorowanych gatunków reprezentowanych, dane dotyczące cech były dość skąpe dla naszych zespołów gatunków w skali biomechanicznej (Figura 2A). Co więcej, dostępne dane o cechach różniły się znacząco w zależności od cech, kladów roślin i biomów. Filogenetycznie, P liści i gęstość drewna były szczególnie słabo reprezentowane, a całe klady nie posiadały żadnych dostępnych danych. W rezultacie, z około 2/3 wartości cech dla naszych 7,842 gatunków, które musiały być imputowane, wiele musiało być przypisanych przy braku jakichkolwiek blisko spokrewnionych taksonów. Geograficznie, SLA, wysokość i masa nasion są niedostatecznie reprezentowane w tropikach i umiarkowanej Ameryce Południowej, podczas gdy N liści i gęstość drewna są bardziej równomiernie reprezentowane w różnych regionach. P z liści jest słabo próbkowany we wszystkich biomach. Hiperwolumeny cech utworzone z puli gatunkowych losowo wybranych 20% komórek dla każdego biomu wykazują głównie różnice pomiędzy biomami tropikalnymi i umiarkowanymi/zimnymi (Rysunek 2B). Hiperwolumeny cech są większe i bardziej zmienne w biomach tropikalnych, z największą zmiennością w wilgotnych i suchych lasach tropikalnych. Wśród biomów umiarkowanych/zimnych największe hiperwolumeny cech wykazują lasy iglaste i umiarkowane lasy mieszane. Co ciekawe, kserotermiczne krzewy wykazują dystrybucję hiperwoluminów bardziej podobną do biomów tropikalnych niż umiarkowanych.
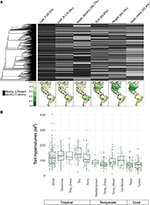
Rysunek 2. (A) Proporcja gatunków w bazie danych BIEN 3.0 ze znanymi (szary) lub brakującymi (czarny) wartościami cech. Filogeneza po lewej stronie odpowiada drzewu ALLBM roślin nasiennych ze Smith i Brown (2018) (tj. taksony z GenBank i Open Tree of life ze szkieletem dostarczonym przez Magallón et al., 2015). Mapy reprezentują proporcję gatunków z informacją o cechach w stosunku do całkowitej liczby gatunków w bazie danych BIEN 2.0. (B) Dystrybucja hiperwoluminów cech dla 20% losowo wybranych komórek o wymiarach 100 × 100 km w każdym biome. Hiperwoluminy podano w jednostkach odchylenia standardowego do potęgi liczby użytych cech.
Zależność między funkcjonalną odrębnością a rozmieszczeniem geograficznym jest nadzwyczaj podobna wśród biomów (Ryc. 3). W każdym biomie zdecydowana większość gatunków jest zarówno ograniczona geograficznie, jak i podobna funkcjonalnie. Jednocześnie, najbardziej wyróżniające się funkcjonalnie gatunki w obrębie każdego biomu były generalnie również ograniczone geograficznie, a najbardziej rozpowszechnione geograficznie gatunki były prawie zawsze podobne funkcjonalnie.
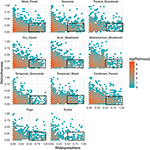
Rysunek 3. Wzorce odrębności funkcjonalnej w poszczególnych biomach. Odrębność reprezentuje jak bardzo gatunki są funkcjonalnie odległe od siebie w obrębie danego biomu (tj. średnia parami fenotypowa odległość od gatunku ogniskowego do wszystkich pozostałych). Im większa wartość, tym bardziej gatunek jest odległy od środka przestrzeni funkcjonalnej biomu. Rozprzestrzenienie mierzy jak bardzo dany gatunek jest geograficznie powszechny w obrębie danego biomu. Wartość 0 oznacza, że dany gatunek jest obecny w pojedynczej komórce biomu. Wartości kosza to liczba gatunków w skali logarytmicznej. Prostokąty reprezentują gatunki, które są uważane za funkcjonalnie podobne i szeroko rozpowszechnione w każdym biome, przy zastosowaniu wartości odcięcia odpowiednio 0,25 i 0,5 odrębności i powszechności.
Stwierdziliśmy znaczne zróżnicowanie w proporcjonalnym rozkładzie form wzrostu w obrębie i pomiędzy biomami. Gatunki drzewiaste stanowią dominujące formy wzrostu w biomach tropikalnych pod względem liczby gatunków, podczas gdy gatunki zielne dominują w środowiskach umiarkowanych (Ryc. 4). Gdy wzięliśmy pod uwagę tylko te gatunki, które są szeroko rozpowszechnione i funkcjonalnie wspólne w każdym biomie, rozkład form wzrostu w poszczególnych biomach zmienił się, szczególnie w proporcji drzew, ziół i traw. Na przykład, w biomach tropikalnych udział drzew zmniejszył się w każdym biomie z wyjątkiem lasu wilgotnego. W biomach umiarkowanych wzrósł udział traw, szczególnie w kierunku regionów polarnych. Co ciekawe, rozkład form wzrostu w lasach kserotermicznych bardziej przypomina rozkład w biomach umiarkowanych, gdy bierze się pod uwagę tylko gatunki szeroko rozpowszechnione i funkcjonalnie pospolite.
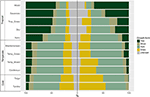
Rysunek 4. Dystrybucja form wzrostu w każdym biomie (po lewej) z wykorzystaniem całkowitej liczby gatunków i (po prawej) z wykorzystaniem tylko tych gatunków, które są funkcjonalnie podobne i szeroko rozpowszechnione w obrębie danego biomu (patrz Ryc. 3).
Parowe porównania składu gatunkowego pomiędzy biomami ujawniają trzy główne skupiska reprezentujące tropikalne, umiarkowane i polarne strefy klimatyczne (Ryc. 5A), odzwierciedlające duże nakładanie się taksonomiczne w obrębie tych regionów, ale nie pomiędzy nimi (Ryc. 1). Porównania parami hiperwoluminów cech pomiędzy biomami pokazują mniej wyraźne grupowanie stref klimatycznych (Rysunek 5B). W tym przypadku przestrzeń funkcjonalna lasów kserotermicznych pokrywa się znacząco z biomami strefy umiarkowanej. Analiza ta ujawnia również pokrywanie się przestrzeni funkcjonalnej tajgi z umiarkowanymi użytkami zielonymi i lasami mieszanymi. Porównanie parami hiperwoluminów cech pomiędzy biomami z wykorzystaniem tylko tych gatunków, które uznano za funkcjonalnie pospolite i szeroko rozpowszechnione pokazuje mniejsze nakładanie się przestrzeni cech pomiędzy i w obrębie stref klimatycznych (Ryc. 5C). Jednakże, mimo że lasy kserotermiczne są obecnie zgrupowane z resztą biomów tropikalnych, siedliska te wraz z tropikalnymi użytkami zielonymi wykazują duże nakładanie się w przestrzeni funkcjonalnej z biomami umiarkowanymi, takimi jak śródziemnomorskie lasy i umiarkowane użytki zielone.
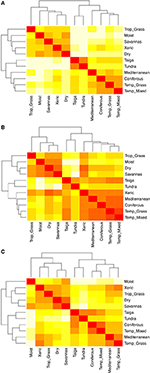
Rysunek 5. (A) Podobieństwo parami w składzie gatunkowym pomiędzy biomami. (B) Podobieństwo parami w hiperwoluminach cech (podobieństwo 1-Sørensena) między biomami z wykorzystaniem całkowitej liczby gatunków. (C) Podobieństwo parami w hiperwoluminach cech (podobieństwo 1-Sørensena) między biomami z wykorzystaniem tylko tych gatunków, które są uważane za funkcjonalnie podobne i szeroko rozpowszechnione. Im jaśniejsza komórka, tym większe podobieństwo.
Dyskusja
Nasze analizy przynoszą trzy ważne spostrzeżenia dla zrozumienia biomów lądowych poprzez obiektyw funkcjonalny. Po pierwsze, pokazujemy, że pomimo postępu w kompilacji i syntezie danych dotyczących pierwotnej różnorodności biologicznej, nadal istnieją znaczne braki w wiedzy, które mogą ograniczyć naszą zdolność do ilościowego określenia funkcjonalnej różnorodności biologicznej biomów w skalach od kontynentalnej do globalnej. Po drugie, nasze analizy dostępnych danych pokazują, że wszystkie biomy w Ameryce Północnej i Południowej mają niezwykły wspólny wzorzec, w którym najbardziej rozpowszechnione geograficznie gatunki w każdym biomie mają tendencję do dzielenia się wspólnymi cechami funkcjonalnymi, podczas gdy najbardziej wyróżniające się funkcjonalnie gatunki są niezmiennie ograniczone w swoim rozmieszczeniu. Po trzecie, gdy bierze się pod uwagę tylko gatunki szeroko rozpowszechnione i funkcjonalnie wspólne, biomy można łatwiej rozróżnić pod względem funkcjonalnym, a wzorce odmienności między biomami wydają się odzwierciedlać związek między klimatem a przestrzenią nisz funkcjonalnych roślin. Łącznie, nasze wyniki sugerują, że podczas gdy badanie różnorodności funkcjonalnej biomów jest wciąż w fazie formalnej, dalszy rozwój tej dziedziny prawdopodobnie przyniesie wgląd w ewolucję, biogeografię, tworzenie społeczności i funkcję ekosystemu.
Braki w wiedzy
Baza danych BIEN jest specjalnie zaprojektowana, aby wypełnić luki w naszej wiedzy na temat różnorodności biologicznej roślin, jednak jak wskazują Hortal et al. (2015), współdziałające braki w wiedzy prowadzą do niepewności w kwantyfikacji różnorodności biologicznej w największych skalach. Na przykład, nie tylko mniej niż 10% naszych zmapowanych gatunków miało dostępne zarówno dane o cechach, jak i informacje filogenetyczne, ale te brakujące dane o cechach (~66% wartości cech gatunków) były dość ustrukturyzowane, zarówno filogenetycznie, jak i geograficznie. W ten sposób Raunkiaerowski niedobór danych o cechach funkcjonalnych (sensu Hortal et al., 2015) współgra z Wallace’owskim niedoborem informacji o rozmieszczeniu oraz Darwinowskim niedoborem zrozumienia filogenetycznego. I choć możemy wykorzystać wiedzę filogenetyczną do rozsądnej imputacji tych brakujących wartości (Swenson i in., 2017), kilka aspektów wynikających z tego wzorców, które są ważne dla klasyfikacji biome’ów, pozostaje niepewnych. Na przykład, istniejące dane dotyczące form wzrostu sugerują, że gatunki drzewiaste dominują we wszystkich biomach tropikalnych, podczas gdy proporcjonalna różnorodność zielnych form wzrostu jest znacznie wyższa w biomach umiarkowanych i polarnych (patrz także Engemann i in., 2016; Zanne i in., 2018). Czy ten równoleżnikowy wzrost względnej różnorodności roślin zielnych odzwierciedla błędy w pobieraniu próbek i brak wiedzy taksonomicznej na temat tropikalnych roślin zielnych, czy też odzwierciedla różne historie ewolucyjne i biogeograficzne w obszarach bliskowschodnich i neotropikalnych? Dominujące formy wzrostu są jedną z kluczowych cech wyróżniających biomy, więc systematyczne zmiany w najbardziej zróżnicowanych formach wzrostu (dominujących lub nie) z pewnością wpłyną na nasze przewidywania dotyczące tego, jak różnorodność funkcjonalna może się zmienić w różnych biomach i jak te zmiany wpłyną na funkcje ekosystemu i usługi.
Użyliśmy map zasięgów gatunków jako danych wejściowych głównie w celu przezwyciężenia niezaprzeczalnego problemu błędu próbkowania, który jest charakterystyczny dla zbiorów danych skompilowanych z wielu źródeł (patrz Rysunek 1). Jednakże mapy zasięgów opracowane na podstawie modeli rozmieszczenia gatunków mogą stanowić dodatkowy element niepewności w naszych wynikach. Na przykład, biorąc pod uwagę rozdzielczość geograficzną tego badania i złożoność przestrzenną niektórych biomów, modele te mogły przeszacować zasięg geograficzny niektórych gatunków z komórek pojedynczego biomu do komórek pobliskich i wzajemnie przenikających się biomów. Wykorzystanie danych o występowaniu nie zmieniło ogólnych wyników tego badania (patrz ryciny uzupełniające 2-6); jednak nieznaczne zmniejszenie funkcjonalnego pokrywania się biomów mogłoby rzeczywiście ujawnić przeszacowanie zasięgów niektórych gatunków (patrz ryciny uzupełniające 2, 5 i 6). Wykorzystanie informacji o występowaniu również zmieniło ogólne relacje pomiędzy funkcjonalną odrębnością i rozpowszechnieniem w naszych wynikach, ze względu na względną nadpróbkowalność regionów umiarkowanych w stosunku do tropikalnych (patrz Ryc. 4). W tym przypadku, nasza miara rozpowszechnienia jest ograniczona przez bardzo ograniczone próbkowanie większości gatunków w biomach tropikalnych. Ponieważ zestawy danych i próbkowanie poprawiają się, prawdopodobnie istnieje możliwość zmniejszenia tych niepewności w przyszłości.
Inną luką w danych, która musi zostać rozwiązana, aby zrozumieć różnorodność funkcjonalną biomów, jest prestoński niedobór informacji o liczebności. Liczebność jest szczególnie ważna w badaniach nad różnorodnością funkcjonalną, ponieważ cechy, które mają największe znaczenie dla tworzenia społeczności, funkcjonowania ekosystemu i cykli biogeochemicznych są cechami najbardziej dominujących gatunków. Ponieważ oparliśmy nasze asamblaże na mapach zasięgu pochodzących z modeli rozmieszczenia gatunków, mogliśmy odnieść się jedynie do geograficznego komponentu powszechności, ale pozytywna relacja pomiędzy lokalną liczebnością a zasięgiem geograficznym, tzw. relacja zajętość-obfitość, sugeruje, że najbardziej rozpowszechnione gatunki w każdym biomacie mogą być często również jednymi z bardziej obfitych (Borregaard i Rahbek, 2010; Novosolov i in., 2017). Ponieważ biomy są generalnie charakteryzowane przez dominujące formy wzrostu w regionie, integracja informacji o liczebności może skutkować biomami wykazującymi mniejsze nakładanie się funkcjonalne. Jednakże, nawet jeśli BIEN zebrał obszerne dane dotyczące powierzchni, które pozwalają na oszacowanie lokalnej liczebności, dokonywanie rozsądnych porównań między różnymi regionami i formami wzrostu jest utrudnione przez nierównomierne pobieranie próbek, regionalne różnice w różnorodności gamma i niewspółmierne metody ilościowego określania liczebności.
Wspólne wzorce w obrębie biomów
Pomimo utrzymujących się luk w dostępnych danych, nasze analizy ujawniły wcześniej nieudokumentowany związek wspólny dla wszystkich biomów Półkuli Zachodniej: w każdym biomie, najbardziej rozpowszechnione gatunki wykazują również tendencję do wykazywania niskiej funkcjonalnej odrębności, podczas gdy najbardziej funkcjonalnie odrębne gatunki są prawie niezmiennie ograniczone w swoim rozmieszczeniu (Ryc. 3). Ta zależność “zajętość-redundancja” może sugerować, że warunki klimatyczne panujące w danym biome wybierają zestaw wspólnych cech, a gatunki bardziej funkcjonalnie wyróżniające się są ograniczone do rzadszego podzbioru siedlisk w obrębie biome. Ogólna przewaga funkcjonalnie podobnych gatunków we wszystkich biomach oraz zależność “zajętość-redundancja” są zgodne z niedawną globalną analizą różnorodności funkcjonalnej na poziomie społeczności, która sugeruje, że filtrowanie siedlisk prowadzi do koegzystencji funkcjonalnie podobnych gatunków (Li i in., 2018), a także z badaniami pokazującymi, że redundancja funkcjonalna zwiększa stabilność społeczności (np. Walker i in., 1999; Pillar i in., 2013). Ponadto, wraz z wysokim stopniem zarówno taksonomicznego, jak i funkcjonalnego pokrywania się między biomami (Ryc. 1, 5), fakt, że wspólne, szeroko rozpowszechnione gatunki są funkcjonalnie podobne, wzmacnia pogląd, że rośliny lądowe w szerokim zakresie warunków środowiskowych mają wspólne cechy w pobliżu rdzenia spektrum cech funkcjonalnych (Wright i in., 2004; Díaz i in., 2016). W przeciwieństwie do Umaña et al. (2017), nasze wyniki pokazują, że rzadkie, ograniczone geograficznie gatunki mogą, ale nie muszą, różnić się funkcjonalnie od bardziej rozpowszechnionych i powszechnych gatunków. Tak więc otwartym pozostaje pytanie, czy bardziej funkcjonalnie wyróżniające się gatunki są specjalistami w poszczególnych środowiskach, czy też ich kombinacje cech powodują demograficzne lub fizjologiczne kompromisy, które ograniczają ich geograficzną dystrybucję.
Porównania między biomami
Nasze porównanie rozkładów hiperobjętości cech w różnych biomach (Rysunek 2B) jest zgodne z obserwacją, że środowiska bardziej bogate gatunkowo są również bardziej zróżnicowane funkcjonalnie (Swenson i in, 2012; Lamanna et al., 2014; Li et al., 2018; Šímová et al., 2018). Nasze wyniki są bardziej niejednoznaczne w odniesieniu do hipotezy, że sezonowe i ekstremalne środowiska klimatyczne konsekwentnie ograniczają różnorodność funkcjonalną gatunków (de la Riva i in., 2018). Wszystkie biomy tropikalne wykazują wyższą średnią różnorodność funkcjonalną niż wszystkie biomy umiarkowane, a biomy polarne rzeczywiście wykazują najmniejsze hiperwolumeny. Jednakże, w obrębie każdej grupy, suchsze lub bardziej zmienne sezonowo biomy nie zawsze wykazują mniejsze hiperwolumeny (np. suche lasy, lasy kserotermiczne), jak oczekiwalibyśmy zgodnie z hipotezą tolerancji Currie et al. (2004), podczas gdy optymalne warunki klimatyczne wspierają więcej kombinacji parametrów fizjologicznych. Tylko na podstawie tych wyników nie możemy stwierdzić, czy biomy umiarkowane i polarne są mniej zróżnicowane taksonomicznie z powodu ograniczeń przestrzeni nisz funkcjonalnych, czy też ich hiperwolumeny funkcjonalne są małe, ponieważ nie są zróżnicowane taksonomicznie. Podejścia modelowania zerowego mogłyby potencjalnie pomóc w rozdzieleniu różnorodności taksonomicznej i funkcjonalnej (Swenson et al., 2012; Lamanna et al., 2014; Šímová et al., 2018), ale taka analiza wykraczała poza zakres tego badania. Co ważniejsze, nasze wyniki wzmacniają znaczenie zrozumienia, w jaki sposób historia ewolucyjna i biogeograficzna kształtują różnorodność funkcjonalną biomów (Woodward i in., 2004; Pennington i in., 2006; Donoghue i Edwards, 2014; Moncrieff i in., 2016). Rozległa wymiana gatunków (i wyższych linii) między biomami w obrębie różnych obszarów biogeograficznych, ale w dużej mierze nie między nimi, może służyć zarówno do ujednolicenia różnorodności funkcjonalnej w obrębie obszarów, jak i do dostarczenia wskazówek na temat charakterystycznych cech, które są wybierane lub odrzucane przez różne środowiska (Douma i in., 2012; Zanne i in., 2014, 2018).
Pomimo znacznego nakładania się hiperobjętości wśród wszystkich biomów (Supplementary Figure 2), biomy tropikalne, umiarkowane i zimne wydają się zajmować rozróżnialne regiony przestrzeni funkcjonalnej (Ryc. 5B,C). Głównymi cechami różnicującymi biomy wydają się być cechy związane z ogólnym rozmiarem roślin, w tym zarówno wysokość dojrzałych roślin, jak i masa nasion (Ryc. 7-10), a nie cechy związane z ekonomiką liści, jak zaobserwowano w bardziej lokalnych analizach opartych na powierzchni (np. Douma i in., 2012). Wyjątkiem jest P liści, które wykazywało znaczące różnice pomiędzy biomami tropikalnymi i umiarkowanymi/polarnymi (Ryc. 7-10), co zostało zaobserwowane w innych analizach opartych zarówno na wartościach specyficznych dla danego gatunku, jak i pomiarach całego ekosystemu (Kerkhoff i in., 2005; Swenson i in., 2012). Ponieważ P liści było najrzadziej próbkowaną cechą, różnice pomiędzy tropikalnymi i umiarkowanymi/polarnymi obszarami mogą być przedmiotem błędów wynikających z procedury imputacji. Jednakże, P liści wykazuje znaczący sygnał filogenetyczny (Kerkhoff i in., 2006), co sugeruje, że imputacje powinny być nieobiektywne (Swenson i in., 2017). P liści jest również znacznie wyższe w zielnych formach wzrostu (Kerkhoff i in., 2006), więc przesunięcie równoleżnikowe z dominującej różnorodności drzewiastej do zielnej (Ryc. 4) może również wpływać na ten wzór.
Gdy ograniczyliśmy analizy hiperobjętości tylko do najbardziej rozpowszechnionych i funkcjonalnie powszechnych gatunków w każdym biome, poszczególne biomy w ramach każdej sfery biogeograficznej nakładały się mniej w przestrzeni cech funkcjonalnych (porównaj Ryc. 5B,C), co sugeruje, że te gatunki mogą odzwierciedlać fenotypy lepiej przystosowane do poszczególnych środowisk. W tym kontekście szczególnie interesujący jest biosfera lasów kserotermicznych. Częściowo z powodu włączenia ekoregionu Chaco, taksonomicznie lasy kserotermiczne łączą się z biomami tropikalnymi (Ryc. 5A). Jednak gdy weźmie się pod uwagę hiperwolumeny funkcjonalne wszystkich gatunków, wykazują one znacznie większe podobieństwo do biomów umiarkowanych (Ryc. 5B). Wreszcie, gdy analizowane są tylko najbardziej rozpowszechnione i funkcjonalnie powszechne gatunki, lasy kserotermiczne ponownie wykazują zwiększone podobieństwo do biomów tropikalnych, ale także utrzymują wysokie podobieństwo do umiarkowanych biomów trawiastych i śródziemnomorskich (Ryc. 5C). Przejścia z ciepłych, mezycznych środowisk do zimniejszych, suchszych i bardziej sezonowych są ułatwione dzięki podobnym cechom, np. zielnemu pokrojowi (Douma i in., 2012; Zanne i in., 2014, 2018), a podobnie jak w przypadku zimniejszych środowisk, zbiorowiska w suchych środowiskach również mają tendencję do większego skupienia filogenetycznego (Qian i Sandel, 2017). Co więcej, położenie stref kserotermicznych na granicy międzyzwrotnikowej strefy konwergencji sprawia, że stanowią one geograficzne przejście między sferą tropikalną i umiarkowaną. Fakt, że lasy kserotermiczne są pośrednie między sferą tropikalną i umiarkowaną zarówno pod względem funkcjonalnym, jak i biogeograficznym, dodatkowo wzmacnia ideę, że aby lepiej zrozumieć zróżnicowanie funkcjonalne biomów, musimy wziąć pod uwagę ich historie biogeograficzne i filogenetyczne (Pennington i in., 2006; Donoghue i Edwards, 2014; Moncrieff i in., 2016).
Wnioski
Każda klasyfikacja biomów lądowych nakłada niewielką liczbę dyskretnych kategorii na ciągłe gradienty w klimacie i rozmieszczeniu gatunków, a zatem stanowi rażące uproszczenie złożonego krajobrazu ekologicznego (Moncrieff i in., 2016, ale patrz Silva de Miranda i in., 2018). Jednak pomimo możliwości nadmiernego uproszczenia, biomy są użytecznymi konstruktami do organizowania i zrozumienia różnorodności biologicznej i funkcjonowania głównych ekosystemów lądowych Ziemi, a podejścia oparte na cechach mają duży potencjał, aby pomóc dynamicznie modelować globalne rozkłady roślinności.
W tym badaniu wykazaliśmy, że znaczna część różnorodności taksonomicznej wszystkich biomów reprezentuje gatunki, które są zarówno wąsko rozmieszczone, jak i funkcjonalnie podobne. Co więcej, w obrębie każdego z biomów gatunki najbardziej wyróżniające się funkcjonalnie są również rzadkie pod względem geograficznym, podczas gdy gatunki szeroko rozpowszechnione wykazują niską odrębność funkcjonalną. Pomimo znacznego taksonomicznego i funkcjonalnego pokrywania się biomów, tworzą one rozróżnialne, biogeograficznie i klimatycznie odrębne jednostki, zwłaszcza gdy funkcjonalne grupowanie opiera się na najbardziej rozpowszechnionych i funkcjonalnie wspólnych gatunkach w każdym biomie. Jednak postęp w funkcjonalnym zrozumieniu biomów będzie wymagał nie tylko lepszej charakterystyki zmienności cech w obrębie i między typami roślinności, ale także informacji na temat biogeograficznej i filogenetycznej historii zespołów gatunków oraz względnej obfitości gatunków w obrębie biomów.
Dostępność danych
Zestawy danych cech i mapy zasięgów gatunków analizowane w tym badaniu można pobrać za pośrednictwem pakietu R BIEN (Maitner i in., 2018). Zobacz http://bien.nceas.ucsb.edu/bien/, aby uzyskać więcej szczegółów na temat bazy danych BIEN.
Author Contributions
SE-L, AK, BJE, DMN i CV zaprojektowali badanie; SE-L i AK przeanalizowali dane; SE-L i AK napisali pierwszą wersję manuskryptu; CV, BB, NK, BSM, BM, RKP, BS, SS, J-CS i SKW przyczynili się do zestawienia i stworzenia bazy danych cech i map zasięgu. All authors contributed to the development and writing of the manuscript.
Funding
SE-L, DMN, and AK were supported by a collaborative research grant from the US National Science Foundation (DEB-1556651). BJE był wspierany przez nagrody National Science Foundation DEB-1457812 i Macrosystems-1065861. CV był wspierany przez European Research Council (Grant ERC-StG-2014-639706-CONSTRAINTS) oraz przez French Foundation for Research on Biodiversity (FRB; www.fondationbiodiversite.fr) w kontekście projektu CESAB Causes and consequences of functional rarity from local to global scales. J-CS traktuje tę pracę jako wkład do swojego projektu VILLUM Investigator Biodiversity Dynamics in a Changing World finansowanego przez VILLUM FONDEN (grant 16549). SKW był wspierany przez Strategic Science Investment Fund nowozelandzkiego Ministerstwa Biznesu, Innowacji i Zatrudnienia w ramach Science and Innovation Group.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Dziękujemy Danowi Griffithowi i dwóm recenzentom za konstruktywną krytykę, która znacznie poprawiła ten manuskrypt. Dziękujemy również wszystkim autorom danych BIEN (zobacz http://bien.nceas.ucsb.edu/bien/data-contributors/, aby uzyskać pełną listę).
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fevo.2018.00219/full#supplementary-material
Banda, R.K., Delgado-Salinas, A., Dexter, K. G., Linares-Palomino, R., Oliveira-Filho, A., Prado, D., et al. (2016). Wzorce różnorodności roślin w neotropikalnych lasach suchych i ich implikacje dla ochrony. Science 353, 1383-1387. doi: 10.1126/science.aaf5080
PubMed Abstract | CrossRef Full Text | Google Scholar
Blonder, B., Lamanna, C., Violle, C., and Enquist, B. J. (2014). The n-dimensional hypervolume. Glob. Ecol. Biogeogr. 23, 595-609. doi: 10.1111/geb.12146
CrossRef Full Text | Google Scholar
Blonder, B., Morrow, C. B., Maitner, B., Harris, D. J., Lamanna, C., Violle, C., et al. (2018). New approaches for delineating n-dimensional hypervolumes. Methods Ecol. Evol. 9, 305-319. doi: 10.1111/2041-210X.12865
CrossRef Full Text | Google Scholar
Bonan, G. B., Oleson, K. W., Fisher, R. A., Lasslop, G., and Reichstein, M. (2012). Reconciling leaf physiological traits and canopy flux data: use of the TRY and FLUXNET databases in the Community Land Model version 4. J. Geophys. Res. Biogeosci. 117:G02026. doi: 10.1029/2011JG001913
CrossRef Full Text | Google Scholar
Borregaard, M. K., and Rahbek, C. (2010). Causality of the relationship between geographic distribution and species abundance. Q. Rev. Biol. 85, 3-25. doi: 10.1086/650265
PubMed Abstract | CrossRef Full Text | Google Scholar
Bruggeman, J., Heringa, J., and Brandt, B. W. (2009). PhyloPars: estimation of missing parameter values using phylogeny. Nucleic Acids Res. 37, W179-W184. doi: 10.1093/nar/gkp370
PubMed Abstract | CrossRef Full Text | Google Scholar
Cadotte, M. W., Carscadden, K., and Mirotchnick, N. (2011). Beyond species: functional diversity and the maintenance of ecological processes and services. J. Appl. Ecol. 48, 1079-1087. doi: 10.1111/j.1365-2664.2011.02048.x
CrossRef Full Text | Google Scholar
Cornwell, W. K., Cornelissen, J. H., Amatangelo, K., Dorrepaal, E., Eviner, V. T., Godoy, O., et al. (2008). Plant species traits are the predominant control on litter decomposition rates within biomes worldwide. Ecol. Lett. 11, 1065-1071. doi: 10.1111/j.1461-0248.2008.01219.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Craine, J. M. (2009). Resource Strategies of Wild Plants. New Jersey, NJ: Princeton University Press. doi: 10.1515/9781400830640
CrossRef Full Text | Google Scholar
Currie, D. J., Mittelbach, G. G., Cornell, H. V., Field, R., Guégan, J. F., Hawkins, B. A., et al. (2004). Predictions and tests of climate-based hypotheses of broad-scale variation in taxonomic richness. Ecol. Lett. 12, 1121-1134. doi: 10.1111/j.1461-0248.2004.00671.x
CrossRef Full Text | Google Scholar
de la Riva, E. G., Violle, C., Pérez-Ramos, I. M., Marañón, T., Navarro-Fernández, C. M., Olmo, M., et al. (2018). A multidimensional functional trait approach reveals the imprint of environmental stress in Mediterranean woodody Communities. Ecosystems 21, 248-262. doi: 10.1007/s10021-017-0147-7
CrossRef Full Text | Google Scholar
Díaz, S., Kattge, J., Cornelissen, J. H., Wright, I. J., Lavorel, S., Dray, S., et al. (2016). Globalne spektrum formy i funkcji roślin. Nature 529, 167-171. doi: 10.1038/nature16489
PubMed Abstract | CrossRef Full Text | Google Scholar
Díaz, S., Lavorel, S., de Bello, F., Quétier, F., Grigulis, K., and Robson, T. M. (2007). Incorporating plant functional diversity effects in ecosystem service assessments. Proc. Natl. Acad. Sci. U.S.A 104, 20684-20689. doi: 10.1073/pnas.0704716104
PubMed Abstract | CrossRef Full Text | Google Scholar
Donoghue, M. J., and Edwards, E. J. (2014). Przesunięcia biome’ów i ewolucja nisz u roślin. Annu. Rev. Ecol. Evol. Syst. 45, 547-572. doi: 10.1146/annurev-ecolsys-120213-091905
CrossRef Full Text | Google Scholar
Douma, J. C., Aerts, R., Witte, J. P. M., Bekker, R. M., Kunzmann, D., Metselaar, K., et al. (2012). A combination of functionally different plant traits provides a means to quantitatively predict a broad range of species assemblages in NW Europe. Ecography 35, 364-373. doi: 10.1111/j.1600-0587.2011.07068.x
CrossRef Full Text | Google Scholar
Engemann, K., Sandel, B., Enquist, B. J., Jørgensen, P. M., Kraft, N., Marcuse-Kubitza, A., et al. (2016). Patterns and drivers of plant functional group dominance across the Western Hemisphere: a macroecological re-assessment based on a massive botanical dataset. Bot. J. Linn. Soc. 180, 141-160. doi: 10.1111/boj.12362
CrossRef Full Text | Google Scholar
Enquist, B. J., Condit, R., Peet, R., Thiers, B., and Schildhauer, M. (2016). The botanical information and ecology network (BIEN): cyberinfrastructure for an integrated botanical information network to investigate the ecological impacts of global climate change on plant biodiversity. PeerJ Prepr. 4:e2615v2. doi: 10.7287/peerj.preprints.2615v2
CrossRef Full Text | Google Scholar
Garnier, E., Cortez, J., Billès, G., Navas, M. L., Roumet, C., Debussche, M., et al. (2004). Plant functional markers capture ecosystem properties during secondary succession. Ecology 85, 2630-2637. doi: 10.1890/03-0799
CrossRef Full Text | Google Scholar
Goldsmith, G. R., Morueta-Holme, N., Sandel, B., Fitz, E. D., Fitz, S. D., Boyle, B., et al. (2016). Plant-O-Matic: dynamiczny i mobilny przewodnik po wszystkich roślinach obu Ameryk. Methods Ecol. Evol. 7, 960-965. doi: 10.1111/2041-210X.12548
CrossRef Full Text | Google Scholar
Goolsby, E. W., Bruggeman, J., and Ané, C. (2017). Rphylopars: fast multivariate phylogenetic comparative methods for missing data and within-species variation. Methods Ecol. Evol. 8, 22-27. doi: 10.1111/2041-210X.12612
CrossRef Full Text | Google Scholar
Grenié, M., Denelle, P., Tucker, C. M., Munoz, F., and Violle, C. (2017). funrar: an R package to characterize functional rarity. Divers. Distrib. 23, 1365-1371. doi: 10.1111/ddi.12629
CrossRef Full Text | Google Scholar
Hortal, J., de Bello, F., Diniz-Filho, J. A. F., Lewinsohn, T. M., Lobo, J. M., and Ladle, R. J. (2015). Seven shortfalls that beset large-scale knowledge of biodiversity. Annu. Rev. Ecol. Evol. Syst. 46, 523-549. doi: 10.1146/annurev-ecolsys-112414-054400
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Enquist, B. J., Elser, J. J., and Fagan, W. F. (2005). Plant allometry, stoichiometry and the temperature-dependence of primary productivity. Glob. Ecol. Biogeogr. 14, 585-598. doi: 10.1111/j.1466-822X.2005.00187.x
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Fagan, W. F., Elser, J. J., and Enquist, B. J. (2006). Phylogenetic i formy wzrostu zmienność w skalowaniu azotu i fosforu w roślinach nasiennych. Am. Nat. 168, E103-E122. doi: 10.1086/507879
PubMed Abstract | CrossRef Full Text | Google Scholar
Kraft, N. J., Valencia, R., and Ackerly, D. D. (2008). Functional traits and niche-based tree community assembly in an Amazonian forest. Science 322, 580-582. doi: 10.1126/science.1160662
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamanna, C., Blonder, B., Violle, C., Kraft, N. J., Sandel, B., et al. (2014). Functional trait space and the latitudinal diversity gradient. Proc. Natl. Acad. Sci. U.S.A. 111, 13745-13750. doi: 10.1073/pnas.1317722111
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavorel, S., and Garnier, E. (2002). Predicting changes in community composition and ecosystem functioning from plant traits: revisiting the Holy Grail. Funct. Ecol. 16, 545-556. doi: 10.1046/j.1365-2435.2002.00664.x
CrossRef Full Text | Google Scholar
Lavorel, S., Grigulis, K., Lamarque, P., Colace, M.-P., Garden, D., Girel, J., et al. (2011). Using plant functional traits to understand the landscape distribution of multiple ecosystem services. J. Ecol. 99, 135-147. doi: 10.1111/j.1365-2745.2010.01753.x
CrossRef Full Text | Google Scholar
Li, Y., Shipley, B., Price, J. N., Dantas, V. de L., Tamme, R., Westoby, M., et al. (2018). Habitat filtering determines the functional niche occupancy of plant communities worldwide. J. Ecol. 106, 1001-1009. doi: 10.1111/1365-2745.12802
CrossRef Full Text | Google Scholar
Magallón, S., Gómez-Acevedo, S., Sánchez-Reyes, L. L., and Hernández-Hernández, T. (2015). A metacalibrated time-tree documents the early rise of flowering plant phylogenetic diversity. New Phytol. 207, 437-453. doi: 10.1111/nph.13264
PubMed Abstract | CrossRef Full Text | Google Scholar
Maitner, B. S., Boyle, B., Casler, N., Condit, R., Donoghue, J., Durán, S. M., et al. (2018). The BIEN R package: a tool to access the botanical information and ecology network (BIEN) database. Methods Ecol. Evol. 9, 373-379. doi: 10.1111/2041-210X.12861
CrossRef Full Text | Google Scholar
Moncrieff, G. R., Bond, W. J., and Higgins, S. I. (2016). Revising the biome concept for understanding and predicting global change impacts. J. Biogeogr. 43, 863-873. doi: 10.1111/jbi.12701
CrossRef Full Text | Google Scholar
Novosolov, M., Rodda, G. H., North, A. C., Butchart, S. H. M., Tallowin, O. J. S., Gainsbury, A. M., et al. (2017). Population density-range size relationship revisited. Glob. Ecol. Biogeogr. 26, 1088-1097. doi: 10.1111/geb.12617
CrossRef Full Text | Google Scholar
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C., et al. (2001). Terrestrial Ecoregions of the world: a new map of life on earth: a new global map of terrestrial ecoregions provides an innovative tool for conserving biodiversity. Bioscience 51, 933-938.doi: 10.1641/0006-3568(2001)0512.0.CO;2
CrossRef Full Text | Google Scholar
Pennington, R. T., Prado, D. E., and Pendry, C. A. (2000). Neotropical sezonowo suche lasy i czwartorzędowe zmiany roślinności. J. Biogeogr. 27, 261-273. doi: 10.1046/j.1365-2699.2000.00397.x
CrossRef Full Text | Google Scholar
Pennington, R. T., Richardson, J. E., and Lavin, M. (2006). Insights into the historical construction of species-rich biomes from dated plant phylogenies, neutral ecological theory and phylogenetic community structure. New Phytol. 172, 605-616. doi: 10.1111/j.1469-8137.2006.01902.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Penone, C., Davidson, A. D., Shoemaker, K. T., Di Marco, M., Rondinini, C., Brooks, T. M., et al. (2014). Imputacja brakujących danych w zbiorach danych cech historii życia: które podejście sprawdza się najlepiej? Methods Ecol. Evol. 5, 961-970. doi: 10.1111/2041-210X.12232
CrossRef Full Text | Google Scholar
Pillar, V. D., Blanco, C. C., Müller, S. C., Sosinski, E. E., Joner, F., and Duarte, L. D. S. (2013). Funkcjonalna redundancja i stabilność w zbiorowiskach roślinnych. J. Veg. Sci. 24, 963-974. doi: 10.1111/jvs.12047
CrossRef Full Text | Google Scholar
Prado, D. E., and Gibbs, P. E. (1993). Patterns of species distributions in the dry seasonal forests of South America. Ann. Mo. Bot. Gard. 80, 902-927. doi: 10.2307/2399937
CrossRef Full Text | Google Scholar
Qian, H., and Sandel, B. (2017). Phylogenetic structure of regional angiosperm assemblages across latitudinal and climatic gradients in North America. Glob. Ecol. Biogeogr. 26, 1258-1269. doi: 10.1111/geb.12634
CrossRef Full Text | Google Scholar
Reich, P. B., Wright, I. J., Cavender-Bares, J., Craine, J. M., Oleksyn, J., Westoby, M., et al. (2003). The evolution of plant functional variation: traits, spectra, and strategies. Int. J. Plant Sci. 164, S143-S164. doi: 10.1086/374368
CrossRef Full Text | Google Scholar
Silva de Miranda, P. L., Oliveira-Filho, A., Pennington, R. T., Neves, D. M., Baker, T. R., and Dexter, K. G. (2018). Using tree species inventories to map biomes and assess their climatic overlaps in lowland tropical South America. Glob. Ecol. Biogeogr. 27, 899-912. doi: 10.1111/geb.12749
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Kraft, N. J. B., Storch, D., Svenning, J.-C., Boyle, B., et al. (2015). Shifts in trait means and variances in North American tree assemblages: species richness patterns are loosely related to the functional space. Ecography 38, 649-658. doi: 10.1111/ecog.00867
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Svenning, J.-C., Kattge, J., Engemann, K., Sandel, B., et al. (2018). Przestrzenne wzorce i relacje klimatyczne głównych cech roślin w Nowym Świecie różnią się między gatunkami drzewiastymi i zielnymi. J. Biogeogr. 45, 895-916. doi: 10.1111/jbi.13171
CrossRef Full Text | Google Scholar
Smith, S. A., and Beaulieu, J. M. (2009). Life history influences rates of climatic niche evolution in flowering plants. Proc. Biol. Sci. 276, 4345-4352. doi: 10.1098/rspb.2009.1176
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., and Brown, J. W. (2018). Constructing a broadly inclusive seed plant phylogeny. Am. J. Bot. 105, 302-314. doi: 10.1002/ajb2.1019
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., and Donoghue, M. J. (2008). Rates of molecular evolution are linked to life history in flowering plants. Science 322, 86-89. doi: 10.1126/science.1163197
PubMed Abstract | CrossRef Full Text | Google Scholar
Swenson, N. G. (2014). Phylogenetic imputation of plant functional trait databases.Ecography 37, 105-110. doi: 10.1111/j.1600-0587.2013.00528.x
CrossRef Full Text
Swenson, N. G., Enquist, B. J., Pither, J., Kerkhoff, A. J., Boyle, B., Weiser, M. D., et al. (2012). The biogeography and filtering of woodody plant functional diversity in North and South America. Glob. Ecol. Biogeogr. 21, 798-808. doi: 10.1111/j.1466-8238.2011.00727.x
CrossRef Full Text | Google Scholar
Swenson, N. G., Weiser, M. D., Mao, L., Araújo, M. B., Diniz-Filho, J. A. F., Kollmann, J., et al. (2017). Phylogeny and the prediction of tree functional diversity across novel continental settings. Glob. Ecol. Biogeogr. 26, 553-562. doi: 10.1111/geb.12559
CrossRef Full Text | Google Scholar
Umaña, M. N., Mi, X., Cao, M., Enquist, B. J., Hao, Z., Howe, R., et al. (2017). The role of functional uniqueness and spatial aggregation in explaining rarity in trees. Glob. Ecol. Biogeogr. 26, 777-786. doi: 10.1111/geb.12583
CrossRef Full Text | Google Scholar
van Bodegom, P. M., Douma, J. C., and Verheijen, L. M. (2014). A fully traits-based approach to modeling global vegetation distribution. Proc. Natl. Acad. Sci. U.S.A. 111, 13733-13738. doi: 10.1073/pnas.1304551110
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Reich, P. B., Pacala, S. W., Enquist, B. J., and Kattge, J. (2014). The emergence and promise of functional biogeography (Pojawienie się i obietnica biogeografii funkcjonalnej). Proc. Natl. Acad. Sci. U.S.A. 111, 13690-13696. doi: 10.1073/pnas.1415442111
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Thuiller, W., Mouquet, N., Munoz, F., Kraft, N. J. B., Cadotte, M. W., et al. (2017). Functional rarity: the ecology of outliers. Trends Ecol. Evol. 32, 356-367. doi: 10.1016/j.tree.2017.02.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, B., Kinzig, A., and Langridge, J. (1999). Plant attribute diversity, resilience, and ecosystem function: the nature and significance of dominant and minor species. Ecosystems 2, 95-113. doi: 10.1007/s100219900062
CrossRef Full Text | Google Scholar
Westoby, M. (1998). Schemat strategii ekologii roślin oparty na wysokości liści i nasion (LHS). Plant Soil 199, 213-227. doi: 10.1023/A:1004327224729
CrossRef Full Text | Google Scholar
Woodward, F. I., Lomas, M. R., and Kelly, C. K. (2004). Global climate and the distribution of plant biomes. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 359, 1465-1476. doi: 10.1098/rstb.2004.1525
PubMed Abstract | CrossRef Full Text | Google Scholar
Wright, I. J., Reich, P. B., Westoby, M., Ackerly, D. D., Baruch, Z., Bongers, F., et al. (2004). Światowe spektrum ekonomii liści. Nature 428, 821-827. doi: 10.1038/nature02403
PubMed Abstract | CrossRef Full Text | Google Scholar
Xia, J., Niu, S., Ciais, P., Janssens, I. A., Chen, J., Ammann, C., et al. (2015). Joint control of terrestrial gross primary productivity by plant phenology and physiology. Proc. Natl. Acad. Sci. U.S.A. 112, 2788-2793. doi: 10.1073/pnas.1413090112
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Pearse, W. D., Cornwell, W. K., McGlinn, D. J., Wright, I. J., and Uyeda, J. C. (2018). Funkcjonalna biogeografia okrytozalążkowych: życie na ekstremach. New Phytol. 218, 1697-1709. doi: 10.1111/nph.15114
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Tank, D. C., Cornwell, W. K., Eastman, J. M., Smith, S. A., FitzJohn, R. G., et al. (2014). Three keys to the radiation of angiosperms into freezing environments. Nature 506, 89-92. doi: 10.1038/nature12872
PubMed Abstract | CrossRef Full Text | Google Scholar
.