Introduction
Stwardnienie zanikowe boczne (ALS) jest postępującym schorzeniem charakteryzującym się zajęciem zarówno górnych, jak i dolnych neuronów ruchowych (UMNs i LMNs). W ALS, utrata mięśni preferencyjnie dotyczy przywodziciela policzkowego krótkiego (APB) i pierwszego grzbietowego mięśnia międzykostnego, z względnym zachowaniem przywodziciela digiti minimi (ADM). Ta specyficzna cecha ALS została określona jako objaw “rozdwojonej ręki” (Wilbourn, 2000). Ogólnie rzecz biorąc, zakres utraty jednostek motorycznych jest znacznie większy w APB niż w ADM u pacjentów z ALS (Kuwabara i in., 1999). Zaproponowano, że zarówno mechanizmy korowe, jak i obwodowe leżą u podstaw różnych poziomów atrofii wśród mięśni małych rąk w ALS (Weber i in., 2000; Shibuya i in., 2013). Wyniki badań z zastosowaniem przezczaszkowej stymulacji magnetycznej wykazały, że kortykomotoneuronalne wejście do rdzeniowych motoneuronów unerwiających kompleks thenar jest bardziej rozległe u normalnych uczestników (Macdonell i in., 1999; Menon i in., 2014). Taka różnica wejść może powodować preferencyjną degenerację tych motoneuronów rdzeniowych w ALS poprzez transsynaptyczny mechanizm ekscytotoksyczny anterograde. Projekcje kortykomotoneuronalne do kompleksu thenar są preferencyjnie zaburzone w ALS, co sugeruje, że dysfunkcja kortykomotoneuronalna przyczynia się do objawu rozdwojenia dłoni w ALS (Weber et al., 2000). Badania pobudliwości nerwów obwodowych sugerują, że aksony motoneuronów unerwiających APB są nadpobudliwe i podatne na degenerację w ALS (Vucic i Kiernan, 2010; Shibuya i in., 2013). Jednak do tej pory niewiele jest badań, które bezpośrednio porównywały dysfunkcję lub pobudliwość motoneuronów unerwiających APB i ADM. Fala F jest późną odpowiedzią o niskiej amplitudzie, która odzwierciedla antydromową aktywację motoneuronów (Pastore-Olmedo i in., 2009). Fale F mogą stanowić niezależną miarę pobudliwości segmentalnych motoneuronów (Fisher, 1992; Milanov, 1992; Hachisuka i in., 2015). Podstawowym celem tego badania było zbadanie różnic w dysfunkcji między motoneuronami rdzeniowymi unerwiającymi APB i ADM w ALS przy użyciu fal F.
Materiały i metody
Uczestnicy
Badaliśmy 40 pacjentów ze sporadycznym ALS i 20 dopasowanych pod względem wieku i płci normalnych uczestników. Wszyscy pacjenci byli widziani w Departamencie Neurologii w Peking Union Medical College Hospital między sierpniem 2013 a czerwcem 2014 roku. Pacjenci z ALS, którzy spełnili zmodyfikowane kryteria El Escorial dla definitywnego, prawdopodobnego lub prawdopodobnego ALS wspomaganego laboratoryjnie (Brooks i in., 2000), zostali kolejno włączeni do badania. U tych pacjentów analizowano różne badania elektrofizjologiczne i cechy kliniczne, takie jak wiek w chwili włączenia do badania i czas od wystąpienia objawów. U żadnego z pacjentów z ALS nie zidentyfikowano mutacji genetycznej. Zajęcie UMN w kończynach górnych było sugerowane przez obecność klonusu, zwiększonego napięcia, szybkich odruchów ścięgnistych i dodatnich objawów Hoffmana. Pacjenci z ALS zostali podzieleni na dwie grupy na podstawie objawów fizycznych. Pacjenci z grupy 1 (20 pacjentów z ALS) mieli zanik i osłabienie wewnętrznych mięśni rąk. Pacjenci z grupy 2 (20 pacjentów z ALS) nie wykazywali utraty lub osłabienia wewnętrznych mięśni ręki i wykazywali brak lub łagodne upośledzenie dyskretnych ruchów palców. Dane dla bardziej dotkniętej ręki były analizowane dla pacjentów z ALS z grupy 1, podczas gdy dane dla bardziej nienaruszonej ręki były analizowane dla pacjentów z ALS z grupy 2. Dane dla lewej ręki były analizowane dla normalnych kontroli (NCs). Pacjenci z ALS byli klasyfikowani klinicznie przy użyciu ALS functional rating scale-revised (ALSFRS-R; Cedarbaum i in., 1999) i kategoryzowani według miejsca początku choroby. Cechy elektrodiagnostyczne wszystkich pacjentów z ALS były zgodne z rozproszonym i postępującym zwyrodnieniem komórek rogów przednich. W czasie badania żaden z pacjentów nie przyjmował riluzolu ani innych leków przeciwspastycznych. Wykluczono uczestników z przypadkowym zespołem cieśni nadgarstka lub kości sześciennej na podstawie badania klinicznego i badań przewodnictwa nerwowego. Wszyscy badani wyrazili świadomą, pisemną zgodę na udział w badaniu. Badanie zostało zatwierdzone przez Ethics Committee of Clinical Research of Peking Union Medical College Hospital (Pekin, Chiny), a wszystkie procedury przeprowadzono zgodnie z Deklaracją Helsińską.
Badanie przewodnictwa nerwowego
Badania elektrofizjologiczne przeprowadzono przy użyciu systemu elektromiografii (EEG) Viking IV (Nicolet Biomedical, Madison, WI, USA). Złożone potencjały czynnościowe mięśni (CMAPs) rejestrowano z mięśni APB i ADM po stymulacji nerwu pośrodkowego lub łokciowego w nadgarstku. Temperatura skóry badanych kończyn utrzymywana była na poziomie >32°C. Mierzono dystalną latencję ruchową (DML), amplitudę CMAP od szczytu do szczytu, prędkość przewodzenia motorycznego (MCV) oraz stosunek amplitudy CMAP ADM/APB.
Badanie fal F
Wszyscy badani znajdowali się w pozycji leżącej i zrelaksowanej podczas całego eksperymentu. Fale F nerwów pośrodkowego i łokciowego były rejestrowane za pomocą elektrod powierzchniowych przymocowanych do skóry nad mięśniami APB i ADM. Badane nerwy były stymulowane poprzez dostarczenie 100 bodźców supramaksymalnych o częstotliwości 1 Hz w miejscu, które było 7 cm proksymalnie od aktywnej elektrody rejestrującej z katodą proksymalnie do anody. Uznano, że całkowita liczba 100 bodźców jest odpowiednia do zbadania pełnego potencjału fal F (Fisher i in., 1994). Ustawienia filtrów wynosiły od 20 Hz do 10 kHz, prędkość przemiatania 5 ms na podział, a wzmocnienie wzmacniacza 0,5 mV na podział. Fale A, które zostały zdefiniowane jako identyczne późne odpowiedzi o stałej latencji, które wystąpiły w co najmniej 8 z 20 śladów, zostały wyłączone z badania fal F (Puksa i in., 2003). Analizie poddano następujące parametry fal F: minimalną latencję, średnią latencję, maksymalną latencję, trwałość fali F, średnią amplitudę, średni stosunek amplitudy F/M oraz liczbę powtarzających się fal F. Amplituda międzyszczytowa fali F była mierzona, jeśli amplituda wynosiła co najmniej 40 μV. Średni stosunek amplitudy F/M obliczano dzieląc średnią amplitudę fali F przez odpowiadającą jej maksymalną amplitudę CMAP. Neuron powtarzający (RN) był neuronem, który dawał początek serii fal F o identycznych latencjach, amplitudach i kształtach, a te fale F były definiowane jako powtarzające się fale F. RN i powtarzające się fale F były wykrywane przez oględziny i ręcznie nakładane na inne powtarzające się fale F. Powtarzające się fale F były mierzone przy użyciu następujących indeksów: indeks RN = 100 × liczba RN/liczba śladów z różnymi kształtami fal F w serii 100 bodźców; indeks powtarzających się fal F (Freps) = 100 × liczba powtarzających się fal F/całkowita liczba śladów z falami F w tym samym nerwie (Chroni i in., 2012).
Analizy statystyczne
Test Shapiro-Wilka został użyty do oceny normalności danych. Gdy wartość P w analizie wariancji osiągnęła istotność, wykonano test Studenta-Newmana-Keulsa. Do oceny różnic między dwiema grupami zastosowano test t z próbą niezależną. Dla danych nieparametrycznych porównania między grupami wykonano testem H Kruskala-Wallisa. Po odrzuceniu hipotezy zerowej, porównania parami grup testowano za pomocą testu U Manna-Whitneya i korekty Bonferroniego przy poziomie istotności P < 0,017. Różnice w zmiennych kategorycznych badano testem Chi-kwadrat. Istotność statystyczna została ustalona na poziomie P < 0,05. SPSS dla Windows, wersja 21.0 (SPSS, Inc., Chicago, IL, USA), został użyty do przeprowadzenia analiz statystycznych.
Wyniki
Kliniczne profile pacjentów z ALS i uczestników NC są podsumowane w Tabeli 1. Wszyscy pacjenci z ALS byli klinicznie zdominowani przez LMN. Wiek w momencie badania, stosunek płci i wzrost były porównywalne w trzech grupach. Wśród pacjentów z ALS, choroba o początku w kończynach górnych stanowiła 70% pacjentów w grupie 1 i 25% pacjentów w grupie 2. Było 11 pacjentów z ALS w grupie 1 i 10 w grupie 2 z dwoma dotkniętymi regionami ciała, a także było 9 uogólnionych pacjentów w grupie 1 i 10 w grupie 2. Czas trwania choroby i wyniki ALSFRS-R nie różniły się znacząco między pacjentami z ALS w grupach 1 i 2.

Tabela 1. Profile kliniczne uczestników badania.
Tabela 2 przedstawia wyniki badania przewodnictwa nerwowego dla pacjentów z ALS i NCs. Stosunek amplitudy ADM/APB CMAP był znacząco zwiększony u pacjentów z ALS w grupie 1 w porównaniu z grupą NC, co było obserwowane spójnie z objawem rozdwojenia dłoni u pacjentów z ALS (Kuwabara i wsp., 2008). Wyniki badania fali F dla pacjentów z ALS i NC przedstawiono w tabeli 3. Średnia amplituda fali F dla APB była istotnie niższa w grupie 1 niż w grupie 2, które były porównywalne między grupą 2 a NC. Średnie amplitudy fali F dla ADM w grupach 1 i 2 były znamiennie wyższe w porównaniu z grupą 2 i NC. Stosunek amplitudy F/M APB i ADM w grupie 1 był istotnie wyższy niż w grupie 2 i NCs, natomiast w grupie 2 i NCs stosunek amplitudy F/M był podobny. Trwałość fali F w APB, która była istotnie niższa u pacjentów z ALS niż u NC, była porównywalna między grupami 1 i 2. Trwałość fali F w ADM była istotnie niższa w grupie 1 niż w grupie 2 i NC, natomiast trwałość fali F w ADM była podobna między grupą 2 i NC. Indeks RN i indeks Freps APB były istotnie zwiększone w grupach 1 i 2 w porównaniu z NC, ale wskaźniki te były porównywalne między grupami 1 i 2. Indeks RN i indeks Freps ADM był istotnie wyższy w grupie 1 niż w grupie 2 i NCs, natomiast grupa 2 i NCs wykazywały podobne wartości tych indeksów. Na rycinie 1 przedstawiono reprezentatywne przykłady śladów fali F dla nerwu pośrodkowego i łokciowego zarejestrowane u pacjentów z ALS w grupach 1, 2 i NCs.

Tabela 2. Wyniki badania przewodnictwa nerwowego.

Tabela 3. Badanie fal F u pacjentów z ALS i osób z grupy kontrolnej.

Rysunek 1. Reprezentatywne przykłady fal F zarejestrowanych od pacjentów ze stwardnieniem zanikowym bocznym (ALS) i normalnych kontroli (NCs). (A) Fale F zarejestrowane od ręki pacjenta z ALS wykazującego osłabienie i wyniszczenie. Zmniejszona trwałość fali F i zwiększona liczba powtarzających się fal F zostały zaobserwowane w falach F zarejestrowanych zarówno z nerwu pośrodkowego jak i łokciowego. (B) Fale F zarejestrowane z ręki pacjenta z ALS bez wykrywalnego osłabienia. Trwałość fali F była zmniejszona, a liczba powtarzających się fal F była zwiększona w nerwie pośrodkowym, podczas gdy parametry fal F zarejestrowanych z nerwu łokciowego były względnie prawidłowe. (C) Fale F zarejestrowane od zdrowej osoby na lewej kończynie górnej. Amplitudy fal F, latencje i kształty fal były zmienne, a trwałość fal F była prawidłowa zarówno dla nerwu pośrodkowego, jak i łokciowego. Litery na prawo od zapisu identyfikują powtarzające się fale F na podstawie amplitudy, opóźnienia i kształtu fali. Kalibracje to 0.5 mV i 5 ms dla zapisu fali F.
Tabela 4 pokazuje diagnostyczną wydajność fali F w ALS vs. NCs. Fala F może być wykorzystana do różnicowania pacjentów z ALS i NC. Indeks RN i indeks Freps w APB okazały się wiarygodnymi zmiennymi do różnicowania pacjentów z ALS od NC, ponieważ obszar pod krzywą (AUC) dla indeksu RN (0,998, 95% przedział ufności (CI) 0,937-1,000) i indeksu Freps (1,000, 95% CI 0,940-1,000) wykazał “bardzo dobrą” użyteczność diagnostyczną. Pozostałe zmienne dotyczące fali F miały niższe wartości AUC niż indeks RN i indeks Freps w APB, a zatem wykazywały mniejszą przydatność diagnostyczną. Stosunek amplitudy ADM/APB CMAP wykazał AUC równe 0,766 (95% CI 0,638-0,865, P < 0,001) i mógł umiarkowanie różnicować pacjentów z ALS od NC. Zastosowanie wartości odcięcia ADM/APB > 1,7 (Kim et al., 2015) do diagnozowania ALS dało umiarkowaną czułość (52,5%) i wysoką swoistość (85,0%) w porównaniu z kontrolami. Trwałość fali F (P = 0,002), indeks RN (P < 0,001) i indeks Freps (P < 0,001) w APB wydawały się odróżniać pacjentów z ALS od NC bardziej solidnie niż stosunek amplitudy ADM/APB CMAP.
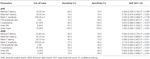
Tabela 4. Diagnostic performance of F-wave in amyotrophic lateral sclerosis (ALS) vs. normal controls (NCs).
Dyskusja
Podstawowym celem tego badania było wykorzystanie pomiarów F-wave do stwierdzenia różnic w dysfunkcji pomiędzy motoneuronami APB i ADM u pacjentów z ALS. Zgodnie z zaproponowanym systemem oceny zaawansowania ALS (Roche i in., 2012), stopień zaawansowania choroby był porównywalny pomiędzy grupą 1 i 2. Różnica w odsetku zachorowań na kończyny górne między grupami 1 i 2 może leżeć u podstaw innego wzorca progresji choroby między tymi dwiema grupami. Szacowana liczba jednostek motorycznych i amplitudy CMAP są użytecznymi parametrami do oceny utraty motoneuronów, podczas gdy fala F może być bezpośrednią sondą dysfunkcji lub niestabilności w komórkach rogów przednich (Hachisuka i in., 2015). Trwałość fali F jest związana z liczbą LMNs i pobudliwością motoneuronów (Schiller i Stalberg, 1978; de Carvalho i in., 2002; Argyriou i in., 2006). Proponowane mechanizmy leżące u podstaw powtarzających się fal F to zwiększona pobudliwość w poszczególnych komórkach rogów przednich, zmniejszona pobudliwość w niektórych motoneuronach lub utrata motoneuronów (Schiller i Stalberg, 1978; Petajan, 1985; Peioglou-Harmoussi i in., 1987; Hachisuka i in., 2015). W miarę utraty motoneuronów, powtarzające się fale F pochodzące z poszczególnych motoneuronów mogą być łatwiej rozpoznawane; argumentuje się jednak, że niska częstotliwość backfiring poszczególnych motoneuronów czyni ten mechanizm raczej mało prawdopodobnym (Chroni i in., 2012). Fizjologicznie stwierdzono istotne różnice w trwałości fali F i liczbie powtórzeń fali F między APB i ADM. Wyniki te mogą być związane z mniejszą liczbą funkcjonalnych motoneuronów unerwiających APB (Gooch i in., 2014) lub zwiększoną korową modulacją hamującą APB (Menon i in., 2014).
W ALS dysfunkcja motoneuronów rdzeniowych rozwija się stopniowo przed wystąpieniem jawnych objawów (Bradley, 1987). W prezentowanym badaniu pacjenci z ALS, u których nie występowało wykrywalne marnowanie lub osłabienie rąk, wykazywali istotnie mniejszą trwałość fali F oraz wyższe wartości indeksu RN i indeksu Freps dla APB w porównaniu z pacjentami z NC. Ponadto, ci pacjenci z ALS wykazywali względnie prawidłowe wartości fali F w ADM. Dane te są spójne z preferencyjną dysfunkcją motoneuronów rdzeniowych unerwiających APB w ALS (Baumann i in., 2012). W ALS, jednakże, motoneurony rdzeniowe unerwiające APB mogą być bardziej aktywne niż te unerwiające ADM, a amplituda CMAP może nie mieć wystarczającej czułości do wykrycia utraty motoneuronów, ponieważ pozostałe motoneurony mogą zapewniać kompensacyjną kolateralną reinerwację zwyrodniałych włókien mięśniowych (van Dijk i in., 2010). Analiza fal F, zwłaszcza fal F w nerwach pośrodkowych, może pomóc w wykryciu subtelnych zmian w komórkach rogów przednich nawet u pacjentów z ALS bez objawów klinicznych, a tym samym może stanowić pomocne podejście do oceny postępu choroby.
Wykazano, że uszkodzenie LMN zmniejsza amplitudę fal F (Fisher, 1992). Zanik mięśni może prowadzić do osłabienia odpowiedzi mięśniowej poprzez częściową neutralizację nadpobudliwości puli motoneuronów (Drory i in., 1993). W niniejszym badaniu u pacjentów z ALS, u których wystąpił objaw rozdwojenia dłoni, stwierdzono znacznie zmniejszone amplitudy fal F, zmniejszoną trwałość fal F oraz zwiększoną liczbę powtarzających się fal F w APB w porównaniu z ADM, co prawdopodobnie odzwierciedla poważniejsze uszkodzenie motoneuronów rdzeniowych unerwiających APB. Tworzenie się dużych jednostek motorycznych po reinerwacji może przyczynić się do wzrostu amplitudy fali F (Drory i in., 2001). Znacznie zwiększona amplituda fali F w ADM w porównaniu z APB u pacjentów z ALS jest spójna z wolniejszą utratą motoneuronów w puli motoneuronów ADM (Baumann i in., 2012). Stosunek amplitudy F/M określa ilościowo proporcję puli motoneuronów, która jest aktywowana podczas serii fal F (Drory i in., 2001). Znacznie zwiększony stosunek amplitudy F/M w APB w porównaniu z tym w ADM pacjentów z ALS odzwierciedla zwiększoną tendencję motoneuronów unerwiających APB do generowania fal F. I odwrotnie, kombinacja zmniejszonej średniej amplitudy fali F i zwiększonego stosunku amplitudy F/M w APB podkreśla preferencyjne zaangażowanie APB w ALS. Powtarzające się fale F wskazują na zmiany patologiczne w jednostkach motorycznych (Hachisuka i wsp., 2015). Znaczący wzrost liczby powtarzających się fal F w APB może sugerować większy stopień nadpobudliwości w obrębie rdzeniowych motoneuronów unerwiających APB (Fang i in., 2015).
Interesujące jest to, że pacjenci z ALS, u których nie stwierdzono wykrywalnego zaniku mięśni dłoni, wykazywali średnią amplitudę fali F dla APB, która była znacząco wyższa niż u pacjentów z ALS, u których wystąpił objaw rozdwojenia dłoni. Natomiast średnia amplituda fali F dla ADM była porównywalna w obu grupach pacjentów z ALS, niezależnie od atrofii mięśni dłoni, ale była istotnie wyższa u pacjentów z ALS niż u NC. Różnice w charakterystyce fali F pomiędzy APB i ADM mogą być przypisane konkurującym efektom degeneracji i regeneracji w obrębie jednostki motorycznej. W przypadku degeneracji neuronów ruchowych, neurony ruchowe, które przetrwały, kompensują to zjawisko poprzez ponowne unerwienie zwyrodniałych włókien mięśniowych poprzez aksonalny sprouting (Ibrahim i el-Abd, 1997). W ALS proces degeneracji może rozpocząć się wcześniej i postępować szybciej w okolicy mięśnia naramiennego. Tempo degeneracji było wolniejsze w motoneuronach unerwiających ADM niż w tych unerwiających APB. Konieczne są dalsze badania, aby wyjaśnić mechanizmy w ALS, które przyczyniają się do różnic w dysfunkcji motoneuronów unerwiających APB i ADM. Podejrzewaliśmy, że mechanizmy korowe, obwodowe mechanizmy aksonalne lub dysfunkcja segmentów rdzeniowych, szczególnie w rdzeniowych obwodach hamujących, mogą przyczyniać się do preferencyjnej degeneracji motoneuronów rdzeniowych unerwiających APB (Turner i Kiernan, 2012; Ramírez-Jarquín i in., 2014).
Poprzednie badania wykazały, że objaw rozdwojenia dłoni jest częściej obserwowany w ALS, a zwiększony stosunek amplitudy ADM/APB CMAP jest prawie specyficzny dla ALS. W obecnym badaniu wykazano, że kryterium neurofizjologiczne dla ADM/APB w postaci stosunku amplitudy CMAP >1,7 (Kuwabara i wsp., 2008) ma umiarkowaną czułość i wysoką swoistość w różnicowaniu ALS od NC, co jest zgodne z wcześniejszymi badaniami (Kim i wsp., 2015). W tym badaniu parametry fali F mogły pomóc w wiarygodnym różnicowaniu pacjentów z ALS od normalnych uczestników. Ponadto, trwałość fali F, indeks RN i indeks Freps w APB mogły wiarygodnie różnicować pacjentów z ALS od NCs, ponieważ te środki wykazały większe wartości AUC niż stosunek amplitudy ADM/APB CMAP.
Nasza analiza ma kilka ograniczeń. Było to badanie przekrojowe, do którego włączono stosunkowo niewielką liczbę uczestników. Konieczne jest przeprowadzenie badania uzupełniającego z udziałem większej populacji w celu dokładnego określenia zakresu dysfunkcji kręgosłupa związanej z objawem rozdwojenia dłoni w ALS. Innym potencjalnym ograniczeniem jest brak grupy kontrolnej złożonej z pacjentów z zespołami, które naśladują ALS. Taka grupa byłaby przydatna do oceny wartości klinicznej fali F w różnicowaniu ALS z zaburzeniami naśladującymi ALS. Co więcej, dalsze badania elektrofizjologiczne wykorzystujące metody oceny dysfunkcji UMN, jak również pobudliwości aksonów ruchowych, powinny być przeprowadzone na tych samych grupach pacjentów, aby rzucić więcej światła na patofizjologię tego zjawiska.
W podsumowaniu, nasze wyniki wykazują różnice w charakterystyce fali F między APB i ADM u pacjentów z ALS. Te zmiany w falach F są charakterystyczne dla pacjentów z ALS i mogą być pomocne w różnicowaniu ALS z pewnymi zaburzeniami, które naśladują ALS. Wyjaśnienie patofizjologicznych mechanizmów leżących u podstaw różnych poziomów atrofii w małych mięśniach ręki rzuciłoby światło na patogenezę ALS.
Wkład autorów
JF i LC: wymyślili, wykonali i zaprojektowali eksperymenty. JF, LC, ML i YG: analizowali dane. ML, YG, XL, DL, BC, DS i QD: dostarczyli odczynniki/materiały/narzędzia do analizy. JF i LC: przyczynili się do napisania manuskryptu.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Chcielibyśmy podziękować pacjentom z ALS i zdrowym ochotnikom, którzy wzięli udział w tym badaniu.
Argyriou, A. A., Polychronopoulos, P., Talelli, P., and Chroni, E. (2006). F-wave study in amyotrophic lateral sclerosis: assessment of balance between upper and lower motor neuron involvement. Clin. Neurophysiol. 117, 1260-1265. doi: 10.1016/j.clinph.2006.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Baumann, F., Henderson, R. D., Gareth Ridall, P., Pettitt, A. N., and McCombe, P. A. (2012). Quantitative studies of lower motor neuron degeneration in amyotrophic lateral sclerosis: evidence for exponential decay of motor unit numbers and greatest rate of loss at the site of onset. Clin. Neurophysiol. 123, 2092-2098. doi: 10.1016/j.clinph.2012.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bradley, W. G. (1987). Najnowsze poglądy na temat stwardnienia zanikowego bocznego z naciskiem na badania elektrofizjologiczne. Muscle Nerve 10, 490-502. doi: 10.1002/mus.880100603
PubMed Abstract | CrossRef Full Text | Google Scholar
Brooks, B. R., Miller, R. G., Swash, M., and Munsat, T. L. (2000). El escorial revisited revised criteria for the diagnosis of amyotrophic lateral sclerosis. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 1, 293-299. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedarbaum, J. M., Stambler, N., Malta, E., Fuller, C., Hilt, D., Thurmond, B., et al. (1999). The ALSFRS-R a revised ALS functional rating scale that incorporates assessments of respiratory function function. J. Neurol. Sci. 169, 13-21. doi: 10.1016/s0022-510x(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Chroni, E., Tendero, I. S., Punga, A. R., and Stålberg, E. (2012). Usefulness of assessing repeater F-waves in routine studies. Muscle Nerve 45, 477-485. doi: 10.1002/mus.22333
PubMed Abstract | CrossRef Full Text | Google Scholar
de Carvalho, M., Scotto, M., Lopes, A., and Swash, M. (2002). F-waves i corticospinal lesion w stwardnieniu zanikowym bocznym. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 3, 131-136. doi: 10.1080/146608202760834139
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Kovach, I., and Groozman, G. B. (2001). Electrophysiologic ocena górnego neuronu ruchowego zaangażowania w stwardnienie zanikowe boczne. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 2, 147-152. doi: 10.1080/146608201753275616
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Neufeld, M. Y., and Korczyn, A. D. (1993). F-wave characteristics following acute and chronic upper motor neuron leisions. Electromyogr. Clin. Neurophysiol. 33, 441-446.
PubMed Abstract | Google Scholar
Fang, J., Cui, L.-Y., Liu, M.-S., Guan, Y.-Z., Li, X.-G., Cui, B., et al. (2015). F-wave study in amyotrophic lateral sclerosis: assessment of segmental motoneuronal dysfunction. Chin. Med. J. 128, 1738-1742. doi: 10.4103/0366-6999.159346
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A. (1992). H-refleksy i fale F: fizjologia i wskazania kliniczne. Muscle Nerve 15, 1223-1233. doi: 10.1002/mus.880151102
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A., Hoffen, B., and Hultman, C. (1994). Normatywne wartości fali F i liczba zarejestrowanych fal F. Muscle Nerve 17, 1185-1189. doi: 10.1002/mus.880171009
PubMed Abstract | CrossRef Full Text | Google Scholar
Gooch, C. L., Doherty, T. J., Chan, K. M., Bromberg, M. B., Lewis, R. A., Stashuk, D. W., et al. (2014). Szacowanie liczby jednostek motorycznych: technologia i przegląd literatury. Muscle Nerve 50, 884-893. doi: 10.1002/mus.24442
PubMed Abstract | CrossRef Full Text | Google Scholar
Hachisuka, A., Komori, T., Abe, T., and Hachisuka, K. (2015). Repeater F-waves are signs of motor unit pathology in polio survivors. Muscle Nerve 51, 680-685. doi: 10.1002/mus.24428
PubMed Abstract | CrossRef Full Text | Google Scholar
Ibrahim, I. K., and el-Abd, M. A. (1997). Olbrzymia powtarzająca się fala F u pacjentów z zaburzeniami komórek rogów przednich. Role of motor unit size. Am. J. Phys. Med. Rehabil. 76, 281-287. doi: 10.1097/00002060-199707000-00006
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J.-E., Hong, Y.-H., Lee, J.-H., Ahn, S.-W., Kim, S.-M., Park, K.-S., et al. (2015). Pattern difference of dissociated hand muscle atrophy in amyotrophic lateral sclerosis and variants. Muscle Nerve 51, 333-337. doi: 10.1002/mus.24323
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Mizobuchi, K., Ogawara, K., and Hattori, T. (1999). Dissociated small hand muscle involvement in amyotrophic lateral sclerosis detected by motor unit number estimates. Muscle Nerve 22, 870-873. doi: 10.1002/(sici)1097-4598(199907)22:7<870::aid-mus9>3.0.co;2-o
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Sonoo, M., Komori, T., Shimizu, T., Hirashima, F., Inaba, A., et al. (2008). Dissociated small hand muscle atrophy in amyotrophic lateral sclerosis: frequency, extent and specificity. Muscle Nerve 37, 426-430. doi: 10.1002/mus.20949
PubMed Abstract | CrossRef Full Text | Google Scholar
Macdonell, R. A. L., Jackson, G. D., Curatolo, J. M., Abbott, D. F., Berkovic, S. F., Carey, L. M., et al. (1999). Motor cortex localization using functional MRI and transcranial magnetic stimulation. Neurology 53, 1462-1467. doi: 10.1212/wnl.53.7.1462
PubMed Abstract | CrossRef Full Text | Google Scholar
Menon, P., Kiernan, M. C., and Vucic, S. (2014). Cortical excitability differences in hand muscles follow a split-hand pattern in healthy controls. Muscle Nerve 49, 836-844. doi: 10.1002/mus.24072
PubMed Abstract | CrossRef Full Text | Google Scholar
Milanov, I. G. (1992). F-wave for assessment of segmental motoneurone excitability. Electromyogr. Clin. Neurophysiol. 32, 11-15.
PubMed Abstract | Google Scholar
Pastore-Olmedo, C., Gonzáez, O., and Geijo-Barrientosc, E. (2009). A study of F-waves in patients with unilateral lumbosacral radiculopathy. Eur. J. Neurol. 16, 1233-1239. doi: 10.1111/j.1468-1331.2009.02764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Peioglou-Harmoussi, S., Fawcett, P. R. W., Howel, D., and Barwick, D. D. (1987). F-response frequency in motor neuron disease and cervical spondylosis. J. Neurol. Neurosurg. Psychiatry 50, 593-599. doi: 10.1136/jnnp.50.5.593
PubMed Abstract | CrossRef Full Text | Google Scholar
Petajan, J. H. (1985). Fale F w neurogennej atrofii. Muscle Nerve 8, 690-696. doi: 10.1002/mus.880080811
PubMed Abstract | CrossRef Full Text | Google Scholar
Puksa, L., Stålberg, E., and Falck, B. (2003). Occurrence of A-waves in F-wave studies of healthy nerves. Muscle Nerve 28, 626-629. doi: 10.1002/mus.10448
PubMed Abstract | CrossRef Full Text | Google Scholar
Ramírez-Jarquín, U. N., Lazo-Gómez, R., Tovar-y-Romo, L. B., and Tapia, R. (2014). Spinal inhibitory circuits and their role in motor neuron degeneration. Neuropharmacology 82, 101-107. doi: 10.1016/j.neuropharm.2013.10.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Roche, J. C., Rojas-Garcia, R., Scott, K. M., Scotton, W., Ellis, C. E., Burman, R., et al. (2012). A proposed staging system for amyotrophic lateral sclerosis. Brain 135, 847-852. doi: 10.1093/brain/awr351
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, H. H., and Stalberg, E. (1978). Odpowiedzi F badane za pomocą pojedynczych włókien EMG u osób zdrowych i pacjentów spastycznych. J. Neurol. Neurosurg. Psychiatry 41, 45-53. doi: 10.1136/jnnp.41.1.45
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibuya, K., Misawa, S., Nasu, S., Sekiguchi, Y., Mitsuma, S., Beppu, M., et al. (2013). Split hand syndrome in amyotrophic lateral sclerosis: different excitability changes in the thenar and hypothenar motor axons. J. Neurol. Neurosurg. Psychiatry 84, 969-972. doi: 10.1136/jnnp-2012-304109
PubMed Abstract | CrossRef Full Text | Google Scholar
Turner, M. R., and Kiernan, M. C. (2012). Does interneuronal dysfunction contribute to neurodegeneration in amyotrophic lateral sclerosis. Amyotroph. Lateral Scler. 13, 245-250. doi: 10.3109/17482968.2011.636050
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dijk, J. P., Schelhaas, H. J., Van Schaik, I. N., Janssen, H. M. H. A., Stegeman, D. F., and Zwarts, M. J. (2010). Monitoring disease progression using high-density motor unit number estimation in amyotrophic lateral sclerosis. Muscle Nerve 42, 239-244. doi: 10.1002/mus.21680
PubMed Abstract | CrossRef Full Text | Google Scholar
Vucic, S., and Kiernan, M. C. (2010). Upregulation of persistent sodium conductances in familial ALS. J. Neurol. Neurosurg. Psychiatry 81, 222-227. doi: 10.1136/jnnp.2009.183079
PubMed Abstract | CrossRef Full Text | Google Scholar
Weber, M., Eisen, A., Stewart, H., and Hirota, N. (2000). The split hand in ALS has a cortical basis. J. Neurol. Sci. 180, 66-70. doi: 10.1016/s0022-510x(00)00430-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilbourn, A. J. (2000). Zespół rozdwojonej ręki. Muscle Nerve 23:138. doi: 10.1002/(sici)1097-4598(200001)23:1<138::aid-mus22>3.0.co;2-7
PubMed Abstract | CrossRef Full Text | Google Scholar
.