Ocena | Biopsychologia | Porównawcza | Poznawcza | Rozwojowa | Językowa | Różnice indywidualne | Osobowość | Filozoficzna | Społeczna |
Metody | Statystyka | Kliniczna | Edukacyjna | Przemysłowa | Zawodowa | Psychologia świata |
Biologiczna:Genetyka behawioralna – Psychologia ewolucyjna – Neuroanatomia – Neurochemia – Neuroendokrynologia -Neurobiologia – Psychoneuroimmunologia – Psychologia fizjologiczna – Psychofarmakologia(Indeks, Zarys)
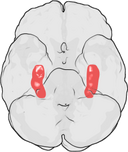
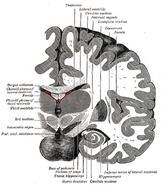
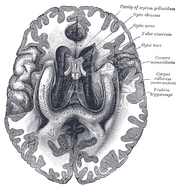
Położenie hipokampa w mózgu człowieka.
Do czasopisma o tej samej nazwie, patrz Hipokamp (czasopismo)
Hipokamp jest częścią przodomózgowia, zlokalizowaną w przyśrodkowym płacie skroniowym. Należy do układu limbicznego i odgrywa główną rolę w pamięci długotrwałej i nawigacji przestrzennej. Ludzie i inne ssaki mają dwa hipokampy, po jednym z każdej strony mózgu. U gryzoni, gdzie badano go najszerzej, hipokamp ma kształt zbliżony do banana. U ludzi ma on zakrzywiony i zawiły kształt, który przypominał wczesnym anatomom konika morskiego. Nazwa, w rzeczywistości, pochodzi od greckiego słowa dla konika morskiego (greckie: hippos = koń, campos = morze).
W chorobie Alzheimera, hipokamp jest jednym z pierwszych regionów mózgu, aby cierpieć szkody; problemy z pamięcią i dezorientacja pojawiają się wśród pierwszych objawów. Uszkodzenie hipokampa może również wynikać z niedotlenienia (anoksji), zapalenia mózgu lub padaczki w płacie skroniowym mezjalnym. Osoby z rozległym uszkodzeniem hipokampa mogą doświadczyć amnezji, czyli niezdolności do tworzenia lub zachowywania nowych wspomnień.
Funkcje hipokampa
Prawdopodobnie najwcześniejszym pomysłem było to, że hipokamp jest zaangażowany w węch: wydaje się, że zostało to zasugerowane głównie przez jego lokalizację w mózgu, obok kory węchowej. Nadal istnieje pewne zainteresowanie hipokampalnych odpowiedzi węchowych, ale prawie nikt teraz nie wierzy, że podstawowa funkcja hipokampa jest węchowa.
Przez lata w literaturze dominowały trzy główne koncepcje funkcji hipokampa: hamowanie, pamięć i przestrzeń. Behawioralna teoria hamowania (karykaturalnie przedstawiona przez O’Keefe’a i Nadela jako “krok na hamulcach!”) była bardzo popularna aż do lat 60-tych. Pochodziła ona w dużej mierze z dwóch obserwacji: po pierwsze, zwierzęta z uszkodzonym hipokampem mają tendencję do bycia nadpobudliwymi; po drugie, zwierzęta z uszkodzonym hipokampem często mają trudności z nauczeniem się hamowania reakcji, których zostały wcześniej nauczone. Jeffrey Gray rozwinął tę linię myślenia w pełnoprawną teorię roli hipokampa w lęku. Teoria hamowania nie jest jednak obecnie zbyt popularna.
Druga ważna linia myślenia odnosi hipokamp do pamięci. Chociaż miała ona swoich prekursorów, idea ta wywodziła swoją główną siłę z bardzo znanego raportu Scoville’a i Milnera o rezultatach chirurgicznego zniszczenia hipokampa (w próbie złagodzenia napadów padaczkowych), u pacjenta znanego jako H.M. Nieoczekiwanym rezultatem była ciężka amnezja: H.M. nie był w stanie świadomie pamiętać wydarzeń, które miały miejsce po jego operacji lub przez kilka lat przed nią. Przypadek ten wzbudził tak wielkie zainteresowanie, że H.M. jest obecnie uważany za najintensywniej badany przypadek medyczny w historii. W następnych latach badano również innych pacjentów z podobnym stopniem uszkodzenia hipokampa i amnezją (spowodowaną wypadkiem lub chorobą), a dosłownie tysiące eksperymentów badało fizjologię plastyczności neuronalnej w hipokampie. Obecnie istnieje niemal powszechna zgoda, że hipokamp odgrywa jakąś ważną rolę w pamięci; jednak dokładna natura tej roli pozostaje szeroko dyskutowana.
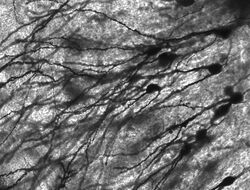
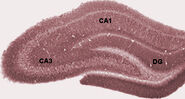
Wybarwione golgiami neurony w hipokampie gryzoni.
Rola w pamięci
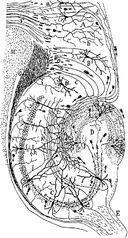
Rysunek obwodu neuronalnego hipokampa gryzoni. S. Ramón y Cajal, 1911.
Psychologowie i neuronaukowcy spierają się o dokładną rolę hipokampa, ale generalnie zgadzają się, że ma on zasadniczą rolę w tworzeniu nowych wspomnień dotyczących osobiście przeżytych wydarzeń (pamięć epizodyczna lub autobiograficzna). Niektórzy badacze wolą uważać hipokamp za część większego systemu pamięci w przyśrodkowym płacie skroniowym, odpowiedzialnego za ogólną pamięć deklaratywną (wspomnienia, które mogą być wyraźnie zwerbalizowane – obejmowałyby one, na przykład, pamięć faktów oprócz pamięci epizodycznej).
Główny artykuł: Rola hipokampa w pamięci
Rola w pamięci przestrzennej i nawigacji
Niektóre dowody wskazują na udział hipokampa w przechowywaniu i przetwarzaniu informacji przestrzennych. Badania na szczurach wykazały, że neurony w hipokampie mają przestrzenne pola odpalania. Komórki te nazywane są komórkami miejsca. Niektóre komórki odpalają się, gdy zwierzę znajdzie się w określonym miejscu, niezależnie od kierunku podróży, podczas gdy większość jest przynajmniej częściowo wrażliwa na kierunek głowy i kierunek podróży.
Główny artykuł: Rola hipokampa w pamięci przestrzennej i nawigacji
Hipokamp a depresja
- Utrata objętości hipokampa,być może odzwierciedlająca wpływ nadmiernej ilości glikokortykoidów na
neurogenezę została zidentyfikowana w grupach osób z depresją w porównaniu z osobami z grupy kontrolnej.
Główny artykuł: Depresja a hipokamp
Historia
Anatomista Giulio Cesare Aranzi (ok. 1564) po raz pierwszy użył terminu hipokamp na określenie narządu mózgowego ze względu na jego wizualne podobieństwo do konika morskiego. Organ ten początkowo łączono raczej ze zmysłem węchu niż z jego znaną funkcją w nabywaniu pamięci. Rosjanin Władimir Bekhterev zauważył rolę hipokampa w pamięci około 1900 roku, na podstawie obserwacji pacjenta z głębokimi zaburzeniami pamięci. Jednak przez wiele lat konwencjonalny pogląd na temat hipokampa był taki, że podobnie jak reszta układu limbicznego, był on odpowiedzialny za emocje.
Na znaczenie hipokampa w pamięci zwrócił uwagę badaczy pacjent HM. HM cierpiał na szereg upośledzeń pamięci anterograde i retrograde w czasie (takie upośledzenia są przedmiotem filmu Memento) po obustronnym usunięciu różnych struktur płata środkowo-skroniowego (w tym obustronnej ablacji jego hipokampów) w celu złagodzenia częstych napadów padaczkowych. Szczególnie ważne jest to, że HM nadal był w stanie uczyć się zadań proceduralnych (które są związane ze striatum) i miał ponadprzeciętny IQ. HM wykazał uderzającą, pojedynczą dysocjację między inteligencją a pamięcią deklaratywną. Względna wielkość formacji hipokampa w stosunku do całkowitej objętości mózgu jest często konserwowana u większości gatunków ssaków. Niemniej jednak stwierdzono, że obszary te są stosunkowo hipotroficzne u waleni.
Anatomia
Główny artykuł: Hippocampus anatomy
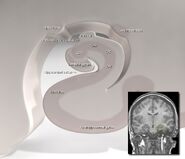
Human hippocampus.
Nissl-stained coronal section of the brain of a macaque monkey, showing hippocampus (circled). Źródło: brainmaps.org
Anatomicznie, hipokamp jest rozwinięciem krawędzi kory mózgowej. Można go wyróżnić jako strefę, w której kora zwęża się do pojedynczej warstwy bardzo gęsto upakowanych neuronów, która zwija się w ciasny kształt litery S. Struktury, które znajdują się na obrzeżach kory, tworzą tzw. układ limbiczny (łac. limbus = granica): należą do niego hipokamp, kora zakrętu obręczy, kora węchowa i migdałek. Paul MacLean zasugerował kiedyś, w ramach swojej teorii trójjedynego mózgu, że struktury limbiczne obejmują neuronalne podstawy emocji. Większość neuronaukowców nie wierzy już, że koncepcja zunifikowanego “układu limbicznego” jest ważna, chociaż.
Hipokamp, jako całość, kończy się wyglądem czegoś w rodzaju zakrzywionej rury, która była różnie przyrównywana do konika morskiego, lub baraniego rogu (Cornu Ammonis), lub banana.Ten ogólny układ utrzymuje się w całym zakresie gatunków ssaków, od jeża do człowieka, chociaż szczegóły różnią się. U szczura dwa hipokampy wyglądają zadziwiająco jak para bananów, połączonych na szypułce. W mózgach ludzi i małp część hipokampa znajdująca się na dole, w pobliżu podstawy płata skroniowego, jest znacznie szersza niż część znajdująca się na górze. Jedną z konsekwencji tej złożonej geometrii jest to, że przekroje przez hipokamp mogą wykazywać zdumiewającą różnorodność kształtów, w zależności od kąta i lokalizacji cięcia.
Najsilniejsze połączenia hipokampa są z korą entorhinalną (EC), która leży obok niego w płacie skroniowym. Warstwy powierzchowne KE dostarczają najliczniejszych wejść do hipokampa, a warstwy głębokie KE odbierają najliczniejsze wyjścia. Z kolei EC jest silnie i wzajemnie połączone z wieloma innymi częściami kory mózgowej. Hipokamp otrzymuje również bardzo ważną projekcję z okolicy przegrody przyśrodkowej. Zniszczenie obszaru przegrody środkowej powoduje zniesienie hipokampalnego rytmu theta i poważnie upośledza niektóre rodzaje pamięci. (Uważa się, że tak zwane leki “gwałtu na randce” wywierają swoje efekty amnestyczne przynajmniej częściowo poprzez antagonizowanie projekcji cholinergicznej z przegrody przyśrodkowej do hipokampa.)
Fizjologia
Przykłady EEG hipokampa szczura i aktywności neuronalnej CA1 w trybach theta (czuwanie/behaving) i LIA (sen wolnofalowy). Każdy wykres przedstawia 20 sekund danych, ze śladem EEG hipokampa na górze, rastrami spajków z 40 jednocześnie zarejestrowanych komórek piramidowych CA1 w środku (każda linia rastra reprezentuje inną komórkę), oraz wykresem prędkości biegu na dole. Górny wykres przedstawia okres czasu, w którym szczur aktywnie poszukiwał rozrzuconych granulek jedzenia. Dla dolnego wykresu, szczur spał.
Hipokamp wykazuje dwa główne “tryby” aktywności, każdy związany z odrębnym wzorcem fal EEG i aktywności populacji neuronów.Tryby te są nazwane tak, jak związane z nimi wzorce EEG: theta i duża nieregularna aktywność (LIA). Oto niektóre z ich głównych cech u szczura, zwierzęcia, które zostało najbardziej obszernie zbadane:
Tryb theta pojawia się podczas stanów aktywnych, czujne zachowanie (zwłaszcza lokomocji), a także podczas REM (sen) sen. W trybie theta, EEG jest zdominowany przez duże regularne fale o częstotliwości od 6 do 9 Hz, a główne grupy neuronów hipokampa (komórki piramidowe i komórki ziarniste) wykazują skąpą aktywność populacji, co oznacza, że w każdym krótkim przedziale czasu, zdecydowana większość komórek jest cicha, podczas gdy niewielka pozostała frakcja strzela w stosunkowo wysokim tempie, do 50 spajków w ciągu jednej sekundy dla najbardziej aktywnych z nich. Aktywna komórka zazwyczaj pozostaje aktywna przez pół sekundy do kilku sekund. W miarę jak szczur się zachowuje, aktywne komórki milkną, a nowe stają się aktywne, ale ogólny odsetek aktywnych komórek pozostaje mniej więcej stały. W wielu sytuacjach aktywność komórek jest określona w dużej mierze przez lokalizację przestrzenną zwierzęcia, ale inne zmienne behawioralne również wyraźnie na nią wpływają.
Tryb LIA pojawia się podczas snu wolnofalowego (bez marzeń sennych), a także podczas stanów bezruchu na jawie, takich jak odpoczynek lub jedzenie. W trybie LIA, EEG jest zdominowany przez ostre fale, które są losowo rozłożonymi w czasie dużymi odchyleniami sygnału EEG trwającymi 200-300msec. Te ostre fale wyznaczają również wzory aktywności neuronalnej populacji. Pomiędzy nimi, komórki piramidowe i komórki ziarniste są bardzo ciche (ale nie nieme). Podczas ostrej fali aż 5-10% populacji może emitować potencjały czynnościowe w okresie 50 ms; wiele z tych komórek emituje nie jeden, lecz serię spajków.
Te dwa tryby aktywności hipokampa można zaobserwować zarówno u naczelnych, jak i u szczurów, z tym ważnym wyjątkiem, że trudno było zaobserwować silną rytmiczność theta w hipokampie naczelnych. Istnieją, jednak, jakościowo podobne ostre fale, i similarstate-zależne zmiany w neuronalnej populationactivity..
Rytm theta
Z powodu jego gęsto upakowane warstwy neuronalne, hipokamp generatessome z największych sygnałów EEG każdej struktury mózgu. W niektórych sytuacjach EEG jest zdominowany przez regularne fale, często trwające formany sekund. Ten wzorzec EEG znany jest jako rytm theta. Był on jednym z najwcześniej odkrytych zjawisk EEG: pierwszy opis pochodzi od Junga i Kornmullera, w 1938 roku. Jednak dopiero w 1954 roku, po opublikowaniu przez Greena i Arduiniego długich i dokładnych badań rytmu theta u królików, kotów i małp, zainteresowanie nim naprawdę wzrosło. Być może głównie dlatego, że powiązali oni rytm theta z pobudzeniem, co było gorącym tematem tamtych czasów, ich praca sprowokowała zalew dalszych badań, w wyniku czego w latach 50-tych i 60-tych opublikowano dosłownie setki prac dotyczących fizjologii i farmakologii theta. Pomimo tego ogromnego dorobku, wiele pytań pozostało bez odpowiedzi, zwłaszcza pytanie o funkcję. Nawet w chwili obecnej ten najbardziej krytyczny z pytań nie został jeszcze przekonująco answered.
Theta rytmiczność jest bardzo oczywiste w królików i gryzoni, a alsoclearly obecny w kotów i psów. Czy theta mogą być widoczne u naczelnych jest kłopotliwym pytaniem. Green i Arduini podali tylko krótkie wybuchy raczej nieregularnej rytmiczności u małp, a większość późniejszych badań wykazała niewiele więcej. Jednak różnice w metodologii sprawiły, że trudno jest wyciągnąć silne wnioski.
W szczurach (zwierzęta, które zostały zdecydowanie najbardziej extensivelystudied), theta jest postrzegane głównie w dwóch warunkach: po pierwsze, gdy zwierzę jest chodzenie lub w inny sposób aktywnie interakcji z itssurroundings; po drugie, podczas snu REM. Częstotliwość wzrasta jako funkcja prędkości biegu, począwszy od około 6,5 Hz na niskim końcu, i wzrasta do około 9 Hz na wysokim końcu, chociaż wyższe częstotliwości są czasami widoczne dla dramatycznych ruchów, takich jak skoki przez szerokie szczeliny. W innych, większych, gatunków zwierząt, thetafrequencies są na ogół nieco niższe. Zależność behawioralna również wydaje się różnić w zależności od gatunku: u kotów i królików, theta jest często obserwowane podczas stanów bezruchu czujności. To zostałoreported dla szczurów, jak również, ale tylko wtedy, gdy są one poważnie frightened.
Theta nie jest tylko ograniczony do hipokampa. U szczurów, to może byćobserwowane w wielu częściach mózgu, w tym prawie wszystkie, któreinteract silnie z hipokampa. Stymulator rytmu uważa się, że leży w przyśrodkowym obszarze przegrody: obszar ten projectsto wszystkich regionów, które pokazują rytmiczność theta, a zniszczenie go eliminuje theta w całym mózgu. (Może być jeden wyjątek, mały obszar w podwzgórzu zwany jądrem supramarynowym, który wydaje się być w stanie utrzymać theta niezależnie od przegrody w niektórych sytuacjach.)
Funkcja theta, zakładając, że ma jeden, nie został jeszcze przekonująco wyjaśnione, chociaż liczne teorie zostały zaproponowane.Najbardziej popularnym trendem było powiązanie jej z uczeniem się i pamięcią.Dobrze ustalono, że zmiany w przegrodzie środkowej–centralnym węźle systemu theta–powodują poważne zaburzenia pamięci.Jednak przegroda środkowa jest czymś więcej niż tylko kontrolerem theta, jest również głównym źródłem projekcji cholinergicznych dohipokampa. Nie ustalono, że zmiany w przegrodzie środkowej wywierają swój wpływ szczególnie poprzez eliminację theta.
Ostre fale
Podczas snu, lub podczas stanów czuwania, gdy zwierzę odpoczywa lub w inny sposób nie jest zaangażowane w swoje otoczenie, EEG hipokampa pokazuje wzór nieregularnych fal wolnych, nieco większych w amplitudzie niż fale theta. Wzorzec ten jest czasami przerywany przez duże skoki zwane falami ostrymi. Zdarzenia te wiążą się z wybuchami aktywności typu spike, trwającymi 50-100 ms, w komórkach piramidowych CA3 iCA1. Wiążą się one również z krótkotrwałymi falami EEG o wysokiej częstotliwości, zwanymi “ripples”. Ripple, których częstotliwość u szczurów mieści się w zakresie 150-200 Hz, mogą być zwykle wykryte tylko przez elektrody umieszczone wewnątrz lub bardzo blisko warstwy ciała komórki CA1. Incontrast, elektrody zlokalizowane w dowolnym miejscu wewnątrz hipokampa, a nawet w sąsiednich struktur mózgu, często będzie podnieść ostre fale aslarge powolne EEG deflections, trwające 200-400 msec.
W szczurów, ostre fale są najbardziej solidne podczas snu, kiedy występują w średnim tempie około 1 na sekundę, ale w bardzo nieregularnych temporalpattern. Ostre fale występują również podczas nieaktywnych stanów czuwania, ale są wtedy rzadsze i zwykle mniejsze. Ostre fale zostały również zaobserwowane w ludzkim płacie skroniowym i hipokampie małp. U małp, ostre fale są dość silne, ale nie występują prawie tak często jak u szczurów.
Jednym z najbardziej interesujących aspektów ostrych fal jest to, że wydają się być związane z pamięcią. Wilson i McNaughton 1994, oraz liczne późniejsze badania, donoszą, że kiedy komórki miejsca hipokampa mają nakładające się przestrzenne pola odpalania (i dlatego często odpalają inne prawie równoczesne), mają tendencję do pokazywania skorelowanej aktywności podczas snu następującego po sesji behawioralnej. Stwierdzono, że to wzmocnienie korelacji, powszechnie znane jako reaktywacja, jest ograniczone głównie do fal ostrych. Zaproponowano, że ostre fale są w rzeczywistości reaktywacją wzorców aktywności neuronalnej, które zostały zapamiętane podczas zachowania, napędzane przez wzmocnienie połączeń synaptycznych w obrębie hipokampa. Pomysł ten stanowi kluczowy składnik teorii “pamięci dwuetapowej”, popieranej przez Buzsaki i innych, która zakłada, że wspomnienia są przechowywane w hipokampie podczas zachowania, a następnie przenoszone do neokory podczas snu: sugeruje się, że ostre fale napędzają hebrajskie zmiany synaptyczne w neokorowych celach hipokampalnych ścieżek wyjściowych.
Ewolucja
Hipokamp ma ogólnie podobny wygląd w całym zakresie gatunków ssaków, od podstawowych, takich jak jeż do najbardziej “zaawansowanych”, takich jak ludzie.stosunek wielkości hipokampa do wielkości ciała szeroko wzrasta, będąc około dwa razy tak duże dla naczelnych jak dla jeża. Nie wzrasta on jednak w tempie zbliżonym do tempa wzrostu neocortex-to-body-size ratio.Tak więc, hipokamp zajmuje znacznie większą objętość płaszcza korowego u gryzoni niż u naczelnych.
Istnieje również ogólny związek między wielkościąhipokampa a pamięcią przestrzenną: kiedy dokonuje się porównań między podobnymi gatunkami, te, które mają większą zdolność do pamięci przestrzennej, mają większe objętości hipokampa… Związek ten rozciąga się również na różnice płci: w gatunkach, w których samce i samice wykazują silne różnice w zdolnościach pamięci przestrzennej, wykazują one również tendencję do wykazywania odpowiednich różnic w objętości hipokampa
Gatunki niemałpokształtne nie mają struktury mózgu, która wygląda jak hipokamp ssaków, ale mają taką, która jest uważana za homologiczną do niego. Hipokamp, jak wskazano powyżej, jest zasadniczo przyśrodkową krawędzią kory mózgowej. Tylko ssaki mają w pełni rozwiniętą korę, ale struktura, z której wyewoluowała, zwana pallium, jest obecna u wszystkich kręgowców, nawet tych najbardziej prymitywnych, takich jak minóg czy włóczęga. Pallium dzieli się zwykle na trzy strefy: przyśrodkową, boczną i grzbietową. Paliczek przyśrodkowy tworzy prekursora hipokampa. To nie przypomina hipokampa wizualnie, ponieważ warstwy nie są wypaczone w kształcie litery S lub owinięte przez dentate gyrus, ale homologia w wskazany przez silne chemiczne i funkcjonalne pokrewieństwa. Istnieje obecnie dowód, żethese hippocampal-like stuktur są zaangażowane w poznanie przestrzenne u ptaków, gadów i fish.
W ptaków, korespondencja jest wystarczająco dobrze ustalone, że większość anatomów odnoszą się do przyśrodkowej strefy podniebiennej jako “avianhippocampus”. Liczne gatunki ptaków mają silne umiejętności przestrzenne, zwłaszcza te, które cache żywności. Istnieją dowody na to, że ptaki skrytobójcy żywności mają większy hipokamp niż inne rodzaje ptaków, i że uszkodzenie hipokampa powoduje upośledzenie pamięci przestrzennej….
The historia dla ryb jest bardziej złożona. W teleost ryb (które makijaż ogromną większość istniejących gatunków), forebrain jest dziwniedistorted w porównaniu do innych rodzajów kręgowców. Większość neuroanatomów uważa, że przodomózgowie teleostów jest zasadniczo odwrócone, jak skarpeta odwrócona do wewnątrz, tak że struktury, które leżą wewnątrz, obok komór, dla większości kręgowców, znajdują się na zewnątrz u ryb teleostów, i viceversa. Jedną z konsekwencji tego jest to, że przyśrodkowe pallium (strefa “hipokampalna”) typowego kręgowca jest uważane za odpowiadające bocznemu pallium typowej ryby. Kilka rodzajów ryb (szczególnie ryb złotowłosych) wykazano eksperymentalnie, że mają one silne zdolności pamięci przestrzennej, a nawet tworzą “mapy poznawcze” obszarów, które zamieszkują. There is evidencethat damage to the lateral pallium impairs spatialmemory.(Long-distance navigation, such as homing by salmon, seems to rely ondifferent mechanisms, however.)
Thus, the role of the hippocampal region in navigation appears to beginfar back in vertebrate evolution, predating splits that occurredhundreds of millions of years ago. Nie wiadomo jeszcze, czy paliczek przyśrodkowy odgrywa podobną rolę u jeszcze prymitywniejszych kręgowców, takich jak rekiny i płaszczki, a nawet minogi i morświny. Niektóre rodzaje owadów i mięczaków, takich jak ośmiornica, również mają silne zdolności przestrzennego uczenia się i nawigacji, ale wydają się one działać inaczej niż system przestrzenny ssaków, więc nie ma jeszcze dobrego powodu, by sądzić, że mają one wspólne ewolucyjne pochodzenie; nie ma też wystarczającego podobieństwa w budowie mózgu, by umożliwić zidentyfikowanie u tych gatunków czegoś przypominającego “hipokamp”.
Zobacz także
- Amygdalohippocampectomy
- Median forebrain bundle
- Septal nuclei
Referencje & Bibliografia
Teksty kluczowe
Książki
- Aboitiz, F, Morales D, Montiel J (2003). The evolutionary origin of the mammalian isocortex: Towards an integrated developmental and functional approach. Behav. Brain Sciences 26: 535-552.
- Amaral, D; Lavenex P (2006). “Ch 3. Hippocampal Neuroanatomy” Andersen P, Morris R, Amaral D, Bliss T, O’Keefe J The Hippocampus Book, Oxford University Press.
- Broglio, C, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C (2002). Cechy wspólnego planu przodomózgowia kręgowców: Specialized pallial areas for spatial, temporal and emotional memory in actinopterygian fish. Brain Res. Bull. 57: 397-399.
- Buzsáki, G (2002). Oscylacje theta w hipokampie. Neuron 33: 325-340.
- Buzsáki, G (2006). Rhythms of the Brain.
- Cantero, JL, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B (2003). Sleep-dependent theta oscylacje w ludzkim hipokampie i neocortex. J. Neurosci. 23: 10897-10903.
- Colombo, M, Broadbent N (2000). Is the avian hippocampus a functional homologue of the mammalian hippocampus? Neurosci. Biobehav. Rev. 24: 465-484.
- Eichnbaum, H; Cohen NJ (1993). Memory, Amnesia, and the Hippocampal System, MIT Press.
- Ekstrom, AD, Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, Fried I (2003). Cellular networks underlying human spatial navigation. Nature 425: 184-188.
- Gray, JA; McNaughton N (2000). The Neuropsychology of Anxiety: An Enquiry into the Functions of the Septo-Hippocampal System, Oxford University Press.
- Green, JD, Arduini AA (1954). Hipokampalna aktywność elektryczna w pobudzeniu. J. Neurophysiol. 17: 533-557.
- Jacobs, LF, Gaulin SJ, Sherry DF, Hoffman GE (1990). Evolution of spatial cognition: sex-specific patterns of spatial behavior predict hippocampal size. PNAS 87: 6349-6352.
- Jacobs, LF (2003). The Evolution of the Cognitive Map. Brain Behav. Evol. 62: 128-139.
- Kirk, IJ, McNaughton N (1991). Supramammillary cell firing and hippocampal rhythmical slow activity. Neuroreport 11: 723-725.
- Maguire, EA, Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, Frith CD (2000). Navigation-related structural change in the hippocampi of taxi drivers. PNAS 97: 4398-4403.
- McNaughton, BL, Battaglia FP, Jensen O, Moser EI, Moser MB (2006). Path integration and the neural basis of the ‘cognitive map’. Nat. Rev. Neurosci. 7: 663-678.
- Moser, EI, Kropf E, Moser M-B (2008). Place Cells, Grid Cells, and the Brain’s Spatial Representation System. Ann. Rev. Neurosci. 31.
- Nieuwenhuys, R (1982). An Overview of the Organization of the Brain of Actinopterygian Fishes. Am. Zool. 22: 287-310.
- O’Kane, G, Kensinger EA, Corkin S (2004). Evidence for semantic learning in profound amnesia: An investigation with patient H.M.. Hippocampus 14: 417-425.
- O’Keefe, J; Nadel L (1978). The Hippocampus as a Cognitive Map, Oxford University Press.
- Portavella, M, Vargas JP, Torres B, Salas C (2002). The effects of telencephalic pallial lesions on spatial, temporal, and emotional learning in goldfish. Brain Res. Bull. 57: 397-399.
- Rodríguez, F, Lópeza JC, Vargasa JP, Broglioa C, Gómeza Y, Salas C (2002). Spatial memory and hippocampal pallium through vertebrate evolution: insights from reptiles and teleost fish. Brain Res. Bull. 57: 499-503.
- Sainsbury, RS, Heynen A, Montoya CP (1987). Behavioral correlates of hippocampal type 2 theta in the rat. Physiol. Behav. 39: 513-519.
- Scoville, WB, Milner B (1957). Loss of Recent Memory After Bilateral Hippocampal Lesions. J. Neurol. Neurosurg. Psych. 20: 11-21.
- Shettleworth, SJ (2003). Memory and Hippocampal Specialization in Food-Storing Birds: Challenges for Research on Comparative Cognition. Brain Behav. Evol. 62: 108-116.
- Skaggs, WE, McNaughton BL, Wilson MA, Barnes CA (1996). Theta phase precession in hippocampal neuronal populations and the compression of temporal sequences. Hippocampus 6: 149-176.
- Squire, LR (1992). Memory and the hippocampus: a synthesis from findings with rats, monkeys, and humans. Psych. Rev. 99: 195-231.
- Squire, LR; Schacter DL (2002). The Neuropsychology of Memory, Guilford Press.
- Vanderwolf, CH (1969). Hippocampal electrical activity and voluntary movement in the rat. EEG & Clin. Neurophysiol. 26: 407-418.
- Vargas, JP, Bingman VP, Portavella M, López JC (2006). Telencephalon and geometric space in goldfish. Eur. J. Neurosci. 24: 2870-2878.
- West, MJ (1990). Stereological studies of the hippocampus: a comparison of the hippocampal subdivisions of diverse species including hedgehogs, laboratory rodents, wild mice and men. Prog. Brain Res. 83: 13-36.
Papers
- Amaral DG and Cowan WM. 1980. Subcortical afferents to the hippocampal formation in the monkey. Journal of Comparative Neurology. Feb 15; 189(4):573-91.
- Duvernoy, H. (2005) The Human Hippocampus, 3rd ed. Berlin: Springer-Verlag.
Materiały dodatkowe
Papers
- Google Scholar
- http://www.psycheducation.org/emotion/hippocampus.htm Wspaniałe wycieczki po mózgu!!!
- BrainMaps at UCDavis hippocampus
- Artificial Hippocampus
- BrainInfo at the University of Washington hier-164
- John O’Keefe & Lynn Nadel (1978) The Hippocampus as a Cognitive Map , Oxford University Press. Full Text
Dodatkowe obrazy
Dodaj zdjęcie do tej galerii
Mózg człowieka: Układ limbiczny
Amygdala – Cingulate gyrus – Fornicate gyrus – Hippocampus – Hypothalamus – Mammillary body – Nucleus accumbens – Orbitofrontal cortex – Parahippocampal gyrus
|
v-d-e
Mózg człowieka: przodomózgowie (móżdżek – kora mózgowa – półkule mózgowe, istota szara) (TA A14.1.09.002-240, 301-320, GA 9.818-826) |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Płat czołowy |
|
||||||||||||||||
| Płat ciemieniowy |
|
Nadolny
|
Medial/inferior
|
Both
|
|||||||||||||
| Płat potyliczny |
|
Superolateral
|
Medial/inferior
|
||||||||||||||
| Płat skroniowy |
|
Kora skroniowa nadskroniowa
|
Medial/inferior
|
||||||||||||||
| Wewnętrzna bruzda płytki |
. |
Nadolne
|
Przyśrodkowy/dolny
|
||||||||||||||
| Płat limbiczny |
|
Inne
|
|||||||||||||||
| Insular lobe |
Long gyrus of insula – Short gyri of insula – Circular sulcus of insula |
||||||||||||||||
| General |
Operculum – Poles of cerebral hemispheres |
||||||||||||||||
Niektóre kategoryzacje są przybliżeniami, a niektóre obszary Brodmanna obejmują gyri.
|
|||||||||||||||||
Na tej stronie wykorzystano treści na licencji Creative Commons pochodzące z Wikipedii (zobacz autorów).