US Pharm. 2012;37(6):26-29.
Przewlekła choroba nerek (CKD) jest definiowana jako trwałe uszkodzenie nerek, któremu towarzyszy obniżenie współczynnika filtracji kłębuszkowej (GFR) i obecność albuminurii. Częstość występowania CKD stale wzrastała w ciągu ostatnich dwóch dekad, a w 2004 roku stwierdzono, że dotyczyła ponad 13% populacji Stanów Zjednoczonych.1 W 2009 roku ponad 570 000 osób w Stanach Zjednoczonych zostało sklasyfikowanych jako cierpiące na schyłkową niewydolność nerek (end-stagenal disease, ESRD), w tym prawie 400 000 pacjentów dializowanych i ponad 17 000 biorców przeszczepów.2 U pacjenta stwierdza się ESRD, gdy wymaga on leczenia zastępczego, w tym dializoterapii lub przeszczepu nerki. Wzrost zachorowalności na CKD jest związany ze starzeniem się społeczeństwa, wzrostem częstości występowania nadciśnienia tętniczego (HTN), cukrzycy i otyłości w populacji Stanów Zjednoczonych. CKD wiąże się z licznymi powikłaniami, takimi jak zaburzenia równowagi elektrolitowej, zaburzenia mineralne i kostne, niedokrwistość, dyslipidemia i HTN. Wiadomo, że CKD jest czynnikiem ryzyka chorób układu sercowo-naczyniowego (cardiovascular disease, CVD), a obniżony wskaźnik GFR i albuminuria są niezależnie związane ze wzrostem śmiertelności z przyczyn sercowo-naczyniowych i wszystkich przyczyn.3,4
HTN występuje u 85% do 95% pacjentów z CKD (stadia 3-5).5Zależność między HTN a CKD ma charakter cykliczny. Niekontrolowana HTN jest czynnikiem ryzyka rozwoju CKD, wiąże się z szybszym postępem CKD i jest drugą główną przyczyną ESRD w Stanach Zjednoczonych.6,7 Postępująca choroba nerek może nasilać niekontrolowaną HTN z powodu rozszerzenia objętości i zwiększonego systemowego oporu naczyniowego.W wielu wytycznych podkreśla się znaczenie obniżenia ciśnienia tętniczego w celu spowolnienia postępu choroby nerek oraz zmniejszenia zachorowalności i śmiertelności z przyczyn sercowo-naczyniowych.8-10 Jednak w celu osiągnięcia i utrzymania odpowiedniej kontroli ciśnienia tętniczego większość pacjentów z CKD wymaga stosowania kombinacji leków przeciwnadciśnieniowych; często konieczne może być zastosowanie nawet trzech lub czterech klas leków.11
Patofizjologia
Nadciśnienie tętnicze jest jedną z głównych przyczyn CKD ze względu na szkodliwy wpływ podwyższonego ciśnienia tętniczego na naczynia nerek.Długotrwałe, niekontrolowane, wysokie ciśnienie tętnicze prowadzi do wysokiego ciśnienia wewnątrzkłębuszkowego, upośledzając filtrację kłębuszkową.12,13 Uszkodzenie kłębuszków nerkowych prowadzi do zwiększenia filtracji białek, co skutkuje nienormalnie zwiększoną ilością białka w moczu (mikroalbuminuria lub białkomocz).12,13 Mikroalbuminuria to obecność niewielkich ilości albumin w moczu i często jest pierwszym objawem ChLC. Białkomocz (stosunek białka do kreatyniny ≥200 mg/g) rozwija się wraz z postępem CKD i wiąże się ze złym rokowaniem zarówno w przypadku chorób nerek, jak i CVD.3,4,14
Jak już wcześniej wspomniano, związek między CKD aHTN jest cykliczny, ponieważ CKD może przyczyniać się do HTN lub ją powodować. Podwyższone ciśnienie tętnicze prowadzi do uszkodzenia naczyń krwionośnych w obrębie nerek, jak również w całym organizmie. Uszkodzenie to upośledza zdolność nerek do filtrowania płynów i odpadów z krwi, prowadząc do zwiększenia objętości płynów we krwi, co powoduje wzrost ciśnienia tętniczego.
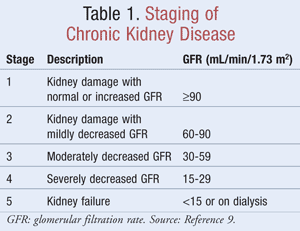
Stopniowanie CKD
Oszacowany GFR, który pomaga klinicystom określić, jak dobrze nerki filtrują odpady, jest wykorzystywany w stopniowaniu CKD. National Kidney Foundation definiuje CKD jako uszkodzenie nerek, stwierdzone markerami w moczu, krwi lub w badaniach obrazowych, z lub bez zmian w GFR, albo GFR <60 mL/min/1,73 m2 przez co najmniej 3 miesiące.9 W TABELI 1 przedstawiono kryteria klasyfikacji zgodnie z wytycznymi Kidney Disease Outcomes Quality Initiative (K/DOQI).9
Cele terapii
Pacjenci z CKD bez cukrzycy i z cukrzycą powinni mieć docelowe ciśnienie tętnicze <130/80 mmHg.8-10Utrzymanie kontroli ciśnienia tętniczego i minimalizacja białkomoczu u pacjentów z CKD i HTN ma zasadnicze znaczenie w zapobieganiu postępowi choroby nerek oraz rozwojowi lub pogorszeniu CVD.8,9
Najnowsze piśmiennictwo sugeruje, że docelowe wartości ciśnienia tętniczego w CKD z cukrzycą i bez cukrzycy mogą wymagać indywidualizacji w zależności od obecności białkomoczu. W niektórych badaniach nie wykazano zmniejszenia ryzyka sercowo-naczyniowego lub nerkowego u pacjentów z CKD z cukrzycą i bez cukrzycy, u których docelowe wartości ciśnienia tętniczego wynoszą <130/80 mmHg, w porównaniu z obniżeniem ciśnienia do <140/90 mmHg.15,16 Jednak u pacjentów z białkomoczem istnieje mniejsze prawdopodobieństwo pogorszenia czynności nerek, niewydolności nerek lub zgonu po osiągnięciu niższej docelowej wartości ciśnienia tętniczego.15,17Prawdopodobnie przyszłe wytyczne mogą zawierać niższą wartość docelową ciśnienia tętniczego, <130/80 mmHg, dla pacjentów z białkomoczem, ale utrzymywać wartość docelową<140/90 mmHg dla pacjentów bez białkomoczu.
Leczenie
Leki, które nie tylko obniżają ciśnienie tętnicze, ale także zmniejszają białkomocz, są zalecane jako terapia pierwszego rzutu u większości pacjentów z CKD iHTN; dane wskazują, że zmniejszenie białkomoczu może przynieść znaczące długoterminowe korzyści zarówno w odniesieniu do wyników sercowo-naczyniowych, jak i nerkowych.9Kilka klas leków przeciwnadciśnieniowych może odgrywać rolę w leczeniu CKD i HTN. Leki działające na układ renina-angiotensyna-aldosteron (RAAS), takie jak inhibitory konwertazy angiotensyny (ACE) lub leki blokujące receptor angiotensyny (ARB), są zwykle uważane za leki przeciwnadciśnieniowe pierwszego rzutu w tej populacji pacjentów.8,9,18 W TABELI 2 przedstawiono wytyczne dotyczące zalecanych leków przeciwnadciśnieniowych u pacjentów z CKD z cukrzycą lub bez cukrzycy i z białkomoczem lub bez białkomoczu.
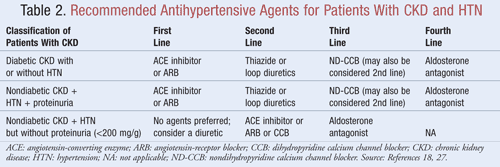
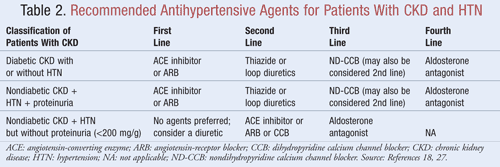
InhibitoryACE lub ARBs: Badania wykazały, że leki przeciwnadciśnieniowe działające na układ renina-angiotensyna zapobiegają pogorszeniu czynności nerek w większym stopniu niż inne leki, nawet przy osiąganiu podobnych wartości ciśnienia tętniczego.19 Wyniki te stwierdzono przede wszystkim u pacjentów z białkomoczem, podczas gdy korzyści były mniejsze u pacjentów bez białkomoczu. Na podstawie tych wyników wytyczne zalecają terapię inhibitorami ACE lub ARB jako leczenie pierwszego rzutu u osób z cukrzycą lub u osób z niecukrzycową chorobą nerek, HTN i białkomoczem. Dane wskazują, że inhibitory ACE i ARB są równie skuteczne w obniżaniu ciśnienia tętniczego i zmniejszaniu białkomoczu.20 Najnowsza metaanaliza sugeruje, że terapia inhibitorem ACE może przynosić większe korzyści niż terapia ARB w leczeniu HTN ze względu na 10% zmniejszenie śmiertelności z wszystkich przyczyn.21 Wyniki te dotyczyły pacjentów z HTN i nie odnosiły się do pacjentów z dodatkowymi chorobami, takimi jak CKD. Dlatego wybór jednego leku zamiast drugiego będzie zależał od czynników specyficznych dla danego pacjenta, takich jak potencjalne działania niepożądane i koszty. Nie zaleca się leczenia zarówno inhibitorem ACE, jak i ARB, ponieważ wykazano, że takie połączenie pogarsza czynność nerek. Skojarzone leczenie inhibitorem ACE i ARB nie zmniejszyło śmiertelności lub zachorowalności z przyczyn sercowo-naczyniowych w porównaniu z monoterapią inhibitorem ACE.20,21
Inhibitory ACE i ARB są na ogół dobrze tolerowane. Inhibitory ACE mogą powodować suchy kaszel, który niestety często wymaga zmiany terapii. ARBs nie są związane z suchym kaszlem. Obrzęk naczynioruchowy występuje bardzo rzadko, jednak pacjenci rozpoczynający leczenie inhibitorami ACE lub ARB powinni być poinformowani o oznakach i objawach, które mogą świadczyć o obrzęku naczynioruchowym.Należy poinformować pacjentów, że obrzęk naczynioruchowy jest mało prawdopodobny, ale jeśli wystąpi obrzęk twarzy (często obejmujący powieki) i (lub) kończyn, powinni przerwać leczenie i natychmiast skontaktować się z lekarzem.18
Diuretyki tiazydowe a diuretyki pętlowe: W przypadku pacjentów bez białkomoczu nie ustalono jednoznacznie preferowanej terapii pierwszego rzutu i można rozważyć zastosowanie innych leków, takich jak tiazydy. Pacjenci z CKD i HTN często doświadczają retencji płynów lub przeciążenia płynami. W związku z tym w ich leczeniu często konieczne jest stosowanie leków moczopędnych. Tiazydy są zalecane u pacjentów z CKD w stadium 1-3 (GFR ≥30 mL/min) i uznano je za skuteczne leki zmniejszające ciśnienie tętnicze i ryzyko CVD.22 Diuretyki pętlowe zaleca się u pacjentów z CKD w stadium 4 lub 5 (GFR <30 mL/min), ponieważ wykazano ich większą skuteczność w zmniejszaniu objętości płynu pozakomórkowego u pacjentów z poważnie zmniejszonym GFR.18 Jednak długoterminowy wpływ diuretyków pętlowych na wyniki sercowo-naczyniowe nie został jednoznacznie ustalony.23
Diuretyki tiazydowe (chlortalidon, hydrochlorotiazyd) i diuretyki pętlowe (bumetanid, furosemid, torsemid) powodują hiperurykemię (zwiększone oddawanie moczu). Ta zwiększona utrata płynów może prowadzić do zaburzeń równowagi elektrolitowej. Ważne jest, aby u pacjentów przyjmujących te leki monitorować stężenie elektrolitów, aby upewnić się, że nie wystąpią u nich zaburzenia elektrolitowe, takie jak hiperkaliemia lub hipomagnezemia. Niedociśnienie ortostatyczne może wystąpić w wyniku stosowania jakichkolwiek leków przeciwnadciśnieniowych, jednak jest ono częste w przypadku leków moczopędnych. Ważne jest, aby poinformować pacjentów rozpoczynających leczenie diuretykami o konieczności powolnego wstawania z pozycji siedzącej lub leżącej.24,25
Blokery kanału wapniowego: Blokery kanału wapniowego (CCBs) są uważane za leki drugiego lub trzeciego rzutu w leczeniu HTN u pacjentów z CKD.8,9 Chociaż może nie być różnicy w wpływie na obniżenie ciśnienia tętniczego między niedihydropirydynowymi CCBs (ND-CCBs; np. diltiazem, werapamil) a dihydropirydynowymi CCBs (np, amlodypina, nifedypina), wykazano, że ND-CCBs znacząco zmniejszają białkomocz, zarówno gdy są stosowane samodzielnie, jak i w połączeniu z inhibitorem ACE lub ARB.26 Ze względu na możliwość zmniejszenia białkomoczu, oprócz działania przeciwnadciśnieniowego, ND-CCBs powinny być rozważane jako terapia drugiego lub trzeciego rzutu u pacjentów z cukrzycową CKD lub niecukrzycową CKD z białkomoczem. Dihydropirydynowe CCB mogą być stosowane jako leki drugiego rzutu u pacjentów z niecukrzycową CKD bez białkomoczu. Do częstych działań niepożądanych należą obrzęki i zaparcia w przypadku ND-CCB (zwłaszcza werapamilu) oraz zaczerwienienie i obrzęk obwodowy w przypadku leków z grupy dihydropirydyny.18
Antagoniści aldosteronu: Aldosteron odgrywa bardzo szkodliwą rolę w postępie CKD. Antagoniści receptora aldosteronowego (np. spironolakton, eplerenon) mogą znaleźć swoje miejsce w terapii CKD, gdy cele dotyczące ciśnienia tętniczego nie zostały osiągnięte za pomocą terapii pierwszego i drugiego rzutu. W badaniach klinicznych wykazano, że leki te zmniejszają białkomocz, jeśli są stosowane łącznie z inhibitorem ACE lub ARB.27,28
Antagoniści aldosteronu są lekami moczopędnymi oszczędzającymi potas, co zwiększa ryzyko hiperkaliemii, zwłaszcza jeśli są stosowane łącznie z inhibitorem ACE lub ARB. Ważne jest, aby u pacjentów rozpoczynających stosowanie leków moczopędnych oszczędzających potas kontrolować stężenie potasu, aby upewnić się, że nie występują u nich zaburzenia elektrolitowe. Objawy hiperkaliemii obejmują arytmię serca i znaczne osłabienie mięśni.Niestety, hiperkaliemia może przebiegać bezobjawowo, co jeszcze bardziej podkreśla znaczenie monitorowania.18,27
Inhibitor reniny: Aliskiren jest jedynym inhibitorem reniny dostępnym obecnie na rynku. Jest on wskazany w leczeniu HTN w monoterapii lub w terapii skojarzonej z walproinianem. Ostatnie dane z badania ALTITUDE spowodowały, że u pacjentów z cukrzycą lub zaburzeniami czynności nerek (GFR <60 mL/min) stosowanie aliskirenu z inhibitorami ACE lub ARB jest przeciwwskazane ze względu na zwiększone ryzyko wystąpienia zaburzeń czynności nerek, niedociśnienia tętniczego i hiperkaliemii.29Aliskiren można rozważyć, jeśli pacjent nie może przyjmować inhibitora ACE lub ARB, jednak nie można zalecać jego stosowania u pacjentów z niewydolnością nerek w stadium 4 lub 5.30
Beta-blokery: Dane oceniające wpływ beta-adrenolityków na postęp CKD i białkomocz są ograniczone.27 Chociaż beta-adrenolityki nie zostały uwzględnione w TABELI 2, można je rozważyć jako terapię drugiego lub trzeciego rzutu, jeśli u pacjenta występują istotne wskazania do stosowania beta-adrenolityków, takie jak choroba wieńcowa lub przewlekła niewydolność serca.18
Zalecenia niefarmakologiczne
Chronoterapia: Ten rodzaj terapii uwzględnia rytm okołodobowy BP i wprowadza podawanie leków przeciwnadciśnieniowych zgodnie z rytmem dobowym, odchodząc od podawania wszystkich leków przeciwnadciśnieniowych w godzinach porannych. Badania wykazały poprawę 24-godzinnej kontroli BP u pacjentów, którym CCB podawano wieczorem, a nie rano.31,32 Dodatkowe badania wykazały korzyści z nocnego podawania innych leków przeciwnadciśnieniowych, takich jak inhibitory ACE lub ARB.33,34 Chronoterapia może być brana pod uwagę u osób, u których nie udaje się osiągnąć docelowego ciśnienia tętniczego przy podawaniu wszystkich leków przeciwnadciśnieniowych rano. Jeśli pacjent przyjmuje więcej niż dwa leki przeciwnadciśnieniowe, właściwe może być podawanie dwóch leków rano, a dodatkowych wieczorem.
Modyfikacja stylu życia: Zwiększenie aktywności fizycznej, zmniejszenie masy ciała i modyfikacje diety są zalecane u wszystkich pacjentów z HTN.8Modyfikacja stylu życia pozostaje kluczowym elementem terapii HTN, niezależnie od tego, czy pacjenci wymagają stosowania leków w celu osiągnięcia docelowego ciśnienia tętniczego. Dieta Dietary Approaches to Stop Hypertension (DASH) kładzie nacisk na zwiększone spożycie owoców i warzyw, włączenie niskotłuszczowego nabiału i chudego białka oraz ograniczenie tłuszczów nasyconych; wykazano, że ten plan żywieniowy znacząco obniża skurczowe ciśnienie tętnicze, niemal równoważnie z redukcją osiąganą przez monoterapię przeciwnadciśnieniową.35 Ponadto, zmniejszenie spożycia sodu i alkoholu zostało uznane za skuteczną interwencję w kierunku obniżenia ciśnienia tętniczego.8Rozpoczęcie tych zdrowych praktyk żywieniowych przy jednoczesnym zwiększeniu codziennej aktywności zwiększa korzyści z terapii przeciwnadciśnieniowej i może odgrywać istotną rolę w osiąganiu celów związanych z BP.
Podsumowanie
Współzależność CKD i HTN prowadzi do dalszego podkreślenia znaczenia kontroli BP i zmniejszenia białkomoczu, jeśli występuje. Leki zmniejszające białkomocz oprócz BP są zwykle lekami pierwszego wyboru, ale pacjenci często wymagają trzech do czterech leków przeciwnadciśnieniowych, aby osiągnąć swoje cele i zminimalizować ryzyko CVD i ESRD. Ponadto modyfikacje zdrowego stylu życia powinny być zawsze traktowane jako istotny element każdego schematu terapii przeciwnadciśnieniowej.
1. Coresh J, Selvin E, Stevens LA, et al. Prevalence of chronic kidney disease in the United States. JAMA. 2007;298:2038-2047.
2. Collins AJ, Foley RN, Chavers B, et al. U.S. renal data system 2011 annual data report. Am J Kidney Dis. 2012;59(suppl 1):evii.
3. Matsushita K, van der Velde M, Astor BC, et al.Association of estimated glomerular filtration rate and albuminuria withall-cause and cardiovascular mortality in general population cohorts: acollaborative meta-analysis. Lancet. 2010;375:2073-2081.
4. Rashidi A, Sehgal AR, Rahman M, O’Connor AS. The casefor chronic kidney disease, diabetes mellitus, and myocardial infarction being equivalent risk factors for cardiovascular mortality inpatientsolder than 65 years. Am J Cardiol. 2008;102:1668-1673.
5. Rao MV, Qiu Y, Wang C, Bakris G. Hypertension and CKD:Kidney Early Evaluation Program (KEEP) and National Health and NutritionExamination Survey (NHANES), 1999-2004. Am J Kidney Dis. 2008;51(suppl 2):S30-S37.
6. Botdorf J, Chaudhary K, Whaley-Connell A. Hypertension in cardiovascular and kidney disease. Cardiorenal Med. 2011;1:183-192.
7. Segura J, Ruilope L. Hypertension in moderate-to-severe nondiabetic CKD patients. Adv Chronic Kidney Dis. 2011;18:23-27.
8. Chobanian AV, Bakris GL, Black HR, et al. The seventhreport of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA. 2003;289:2560-2572.
9. National Kidney Foundation. K/DOQI clinical practiceguidelines for chronic kidney disease: evaluation, classification, andstratification. Am J Kidney Dis. 2002;39(suppl 1):S1-S266.
10. American Diabetes Association. Standards of medical care in diabetes-2012. Diabetes Care. 2012;35(suppl 1):S1-S63.
11. Bakris GL, Williams M, Dworkin L, et al. Preservingrenal function in adults with hypertension and diabetes: a consensusapproach. National Kidney Foundation Hypertension and Diabetes ExecutiveCommittees Working Group. Am J Kidney Dis. 2000;36:646-661.
12. Keane WF, Eknoyan G. Proteinuria, albuminuria, risk,assessment, detection, elimination (PARADE): a position paper for theNational Kidney Foundation. Am J Kidney Dis. 1999;33:1004-1010.
13. Yoshioka T, Rennke HG, Salant DJ, et al. Role ofabnormally high transmural pressure in the permselectivity defect ofglomerular capillary wall: a study in early passive Heymann nephritis. Circ Res. 1987:61:531-538.
14. Sarnak M, Levey A, Schoolwerth A, et al. Kidneydisease as a risk factor for the development of cardiovascular disease: astatement from the American Heart Association Councils on Kidney inCardiovascular Disease, High Blood Pressure Research, ClinicalCardiology, and Epidemiology and Prevention. Circulation. 2003;108:2154-2169.
15. Upadhyay A, Earley A, Haynes SM, Uhlig K. Systematicreview: blood pressure target in chronic kidney disease and proteinuriaas an effect modifier. Ann Intern Med. 2011;154:541-548.
16. Cushman C, Evan GW Byington RP, et al. The ACCORDstudy group. Intensive blood-pressure control in type 2 diabetesmellitus. N Engl J Med. 2010;363:1575-1585.
17. Brenner BM, Cooper ME, De Zeeuw D, et al. Effects oflosartan on renal and cardiovascular outcomes in type 2 diabetes andnephropathy. N Engl J Med. 2001;345:861-869.
18. Kidney Disease Outcomes Quality Initiative (K/DOQI).K/DOQI clinical practice guidelines on hypertension and antihypertensiveagents in chronic kidney disease. Am J Kidney Dis. 2004;43(suppl 1):S1-S290.
19. Remuzzi G, Chiurchiu C, Ruggenenti P. Proteinuria predicting outcome in renal disease: nondiabetic nephropathies (REIN). Kidney Int Suppl. 2004;66:S90-S96.
20. Sharma P, Blackburn RC, Parke CL, et al.Angiotensin-converting enzyme inhibitors and angiotensin receptorblockers for adults with early (stage 1 to 3) non-diabetic chronickidney disease. Cochrane Database Syst Rev. 2011;(10):CD007751.
21. van Vark LC, Bertrand M, Akkerhuis KM, et al.Angiotensin-converting enzyme inhibitors reduce mortality inhypertension: a meta-analysis of randomized clinical trials ofrenin-angiotensin-aldosterone system inhibitors involving 158,998patients. Eur Heart J. 2012 Apr 17; Epub ahead of print.
22. Major outcomes in high-risk hypertensive patientsrandomized to angiotensin-converting enzyme inhibitor or calcium channelblocker vs. diuretic: the Antihypertensive and Lipid-Lowering Treatmentto Prevent Heart Attack Trial (ALLHAT). JAMA. 2002;288:2981-2997.
23. Musini VM, Wright JM, Bassett K, Jauca CD. Blood pressure lowering efficacy of loop diuretics for primary hypertension. Cochrane Database Syst Rev. 2009;(4):CD003825.
24. Microzide (hydrochlorothiazide oral capsules) ulotka dołączona do opakowania. Watson Pharma, Inc: Morristown, NJ; 2011.
25. Ulotka dołączona do opakowania tabletek doustnych Chlorthalidone. Mylan Pharmaceuticals, Inc: Morgantown, WV; 2006.
26. Bakris GL, Weir MR, Secic M, et al. Differentialeffects of calcium antagonist subclasses on markers of nephropathyprogression. Kidney Int. 2004;65:1991-2002.
27. Navaneethan SD, Nigwekar SU, Sehgal AR, et al.Aldosterone antagonists for preventing the progression of chronic kidneydisease. Clin J Am Soc Nephrol. 2009;4:542-551.
28. Mehdi UF, Adams-Huet B, Raskin P, et al. Addition ofangiotensin receptor blockade or mineralocorticoid antagonism to maximalangiotensin-converting enzyme inhibition in diabetic nephropathy. J Am Soc Nephrol. 2009;20:2641-2650.
29. Leki zawierające aliskiren: komunikat o bezpieczeństwie leku – nowe ostrzeżenie i przeciwwskazania. MedWatch.April 20, 2012.www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm301120.htm?source=govdelivery;4/20/2012.Accessed May 1, 2012.
30. Trimarchi H. Role of aliskiren in blood pressure control and renoprotection. Int J Nephrol Renovasc Dis. 2011;4:41-48.
31. Portaluppi F, Vergnani L, Manfredini R, et al.Time-dependent effect of isradipine on the nocturnal hypertension inchronic renal failure. Am J Hypertens. 1995;8:719-726.
32. Hermida RC, Calvo C, Ayala DE, et al. Dose andadministration-time dependent effects of nifedipine GITS on ambulatoryblood pressure in hypertensive subjects. Chronobiol Int. 2007;24:471-493.
33. Hermida RC, Ayala DE. Chronotherapy with theangiotensin-converting enzyme inhibitor ramipril in essentialhypertension: improved blood pressure control with bedtime dosing. Hypertension. 2009;54:40-46.
34. Hermida RC, Calvo C, Ayala DE, et al. Administrationtime-dependent effects of valsartan on ambulatory blood pressure inhypertensive subjects. Hypertension. 2003;42:283-290.
35. Sacks FM, Svetkey LP, Vollmer WM, et al. Effects onblood pressure of reduced dietary sodium and the Dietary Approaches toStop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group.N Engl J Med. 2001;344:3-10.