Sublimacja jest procesem, w którym materiał zmienia się z zamrożonego ciała stałego w gaz bez przechodzenia przez pośredni stan ciekły.
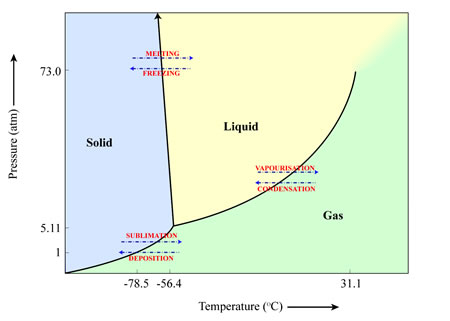
Czy materiał sublimuje (ciało stałe w gaz), topi się (ciało stałe w ciecz) lub paruje (ciecz w gaz) zależy od temperatury i ciśnienia środowiska, w którym się znajduje. Można to zilustrować na “diagramie fazowym”, takim jak ten poniżej dla wody. W tym przypadku, przy ciśnieniu (1 atmosfera) i temperaturze (25 stopni Celsjusza), do jakich jesteśmy przyzwyczajeni na Ziemi, lód wodny będzie się topił, tworząc wodę w stanie ciekłym, która następnie będzie parować, tworząc parę wodną. Jednakże, jeśli ciśnienia są wystarczająco niskie (na przykład ciśnienia, które znajdujemy gdzie indziej w Układzie Słonecznym), lód wodny zamieni się bezpośrednio w parę wodną wraz ze wzrostem temperatury, omijając etap wody w stanie ciekłym.
Sublimacja występuje w wielu miejscach w Układzie Słonecznym. Dwa przykłady to:
- Sublimacja wody z jąder kometarnych w miarę zbliżania się komety do Słońca’
- Sublimacja polarnych czap lodowych na Marsie w czasie marsjańskiego lata.
Przykładem materiału, który sublimuje tu na Ziemi, jest zamrożony dwutlenek węgla (CO2) – bardziej znany jako “suchy lód”. Po wystawieniu na działanie powietrza o temperaturze pokojowej przy ciśnieniu 1 atmosfery, zamrożony CO2 zamienia się bezpośrednio w gazowy CO2.
.