To jest krótki przegląd informacji związanych z zatwierdzeniem tego produktu przez FDA do obrotu. Pełniejsze informacje na temat tego produktu, wskazań do jego stosowania oraz podstawy zatwierdzenia przez FDA można znaleźć w poniższych linkach do streszczenia danych dotyczących bezpieczeństwa i skuteczności (SSED) oraz etykiety produktu.
Nazwa produktu: Axonics Sacral Neuromodulation System
PMA Wnioskodawca: Axonics Modulation Technologies, Inc.
Adres: 26 Technology Drive, Irvine, CA 92618
Data zatwierdzenia: 13 listopada 2019 r.
List zatwierdzający: Approval Order
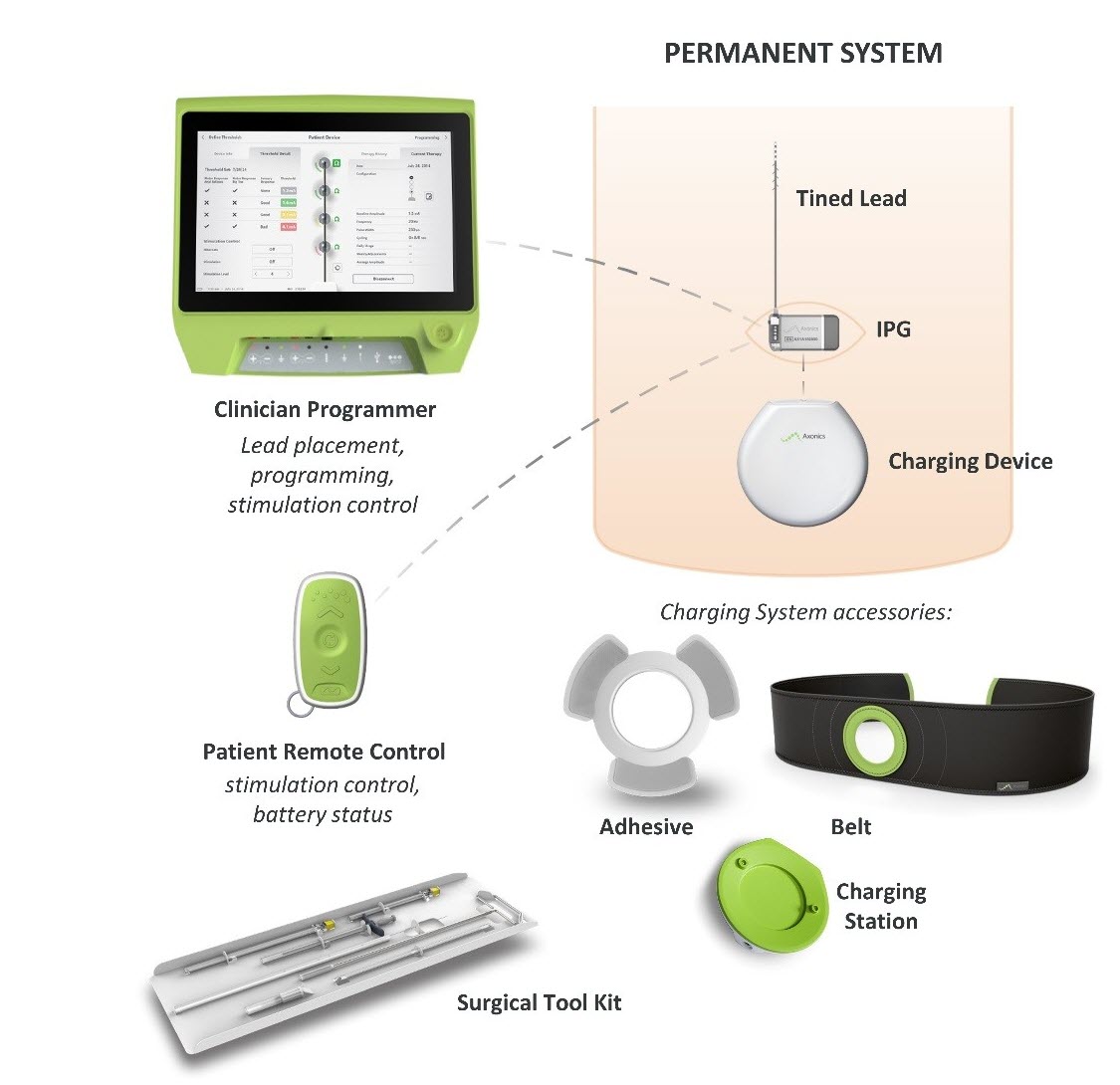
Co to jest? System neuromodulacji krzyżowej (SNM) firmy Axonics jest systemem stymulacji nerwu krzyżowego (SNS) przeznaczonym do leczenia zatrzymania moczu i objawów pęcherza nadreaktywnego. Wykorzystuje on wszczepiony stymulator do dostarczania impulsów elektrycznych poprzez przewód prowadzący do elektrod umieszczonych w pobliżu nerwu krzyżowego.
Jak to działa? Wszczepialny generator impulsów (IPG) jest umieszczany chirurgicznie pod skórą w górnej części pośladka i podłączany do przewodu prowadzącego, który przechodzi pomiędzy kośćmi biodrowymi miednicy i kończy się na nerwie krzyżowym. IPG wysyła impulsy elektryczne przez przewód prowadzący do nerwu krzyżowego, który przemieszcza się z rdzenia kręgowego do pęcherza moczowego, aby pomóc poprawić kontrolę moczu.
Kiedy jest stosowany? System SNM Axonics do kontroli moczu jest stosowany w leczeniu zatrzymania moczu i objawów pęcherza nadreaktywnego u pacjentów, którym nie udało się lub nie mogli tolerować innych metod leczenia, takich jak zmiana stylu życia, ćwiczenia dna miednicy lub leki. Nieleczone zatrzymanie moczu i pęcherz nadreaktywny mogą obniżyć jakość życia pacjenta i mogą powodować znaczne trudności w wykonywaniu codziennych czynności życiowych.
Co można osiągnąć? Wyniki badania klinicznego Systemu SNM firmy Axonics w połączeniu z dodatkowymi danymi klinicznymi zebranymi z systematycznego przeglądu literatury dostępnej dla podobnego urządzenia SNM pokazują, że istnieje korzyść dla większości pacjentów z zatrzymaniem moczu i objawami pęcherza nadreaktywnego, u których inne metody leczenia zawiodły lub nie były tolerowane. W badaniu klinicznym Axonics z udziałem pacjentów z nietrzymaniem moczu, u 90% (116/129) pacjentów z wszczepionym Systemem SNM uzyskano co najmniej 50% zmniejszenie liczby parć naglących w ciągu 6 miesięcy w porównaniu z liczbą parć naglących bez Systemu SNM. W długoterminowym badaniu (van Kerrebroeck, 2007) 152 pacjentów, którym wszczepiono podobne urządzenie SNM, było obserwowanych przez 5 lat. Po 5 latach u 58% (56/96) pacjentów z nietrzymaniem moczu nastąpiła co najmniej 50% poprawa (mierzona liczbą przecieków w ciągu dnia). Dodatkowo po 5 latach u 40% (10/25) pacjentów z częstym parciem naglącym nastąpiła co najmniej 50% poprawa (mierzona liczbą wypróżnień w ciągu dnia), a u 58% (18/31) pacjentów z zatrzymaniem moczu nastąpiła co najmniej 50% poprawa (mierzona liczbą cewnikowań w ciągu dnia). Biorąc pod uwagę podobieństwa w konstrukcji, technologii, działaniu, wskazaniach do stosowania, charakterystyce wyjściowej i populacji pacjentów, których ma leczyć, FDA uważa, że system Axonics SNM System będzie miał podobne działanie do dostępnego na rynku systemu SNM ocenianego w opublikowanych badaniach.
Kiedy nie należy go stosować? Systemu Axonics SNM nie należy stosować u:
- Pacjentów, którzy nie wykazali odpowiedniej odpowiedzi na stymulację testową; lub
- Pacjentów, którzy nie są w stanie obsługiwać systemu Axonics SNM System
Informacje dodatkowe (w tym ostrzeżenia, środki ostrożności i zdarzenia niepożądane):
- Podsumowanie danych dotyczących bezpieczeństwa i skuteczności
- Patient Labeling
- Physician Labeling
- PMA Database Entry
.