
Precipitação de carbonato de cálcio (cal) é um problema comum de entupimento em sistemas de microirrigação. Água com um pH de 7,5 ou superior e um nível de bicarbonato de pelo menos 2 meq/l (120 ppm) é susceptível à precipitação de carbonato de cálcio se níveis comparáveis de cálcio estiverem presentes naturalmente no sistema ou se um composto que contenha cálcio for injectado no sistema.
Causas de Precipitação de Carbonato de Cálcio
O grau em que o carbonato de cálcio ocorre na água à pressão atmosférica depende do pH e da temperatura da água. A valores de pH inferiores a cerca de 6, a maioria do dióxido de carbono dissolvido e uma pequena quantidade de ácido carbónico existe na água. A valores de pH entre cerca de 6,5 e 10, o bicarbonato é dominante. A valores de pH superiores a cerca de 10,5, o íon carbonato domina. As causas da precipitação incluem o seguinte.
- Para águas subterrâneas, o bombeamento reduz a pressão da água à medida que esta flui para o poço. Esta redução libera gás de dióxido de carbono dissolvido, fazendo com que o pH das águas subterrâneas aumente, e que por sua vez pode causar precipitação de carbonato de cálcio.
- A evaporação aumenta a concentração de produtos químicos que se dissolvem na água que permanece no emissor. Devido à sua baixa solubilidade na água, o carbonato de cálcio precipita-se facilmente durante a evaporação.
- O grau de solubilidade do carbonato de cálcio cai à medida que a temperatura da água sobe. A temperatura da água em sistemas de micro irrigação de superfície pode aumentar à medida que a água flui pelas laterais.
- A injeção de certos produtos químicos como amônia aquática e lixívia ou a injeção de fertilizantes contendo cálcio ou materiais como o gesso pode causar precipitação.
Prevenção e Correcção de Problemas de Entupimento
A diminuição do pH da água dissolve quaisquer precipitados de carbonato de cálcio existentes e previne a formação de sais de carbonato adicionais. O tratamento habitual para a precipitação de carbonato de cálcio é injectar ácido para acidificar a água, baixando o pH para 7 ou menos. Os ácidos comuns utilizados para este fim incluem ácido sulfúrico, ácido muriático e ácido clorídrico. Outros ácidos como ácido cítrico e ácido nítrico podem ser usados, mas são mais caros.
Um composto ácido-fertilizante como o ácido uréico-sulfúrico é mais seguro de usar do que um ácido reto. Entretanto, a injeção contínua de produtos ácidos contendo nitrogênio pode causar problemas no decorrer de uma estação para culturas sensíveis a aplicações excessivas de nitrogênio, como maçãs e uvas para vinho.
Os pesquisadores avaliaram outros compostos como fosfonatos e materiais ácidos fosfônicos e descobriram que eles são eficazes na prevenção da precipitação de carbonato de cálcio.
Os tratamentos recomendados para prevenir o entupimento são os seguintes.
- Injete ácido continuamente para manter o pH da água entre 5 e 7,
- Injete ácido intermitentemente para manter o pH da água abaixo de 4 por pelo menos 30 a 60 minutos. A frequência de injeção depende da taxa a que ocorre a precipitação de carbonato. Ao utilizar emissores compensadores de pressão, verifique com o fabricante antes de baixar o pH para 4 ou menos. O latão e quaisquer outros acessórios metálicos não inócuos podem ficar sem caroço.
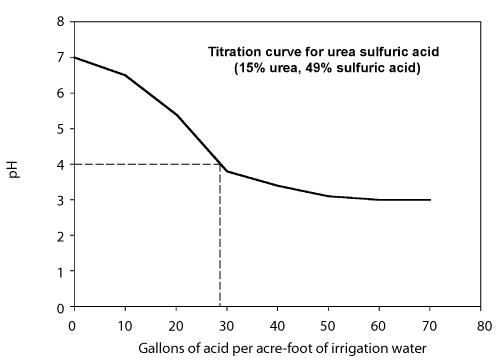
A quantidade de ácido necessária para baixar o pH para o nível desejado depende da alcalinidade da água e do pH alvo. Duas abordagens podem ser usadas para determinar a quantidade de ácido necessária. - Desenvolver uma curva de titulação que mostra a quantidade de ácido necessária para baixar o pH da água até um valor desejado para uma determinada água de irrigação. Isto é normalmente feito por um laboratório e requer que você forneça amostras da água e do ácido. O comportamento da titulação depende da alcalinidade da água de irrigação, portanto a curva de titulação pode variar de uma fonte de água para outra. A Figura 8 mostra uma curva de titulação usando uma solução de ácido uréico-sulfúrico contendo 49% de ácido sulfúrico.
- Utilize uma abordagem de tentativa e erro adicionando ácido à água em incrementos e medindo o pH, repetindo até atingir o nível de pH desejado. Papel de tornassol, kits de teste colormétricos para aquários e piscinas e medidores portáteis de pH podem ser usados para determinar o pH da água. Inúmeras fontes vendem medidores de pH de bolso; eles requerem calibração periódica usando soluções padrão que também podem ser adquiridas.
Figure 8. Curva de titulação para ácido sulfúrico uréico com 49% de ácido sulfúrico.
Calcular a taxa de injeção
Após determinar quanta ácido você precisa, você pode calcular a taxa de injeção de ácido usando a seguinte equação:
IR = (A × Q × 60) ÷ 326.000
where
IR = a taxa de injeção em galões por hora (gph)
A = os galões de ácido por acre-pé de água necessários para baixar o pH
Q = a taxa de fluxo do sistema de irrigação em galões por minuto (gpm)
Os acre-pés de água podem ser determinados pela fórmula Q × T × 60 ÷ 326,000, onde T é o tempo de rega em horas.
Monitorar o pH da água durante o processo de injeção para garantir que não fique muito abaixo de 4. Todas as águas são “tamponadas” de forma diferente pelos sais que contêm; uma água pode necessitar de 10 gph enquanto outra necessitará apenas de 2 gph.
Exemplo
Calcular a taxa de injecção necessária para baixar o pH para 4 utilizando um ácido ureo-sulfúrico (49%). A figura acima é a curva de titulação. A taxa de fluxo do sistema é de 1.000 galões por minuto.
Passo 1. Da curva de titulação, note que são necessários 26 galões de ácido uréico-sulfúrico por acre-pé de água para baixar o pH para 4,
Passo 2.
IR = (26 × 1.000 × 60) ÷ 326.000 = 4,8 gph
Medidas de Segurança
- Não misturar directamente o ácido e o cloro. Isto irá causar a formação de gás cloro venenoso.
- Não adicionar água ao ácido. Ao invés disso, adicione sempre ácido à água.