What is Curium
Curium (pronunciado como KYOOR-ee-em) é um metal radioativo pertencente à família dos metais actinídeos e denotado pelo símbolo químico Cm .

Símbolo de Cúrio
Isótopos de Cúrio
Tem 15 isótopos dos quais o mais estável é Curium-247 com uma meia-vida de cerca de 15.600.000 anos que sofre um decaimento alfa para formar plutónio-243 .
História
Origem do seu Nome: Tem o nome dos bem conhecidos cientistas, Pierre Curie e Marie Curie, os descobridores do rádio.
Quem o descobriu: O elemento foi sintetizado pela equipa de pesquisa de Glenn Seaborg, Albert Ghiorso e Ralph James… 35>>

Curium
>
Onde foi Curium Descoberto
Em 1944, Seaborg, Ghiorso e James bombardearam plutónio-239 com partículas alfa num ciclotrão em Berkeley, Califórnia. Foi então enviado para o Laboratório Metalúrgico da Universidade de Chicago para isolar e analisar o novo elemento. Em 11 de novembro de 1945, após o fim da Segunda Guerra Mundial, a descoberta foi revelada por Seaborg em um programa de rádio onde ele havia sido convidado como cientista convidado. Foi oficializado na semana seguinte.
Classificação e Posição do Elemento na Tabela Periódica
| Número de Grupo | Desconhecido |
| Período | 7 |
| Bloqueio | f |
Localização de Curium na Tabela Periódica
Propriedades de Curium
Propriedades Gerais |
|||
| Massa atómica relativa | 247 | ||
| Massa atómica | 247 unidades de massa atómica | ||
Propriedades físicas |
|||
| Cor/aparência | Branco prateado | ||
| Brilho | Desconhecido | ||
| Odor | Desconhecido | ||
| Ponto de fusão/ponto de congelação | 1345 °C (2453°F) | ||
| Ponto de congelação | Desconhecido | ||
| Densidade | 13.51 g/cm3 | ||
| Estado da matéria à temperatura ambiente (sólido/líquido/gás) | Sólido | ||
| Dureza | Desconhecido | ||
| Condutividade eléctrica | Desconhecido | ||
| Condutividade térmica (calor) | Desconhecido | ||
| Calor específico | Desconhecido | ||
Propriedades Químicas |
|||
| Flammabilidade | Desconhecido | ||
| Estados de oxidação | 4 | 3 | |
Dados atómicos de Curium
| Número atómico | 96 | ||||||
| Valence electrons | 2 | ||||||
| Números quânticos | |||||||
| – n | >5 | ||||||
| – ℓ | 3 | ||||||
| – m ℓ | -3 | ||||||
| – m s | -1/2 | ||||||
| Configuração electrónica (configuração de gás nobre) | 5f76d17s2 | ||||||
| Estrutura atómica | |||||||
| – Número de electrões | 99 | ||||||
| – Número de neutrões | 151 | ||||||
| – Número de prótons | 99 | ||||||
| Rádio de Átomo | |||||||
| – Raio atómico | 2.45 Å | ||||||
| – Raio covalente | 1.68 Å | ||||||
| Electronegatividade | Desconhecido | ||||||
| Energia de ionização
(kJmol-1) |
1ª | 2ª | 3ª | 4ª | 5ª | 6ª | 7ª |
| 578.082 | – | – | – | – | – | – | |
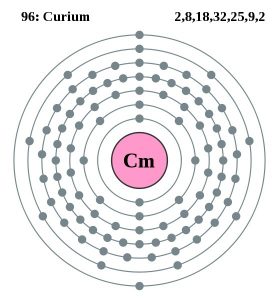
Curium Bohr Modelo
Para que serve Curium
Como não é encontrado naturalmente na crosta terrestre, o elemento radioativo só tem sido usado em estudos de pesquisa básica devido à sua limitada produção laboratorial. Além disso, ele não reage com outros compostos. No entanto, o curium-244 pode ser aplicável como fonte de energia para operar geradores radioelétricos termoelétricos de radioisótopos utilizados em espaçonaves.
Interesting Facts About Curium
- Curium-244 tem sido usado no Espectrómetro de Protões Alfa X para detectar a presença de elementos químicos na atmosfera e compostos de superfície rochosa de Marte
- Acredita-se que o elemento brilha de vermelho no escuro devido à sua natureza radioactiva
Quanto custa Curium
O elemento radioactivo não está comercialmente disponível fora da produção laboratorial.