
Precipitarea carbonatului de calciu (var) este o problemă comună de colmatare în sistemele de microirigare. Apa cu un pH de 7,5 sau mai mare și un nivel de bicarbonat de cel puțin 2 meq/l (120 ppm) este susceptibilă la precipitarea carbonatului de calciu dacă niveluri comparabile de calciu sunt prezente în mod natural în sistem sau dacă un compus care conține calciu este injectat în sistem.
Cauzele precipitării carbonatului de calciu
Gradul în care carbonatul de calciu apare în apă la presiune atmosferică depinde de pH-ul și temperatura apei. La valori ale pH-ului mai mici de aproximativ 6, în apă există în principal dioxid de carbon dizolvat și o cantitate mică de acid carbonic. La valori ale pH-ului cuprinse între aproximativ 6,5 și 10, bicarbonatul este dominant. La valori ale pH-ului mai mari de aproximativ 10,5, predomină ionul carbonat. Cauzele precipitațiilor includ următoarele.
- Pentru apele subterane, pomparea reduce presiunea apei în timp ce aceasta curge în puț. Această reducere eliberează gazul dioxid de carbon dizolvat, determinând creșterea pH-ului apei subterane, care, la rândul său, poate provoca precipitarea carbonatului de calciu.
- Evaporarea crește concentrația de substanțe chimice care sunt dizolvate în apa care rămâne în emițător. Din cauza solubilității sale scăzute în apă, carbonatul de calciu precipită cu ușurință în timpul evaporării.
- Gradul de solubilitate al carbonatului de calciu scade odată cu creșterea temperaturii apei. Temperatura apei din sistemele de microirigare de suprafață poate crește pe măsură ce apa curge pe laterale.
- Injectarea anumitor substanțe chimice, cum ar fi aqua amoniacul și înălbitorul, sau injectarea de îngrășăminte sau materiale care conțin calciu, cum ar fi ghipsul, poate provoca precipitații.
Prevenirea și corectarea problemelor de colmatare
Diminuarea pH-ului apei dizolvă orice precipitații existente de carbonat de calciu și previne formarea de săruri de carbonat suplimentare. Tratamentul obișnuit pentru precipitarea carbonatului de calciu constă în injectarea de acid pentru a acidifica apa, scăzând pH-ul la 7 sau mai puțin. Printre acizii utilizați în mod obișnuit în acest scop se numără acidul sulfuric, acidul muriatic și acidul clorhidric. Pot fi utilizați și alți acizi, cum ar fi acidul citric și acidul azotic, dar sunt mai scumpi.
Un compus acid-fertilizant, cum ar fi acidul ureea-sulfuric, este mai sigur de utilizat decât un acid simplu. Cu toate acestea, injectarea continuă a produselor acide care conțin azot poate cauza probleme pe parcursul unui sezon pentru culturile care sunt sensibile la aplicațiile excesive de azot, cum ar fi merele și strugurii de vin.
Cercetătorii au evaluat și alți compuși, cum ar fi un fosfonat și materiale de acid fosfonic și au constatat că acestea sunt eficiente în prevenirea precipitării carbonatului de calciu.
Tratamentele recomandate pentru prevenirea colmatării sunt următoarele.
- Injectați acidul în mod continuu pentru a menține pH-ul apei între 5 și 7.
- Injectați acidul intermitent pentru a menține pH-ul apei sub 4 timp de cel puțin 30 până la 60 de minute. Frecvența de injectare depinde de viteza cu care are loc precipitarea carbonatului. Atunci când folosiți emițătoare cu compensare de presiune, verificați cu producătorul înainte de a reduce pH-ul la 4 sau mai puțin. Alama și orice alte fitinguri metalice care nu sunt inoxidabile se pot înțepa.
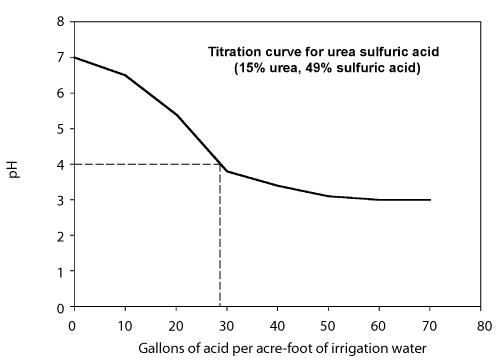
Cantitatea de acid necesară pentru a reduce pH-ul la nivelul dorit depinde de alcalinitatea apei și de pH-ul țintă. Se pot folosi două abordări pentru a determina cantitatea de acid necesară. - Elaborarea unei curbe de titrare care arată cantitatea de acid necesară pentru a scădea pH-ul apei la o valoare dorită pentru o anumită apă de irigare. Acest lucru se face de obicei de către un laborator și necesită să furnizați probe de apă și de acid. Comportamentul titrării depinde de alcalinitatea apei de irigare, astfel încât curba de titrare poate varia de la o sursă de apă la alta. Figura 8 prezintă o curbă de titrare folosind o soluție de uree-acid sulfuric care conține 49% acid sulfuric.
- Utilizați o abordare de tip încercare-eroare adăugând acid în apă în trepte și măsurând pH-ul, repetând până când ajungeți la nivelul de pH dorit. Hârtia de turnesol, kiturile de testare colorimetrică pentru acvarii și piscine și pH-metrele portabile pot fi folosite pentru a determina pH-ul apei. Numeroase surse vând pH-metre de buzunar; acestea necesită o calibrare periodică folosind soluții standard care pot fi, de asemenea, achiziționate.
Figura 8. Curba de titrare pentru acid sulfuric uree cu acid sulfuric 49%.
Calcularea debitului de injecție
După ce ați determinat cantitatea de acid de care aveți nevoie, puteți calcula debitul de injecție a acidului folosind următoarea ecuație:
IR = (A × Q × 60) ÷ 326,000
unde
IR = rata de injecție în galoane pe oră (gph)
A = galoanele de acid pe acru-pământ de apă necesare pentru a scădea pH-ul
Q = debitul sistemului de irigare în galoane pe minut (gpm)
Acrul-pământ de apă poate fi determinat prin formula Q × T × 60 ÷ 326,000, unde T este timpul de reglare a irigării în ore.
Supravegheați pH-ul apei în timpul procesului de injecție pentru a vă asigura că acesta nu coboară mult sub 4. Toate apele sunt “tamponate” în mod diferit de sărurile pe care le conțin; o apă poate necesita 10 gph, în timp ce alta va necesita doar 2 gph.
Exemplu
Calculează debitul de injecție necesar pentru a reduce pH-ul la 4 folosind un acid uree-sulfuric (49%). Figura de mai sus reprezintă curba de titrare. Debitul sistemului este de 1.000 de galoane pe minut.
Etapa 1. Din curba de titrare, observați că sunt necesari 26 de galoane de acid uree-sulfuric pe acru-pământ de apă pentru a scădea pH-ul la 4.
Etapa 2.
IR = (26 × 1.000 × 60) ÷ 326.000 = 4,8 gph
Măsuri de siguranță
- Nu amestecați direct acidul și clorul. Acest lucru va cauza formarea de gaz clor otrăvitor.
- Nu adăugați apă în acid. În schimb, adăugați întotdeauna acid la apă.
.