- Qu’est-ce que le curium
- Isotopes du curium
- Histoire
- Classification et position de l’élément sur le tableau périodique
- Propriétés du curium
- Propriétés générales
- Propriétés physiques
- Propriétés chimiques
- Données atomiques du curium
- À quoi sert le curium
- Faits intéressants sur le curium
- Combien coûte le curium
Qu’est-ce que le curium
Le curium (prononcé comme KYOOR-ee-em) est un métal radioactif appartenant à la famille des métaux actinides et désigné par le symbole chimique Cm .

Symbole du curium
Isotopes du curium
Il possède 15 isotopes dont le plus stable est le curium-247 avec une demi-vie d’environ 15 600 000 ans qui subit une désintégration alpha pour former le plutonium-243 .
Histoire
Origine de son nom : Il porte le nom des scientifiques bien connus, Pierre Curie et Marie Curie, les découvreurs du radium.
Qui l’a découvert : L’élément a été synthétisé par l’équipe de recherche de Glenn Seaborg, Albert Ghiorso et Ralph James .

Curium
Où a été découvert le curium
En 1944, Seaborg, Ghiorso et James ont bombardé du plutonium-239 avec des particules alpha dans un cyclotron à Berkeley, en Californie. Le plutonium est ensuite envoyé au Metallurgical Laboratory de l’Université de Chicago pour isoler et analyser le nouvel élément. Le 11 novembre 1945, après la fin de la Seconde Guerre mondiale, la découverte a été révélée par Seaborg lors d’une émission de radio où il avait été invité en tant que scientifique. Elle fut rendue officielle la semaine suivante .
Classification et position de l’élément sur le tableau périodique
| Numéro de groupe | Inconnu |
| Période | 7 |
| Bloc | f |
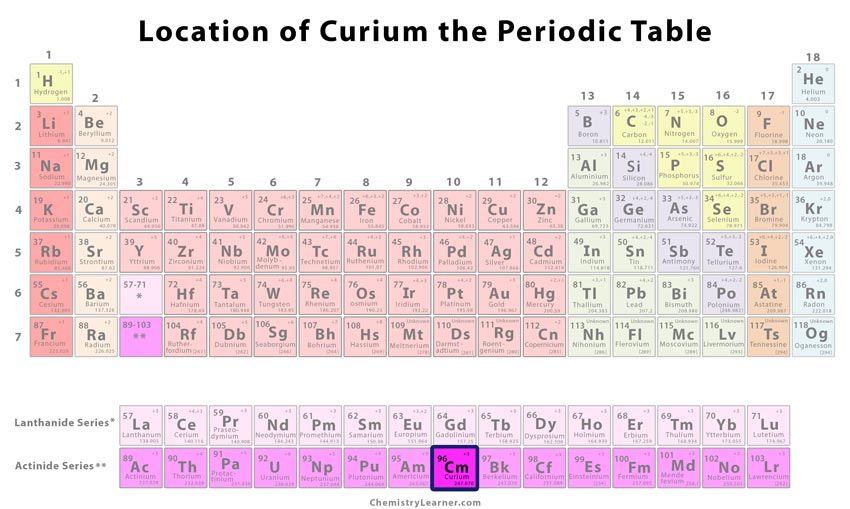
Localisation du curium dans le tableau périodique
Propriétés du curium
Propriétés générales |
|||
| Masse atomique relative | 247 | ||
| Masse atomique | 247 unités de masse atomique | ||
Propriétés physiques |
|||
| Couleur/apparence | Blanc argenté | ||
| Eclat | Inconnu | ||
| Odeur | Inconnue | ||
| Point de fusion/point de congélation | 1345 °C (2453°F) | ||
| Point d’ébullition | Inconnue | ||
| Densité | 13.51 g/cm3 | ||
| État de la matière à température ambiante (solide/liquide/gaz) | Solide | ||
| Dureté | Inconnue | ||
| Conductivité électrique | Inconnue | ||
| Conductivité thermique (chaleur) | Inconnu | ||
| Chaleur spécifique | Inconnu | ||
Propriétés chimiques |
|||
| Inflammabilité | Inconnu | ||
| États d’oxydation | 4 | 3 | |
Données atomiques du curium
| Numéro atomique | 96 | ||||||
| Électrons de valence | 2 | ||||||
| Nombre quantique | |||||||
| – n | 5 | ||||||
| – ℓ | 3 | ||||||
| – m ℓ | -3 | ||||||
| – m s | -1/2 | ||||||
| Configuration des électrons (configuration des gaz rares) | 5f76d17s2 | ||||||
| Structure atomique | |||||||
| – Nombre d’électrons | 99 | ||||||
| – Nombre de neutrons | 151 | ||||||
| – Nombre de protons | 99 | ||||||
| Radius de l’atome | |||||||
| – Rayon atomique | 2.45 Å | ||||||
| – Rayon covalent | 1.68 Å | ||||||
| Electronégativité | Inconnue | ||||||
| Énergie d’ionisation
(kJmol-1) |
1ère | 2ème | 3ème | 4ème | 5ème | 6ème | 7ème |
| 578.082 | – | – | – | – | – | – | |
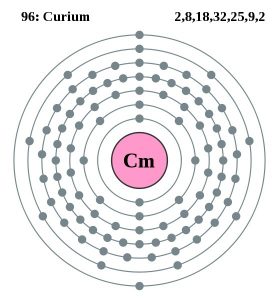
Curium Modèle de Bohr
À quoi sert le curium
Comme on ne le trouve pas naturellement dans la croûte terrestre, cet élément radioactif n’a été utilisé que dans des études de recherche fondamentale en raison de sa production limitée en laboratoire. De plus, il ne réagit pas avec d’autres composés. Cependant, le curium-244 pourrait être applicable comme source d’énergie pour faire fonctionner les générateurs thermoélectriques à radio-isotopes utilisés dans les engins spatiaux .
Faits intéressants sur le curium
- Le curium-244 a été utilisé dans le spectromètre à rayons X Alpha Proton pour détecter la présence d’éléments chimiques dans l’atmosphère et les composés de la surface rocheuse de Mars
- L’élément est censé briller rouge dans l’obscurité en raison de sa nature radioactive
Combien coûte le curium
L’élément radioactif n’est pas disponible dans le commerce en dehors de la production en laboratoire.