Coefficient de partage
Le coefficient de partage est la distribution à l’équilibre d’un analyte entre la phase échantillon et la phase gazeuse.
Les échantillons doivent être préparés pour maximiser la concentration des composants volatils dans l’espace de tête et minimiser la contamination indésirable par d’autres composés dans la matrice de l’échantillon. Pour aider à déterminer la concentration d’un analyte dans l’espace de tête, vous devrez calculer le coefficient de partage (K).
| Valeurs K des solvants courants dans les systèmes air-eau à 40°C | ||||||||
| Solvant | Cyclohexane | n-Hexane | Tétrachloréthylène | 1,1,1-Trichlorméthane | O-Xylène | Toluène | Benzène | Dichlorméthane |
| K Valeur | 0.077 | 0.14 | 1.48 | 1.65 | 2.44 | 2.82 | 2.90 | 5.65 |
| Solvant | n-acétate de butyle | acétate d’éthyle | méthyléthylcétone | n-.Butanol | Isopropanol | Ethanol | Dioxane | |
| Valeur K | 31.4 | 62.4 | 139.5 | 647 | 825 | 1355 | 1618 | |
Calcul du coefficient de partage
Coefficient de partage (K) = Cs/Cg
où :
Cs est la concentration de l’analyte dans la phase échantillon;
Cg est la concentration de l’analyte dans la phase gazeuse
Coefficients de partition des composés courants
Les composés qui ont de faibles valeurs de K auront tendance à se partitionner plus facilement dans la phase gazeuse et auront des réponses relativement élevées et de faibles limites de détection. Un exemple de ceci serait l’hexane dans l’eau : à 40°C, l’hexane aurait une valeur K de 0,14 dans un système air-eau.
Les composés qui ont des valeurs K élevées auront tendance à se répartir moins facilement dans la phase gazeuse et auront des réponses relativement faibles et des limites de détection élevées.
Un exemple de ceci serait l’éthanol dans l’eau : à 40°C, l’éthanol a une valeur K de 1355 dans un système air-eau.
Les valeurs des coefficients de partage pour d’autres composés courants sont indiquées dans le tableau ci-dessus.
Modification du coefficient de partage
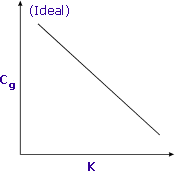 |
La sensibilité augmente lorsque K est minimisé |
Ajout de sels inorganiques
Des concentrations élevées de sel dans les échantillons aqueux diminuent la solubilité des volatiles organiques polaires dans la matrice de l’échantillon et favorisent leur transfert dans l’espace de tête, ce qui entraîne des valeurs de K plus faibles. L’ampleur de l’effet du salage sur le K, cependant, n’est pas la même pour tous les composés.
Les composés dont les valeurs de K sont déjà relativement faibles connaîtront très peu de changement dans le coefficient de partage après l’ajout d’un sel à une matrice d’échantillon aqueuse.
Généralement, les composés polaires volatils dans les matrices polaires (échantillons aqueux) connaîtront les plus grands décalages de K et auront des réponses plus élevées après l’ajout de sel à la matrice d’échantillon.
Sels courants utilisés pour diminuer les effets de matrice :
- Chlorure d’ammonium
- Sulfate d’ammonium
- Chlorure de sodium
- Citrate de sodium
- Sulfate de sodium
- Carbonate de potassium
La valeur de K dépend également du rapport de phase. Ceci est discuté dans la section suivante.
Ratio de phase
Le ratio de phase (β) est défini comme le volume relatif de l’espace de tête par rapport au volume de l’échantillon dans le flacon d’échantillon.
| Calcul du rapport de phase Rapport de phase (β) = Vg / Vs où : Vs est le volume de la phase échantillon |
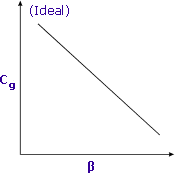 |
| La sensibilité est accrue lorsque β est minimisé |
Les valeurs plus faibles de β (c’est-à-dire.c’est-à-dire une taille d’échantillon plus grande) produiront des réponses plus élevées pour les composés volatils.
La diminution de la valeur de β ne produira pas toujours l’augmentation de la réponse nécessaire pour améliorer la sensibilité.
Lorsque β est diminué en augmentant la taille de l’échantillon, les composés avec des valeurs K élevées se répartissent moins dans l’espace de tête par rapport aux composés avec des valeurs K faibles et produisent des changements de Cg correspondants plus petits.
Les échantillons qui contiennent des composés avec des valeurs K élevées doivent être optimisés pour fournir la valeur K la plus faible avant de modifier le rapport de phase.
Combinaison du coefficient de partage et du rapport de phase
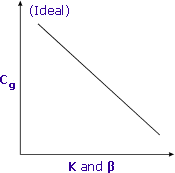
Un K et un β plus faibles entraînent un Cg plus élevé et une meilleure sensibilité
Les coefficients de partage et les rapports de phase fonctionnent ensemble pour déterminer la concentration finale des composés volatils dans l’espace de tête des flacons d’échantillon.
La concentration des composés volatils dans la phase gazeuse peut être exprimée comme suit :
Cg = Co / (K + β)
où
Cg est la concentration des analytes volatils dans la phase gazeuse
et
Co est la concentration initiale des analytes volatils dans l’échantillon.
La recherche des valeurs les plus faibles pour K et β se traduira par des concentrations plus élevées d’analytes volatils dans la phase gazeuse et donc par une meilleure sensibilité.
.