Fördelningskoefficient
Fördelningskoefficienten är jämviktsfördelningen av en analyt mellan provfasen och gasfasen.
Proverna måste förberedas för att maximera koncentrationen av de flyktiga komponenterna i headspace och minimera oönskad kontaminering från andra föreningar i provmatrisen. För att hjälpa till att bestämma koncentrationen av en analyt i headspace måste du beräkna fördelningskoefficienten (K).
| K-värden för vanliga lösningsmedel i luft-vattensystem vid 40°C | ||||||||
| Lösningsmedel | Cyklohexan | n-Hexan | Tetrachloreten | 1,1,1-triklormetan | O-Xylen | Toluen | Bensen | Dichlormetan |
| K-värde | 0.077 | 0.14 | 1.48 | 1.65 | 2.44 | 2.82 | 2.90 | 5.65 |
| Lösningsmedel | n-butylacetat | Ethylacetat | Metyletylketon | n-Butanol | Isopropanol | Ethanol | Dioxan | |
| K-värde | 31.4 | 62.4 | 139.5 | 647 | 825 | 1355 | 1618 | |
Beräkning av fördelningskoefficienten
Fördelningskoefficient (K) = Cs/Cg
varvid:
Cs är koncentrationen av analyten i provfasen;
Cg är koncentrationen av analyten i gasfasen
Partitionskoefficienter för vanliga föreningar
Föreningar som har låga K-värden tenderar att lättare fördela sig i gasfasen och har relativt höga svar och låga detektionsgränser. Ett exempel på detta är hexan i vatten: vid 40 °C har hexan ett K-värde på 0,14 i ett luft-vattensystem.
Föreningar med höga K-värden tenderar att fördela sig mindre lätt i gasfasen och har relativt låga svar och höga detektionsgränser.
Ett exempel på detta är etanol i vatten: vid 40 °C har etanol ett K-värde på 1355 i ett luft-vattensystem.
Värden för fördelningskoefficienter för andra vanliga föreningar visas i tabellen ovan.
Förändring av fördelningskoefficienten
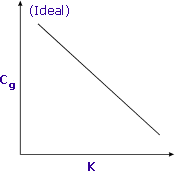 |
Känsligheten ökar när K minimeras |
Tillägg av oorganiska salter
Höga saltkoncentrationer i vattenprover minskar lösligheten hos polära organiska flyktiga ämnen i provmatrisen och främjar deras överföring till headspace, vilket resulterar i lägre K-värden. Storleken på saltningseffekten på K är dock inte densamma för alla föreningar.
Föreningar med K-värden som redan är relativt låga kommer att uppleva mycket små förändringar i fördelningskoefficienten efter tillsats av ett salt till en vattenhaltig provmatris.
Generellt sett kommer flyktiga polära föreningar i polära matriser (vattenhaltiga prover) att uppleva de största förskjutningarna i K och få högre reaktioner efter tillsats av salt till provmatrisen.
Gemensamma salter som används för att minska matrixeffekter:
- Ammoniumklorid
- Ammoniumsulfat
- Natriumklorid
- Natriumcitrat
- Natriumsulfat
- Kaliumkarbonat
Värdet på K är också beroende av fasförhållandet. Detta diskuteras i nästa avsnitt.
Fasförhållande
Fasförhållandet (β) definieras som den relativa volymen av headspace jämfört med volymen av provet i provflaskan.
| Beräkning av fasförhållandet Fasförhållandet (β) = Vg / Vs varvid: Vs är provfasens volym |
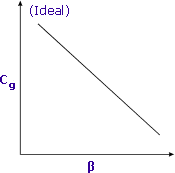 |
| Känsligheten ökar när β minimeras |
Lägre värden på β (dvs.
En minskning av β-värdet ger inte alltid den ökning av svaret som krävs för att förbättra känsligheten.
När β-värdet minskas genom att öka provstorleken, delar sig föreningar med höga K-värden mindre i headspace jämfört med föreningar med låga K-värden och ger motsvarande mindre förändringar i Cg.
Prover som innehåller föreningar med höga K-värden måste optimeras för att ge det lägsta K-värdet innan ändringar görs i fasförhållandet.
Kombination av fördelningskoefficient och fasförhållande
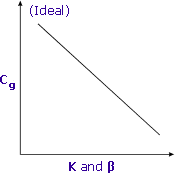
Lägre K och β ger högre Cg och bättre känslighet
Partitionskoefficienter och fasförhållande fungerar tillsammans för att bestämma den slutliga koncentrationen av flyktiga föreningar i headspace i provflaskor.
Koncentrationen av flyktiga föreningar i gasfasen kan uttryckas som:
Cg = Co / (K + β)
där
Cg är koncentrationen av flyktiga analyter i gasfasen
och
Co är den ursprungliga koncentrationen av flyktiga analyter i provet.
Som man strävar efter de lägsta värdena för både K och β får man högre koncentrationer av flyktiga analyter i gasfasen och därmed bättre känslighet.