Mehr als nur Blitze und Floater
Autoren: Nicole C. Morrow BS, Anthony T. Chung, MD, Michael Wall, MD
Posted June 24, 2019
Einführung
Photopsien (d.h. Lichtblitze) sind ein häufiges Symptom in der Augenklinik. Obwohl die meisten Photopsien retinalen Ursprungs sind, ist die Charakterisierung des Erscheinungsbildes, des Auftretens und der damit verbundenen Merkmale von entscheidender Bedeutung für die Bestimmung der Ursache dieser auffälligen, aber unterschiedlichen Beschreibungen von “blinkenden Lichtern”. Im folgenden Tutorium werden die verschiedenen Ursachen von Photopsien erörtert: vitreoretinale Traktion, okuläre Migräne, altersbedingte Makuladegeneration, Diabetes, zerebrale Durchblutung, visuelle Halluzinationen, krebsbedingte Retinopathie, entoptisches Phänomen, Phosphene und linsenbedingte Dysphotopsien.
Diskussion
Hintere Glaskörperabhebung, Netzhautrisse und/oder Netzhautablösung
Eine hintere Glaskörperabhebung (PVD) ist eine häufige Ursache für Floater und Photopsien in der Allgemeinbevölkerung und macht etwa 40 % der Patienten aus, die diese Symptome aufweisen. Floater (Abbildung 1) sind in der Regel auf Zellen oder Trümmer zurückzuführen, die im Glaskörper schwimmen und Schatten auf die Netzhaut werfen. Die Patienten beschreiben auch oft, dass sie einen großen undurchsichtigen Floater sehen, wenn sich der Glaskörper um den Sehnervenkopf herum ablöst. Bei der klinischen Untersuchung ist diese Ablösung des Glaskörpers vom kreisförmigen Sehnerv als Weiss’scher Ring zu erkennen.
Photopsien entstehen, wenn der Glaskörper auf die Netzhaut zieht. Die Spannung des Glaskörpers auf der Netzhaut führt dazu, dass Netzhautzellen feuern und Lichtblitze wahrgenommen werden. Diese Blitze dauern in der Regel weniger als eine Sekunde und werden als Blitzlicht oder Kamerablitz in der Peripherie beschrieben. Die Form des Blitzes ist in der Regel gekrümmt, was auf den Rand der vitreoretinalen Traktion zurückzuführen ist. Photopsien können unilateral oder bilateral auftreten, aber bilaterale Blitze treten typischerweise zu unterschiedlichen Zeiten in jedem Auge auf.
Netzhautrisse können auch Floater und Lichtblitze in der Peripherie verursachen. Netzhautrisse aufgrund von Traumen oder PVD sind typischerweise hufeisenförmig, und wenn sie groß genug sind, dringt der Glaskörper in den subretinalen Raum ein und verursacht eine rhegmatogene Netzhautablösung (RRD). Bei RRDs ist ein chirurgischer Eingriff erforderlich, da sie mit einer anhaltenden und fortschreitenden Sehverschlechterung einhergehen, die von den Patienten typischerweise als Vorhang oder Schleier in ihrem Gesichtsfeld beschrieben wird. Die Unterscheidung zwischen einer akuten PVD und Netzhautrissen kann allein anhand der Anamnese schwierig sein. Hollands et al. fanden heraus, dass 14 % der Patienten, die mit Floatern und/oder Flashes und der Diagnose einer PVD vorstellig werden, auch einen Netzhautriss haben; wenn jedoch keine subjektive Verschlechterung der Sehschärfe vorliegt, sinkt dieses Risiko auf 8,9 %. Umgekehrt steigt das Risiko eines Risses auf 45 % bzw. 62 %, wenn der Patient über eine subjektive Verschlechterung der Sehschärfe berichtet oder eine Glaskörperblutung festgestellt wird. Wird Glaskörperpigment (d. h. das Shafer-Zeichen) festgestellt, liegt das Risiko eines Netzhautrisses bei 88 %. Bei Patienten, bei denen eine PVD ohne Netzhautriss diagnostiziert wurde, hatten 3,4 % innerhalb von sechs Wochen nach ihrer Erstvorstellung einen Netzhautriss. Daher sollte bei allen Patienten innerhalb von 4-6 Wochen nach der Erstvorstellung eine erneute Fundusdilatation durchgeführt werden.

Abbildung 1. Illustration von Floatern, die typisch für eine hintere Glaskörperabhebung sind
Augenmigräne
Migräne ist ein rezidivierendes, häufig einseitiges Kopfschmerzsyndrom, das häufig mit einem Prodromalstadium bilateraler positiver visueller Phänomene einhergeht. Eine “klassische Migräne” ist dadurch gekennzeichnet, dass dieses Prodromalgeschehen (d. h. die Aura) etwa 15 bis 30 Minuten andauert, gefolgt von Kopfschmerzen und damit verbundenen Symptomen, die über Stunden anhalten können. Obwohl das visuelle Phänomen typischerweise beidseitig auftritt, können die Photopsien auf einem Auge größer erscheinen als auf dem anderen. Die visuellen Symptome können bei jedem Migränekopfschmerz auftreten, aber auch nur einmal. Migräne und Auren sind noch nicht vollständig geklärt, und die zugrunde liegenden Mechanismen sind umstritten. Eine führende Theorie besagt, dass Migräne durch Störungen des zerebralen Blutflusses verursacht wird und sich eine Welle gedämpfter neuronaler Aktivität langsam durch das Gehirn bewegt; dieser Prozess beginnt in der Regel im Okzipitallappen und breitet sich nach vorne aus. Eine Migräneaura ist wahrscheinlich das Ergebnis der anfänglichen Welle hoher neuronaler Aktivität, die mit der zuvor beschriebenen Ausbreitungsdepression zusammenhängt, gefolgt von einer Hemmung der Aktivität. Auren können sich als kleine helle Lichter, blinde Flecken, statisches/nebliges Sehen und/oder komplexe Sehstörungen äußern. Typischerweise beginnen Auren vor den Kopfschmerzen als zentrales, sichelförmiges, flimmerndes Skotom, das sich nach außen ausdehnt und von Lichtblitzen oder Zickzacklinien umgeben ist. Bei einer retinalen Migräne kommt es zu einer Sehverschlechterung oder vollständigen Erblindung auf einem Auge, ohne dass ein Flimmerskotom auftritt; dies ist auf einen Vasospasmus des Netzhautkreislaufs oder der Augenarterie zurückzuführen. Das Sehvermögen kehrt bei einer retinalen Migräne schnell wieder zurück. Eine sehr seltene Form der Migräne ist die ophthalmoplegische Migräne, die zu einer vorübergehenden Lähmung eines der drei an der Augenbewegung beteiligten Hirnnerven (CN III, CN IV und CN VI) führen kann, aber nicht mit Photopsien verbunden ist.


Abbildung 2. Illustrationen von flimmernden Skotomen, die typisch für die okuläre Migräne sind. Diese können eine Vielzahl visueller Phänomene hervorrufen, darunter Zickzacklinien und/oder bunte, “statisch” wirkende Bilder.
Altersbedingte Makuladegeneration
Die nicht-exsudative (d. h. trockene) altersbedingte Makuladegeneration (AMD) verursacht einen allmählichen bilateralen zentralen Sehverlust ohne damit verbundene Schmerzen. Die Patienten berichten über vermindertes zentrales Sehen und Metamorphopsie, haben aber in der Regel keine mit der trockenen AMD verbundenen Photopsien. Die exsudative (d. h. neovaskuläre oder feuchte) AMD ist jedoch eine weitere häufige Ursache für Photopsien und in einer Fallserie die zweithäufigste Ursache. Etwa 50 % der Personen mit exsudativer AMD berichten über wiederholte, zentral gelegene Lichtblitze, die mehrere Sekunden bis einige Minuten andauern. Diese Blitze werden typischerweise als Flackern, Pulsieren, funkelnde Lichter, schlangenartige Lichter, sich drehende Lichter, Windräder oder Kreise beschrieben. Meistens sind diese Lichter weiß, aber es gibt auch Berichte über blaue, silberne, goldene oder mehrfarbige Lichter. Die Wahrscheinlichkeit der gemeldeten Photopsien nimmt mit zunehmender Fläche der neovaskulären Membranen zu. Im Gegensatz zu den Photopsien bei PVD, die von der inneren Netzhaut-Glaskörper-Grenzfläche ausgelöst werden, entstehen die Photopsien bei exsudativer AMD durch Flüssigkeitsansammlungen, die die äußeren Netzhautschichten stimulieren. Die Unterscheidung zwischen den beiden kann vor der Untersuchung manchmal schwierig sein; allerdings sind zentrale Lichtblitze bei AMD weitaus häufiger als periphere Lichtblitze bei PVD.
Diabetes
Diabetes kann eine Vielzahl von Sehveränderungen verursachen. Das Fortschreiten der Krankheit kann zu einer proliferativen oder nicht-proliferativen diabetischen Retinopathie führen. Diabetiker, die ihren Blutzuckerspiegel gut einstellen, können ihr Risiko, eine diabetische Retinopathie zu entwickeln, deutlich senken. Die Mehrheit der Patienten entwickelt jedoch nach 15 Jahren eine diabetische Retinopathie. Die nicht-proliferative diabetische Retinopathie ist durch Mikroaneurysmen, Punkt-und-Fleck-Blutungen, harte Exsudate, Watteflecken und Makulaödeme gekennzeichnet. Patienten mit einem Makulaödem weisen in der Regel eine Verschlechterung der Sehschärfe auf. Die meisten Patienten bleiben jedoch asymptomatisch, bis sie die proliferative Phase erreichen. Die proliferative diabetische Retinopathie tritt auf, wenn die anhaltende Ischämie der Netzhaut die Bildung neuer Gefäße und faserigen Gewebes auslöst. Das neue fibröse Wachstum bildet eine kontrahierte Narbe an der vitreoretinalen Schnittstelle und kann Photopsien verursachen, da sich das Gewebe zusammenzieht. Diese Kontraktion kann zu traktiven Netzhautablösungen (TRD) mit einer möglichen Glaskörperblutung führen, da die neuen Gefäße brüchig sind. Patienten mit TRDs können über Floater, Photopsien und/oder einen Vorhang über ihrem Gesichtsfeld berichten, der rhegmatogenen Netzhautablösungen ähnelt. Die Komplikationen der proliferativen diabetischen Retinopathie können zu einem dauerhaften Sehverlust führen. In einer kleinen Studie berichteten Patienten mit Hypoglykämie, die insulinabhängige Diabetiker waren, über bilaterale Photopsien, die aufhörten, sobald ihr Blutzucker wieder normal war. Sie traten entweder in heller oder dunkler Umgebung auf und wurden als weißes Flackern oder Kreise beschrieben.
Basilarinsuffizienz der Wirbelsäule
Die Basilarinsuffizienz der Wirbelsäule führt zu einer verminderten Durchblutung des hinteren Teils des Gehirns und ist mit dem Altern verbunden. Dieser verminderte Blutfluss verursacht eine Ischämie in diesem Bereich und führt zu bilateralen Photopsien, die als unterbrochene Blitze von Sekunden bis Minuten Dauer beschrieben werden. Darüber hinaus ist die vertebrale Basilarinsuffizienz mit Schwindel, Benommenheit, Diplopie, Blindheit, Schwäche und Ataxie verbunden. Die Patienten können ähnliche Lichtblitze und Schleiersehen haben, ähnlich wie bei einer visuellen Migräne; allerdings dauern diese Symptome nicht so lange an und treten nicht vor den Kopfschmerzen auf .
Auslösungshalluzinationen (Charles-Bonnet-Syndrom)
Auslösungshalluzinationen sind als visuelle Halluzinationen charakterisiert, die durch eine ein- oder beidseitige Schädigung der Sehbahn bei Personen mit intakter Kognition entstehen. Die Patienten beschreiben, dass sie mehrfarbige Formen, Gitter, Gesichter, Menschen und Blumen sehen, die Sekunden bis Minuten dauern. Der zugrundeliegende Mechanismus ist nur unzureichend bekannt. Die am weitesten akzeptierte Theorie ist die Theorie der sensorischen Deprivation, die besagt, dass der Verlust visueller Reize für den visuellen Kortex die Erregbarkeit der Neuronen erhöht. Diese erhöhte neuronale Aktivität führt zu einem zufälligen Feuern der Neuronen mit wenig oder gar keinen Reizen, daher der Name Release-Halluzinationen . Dies wird durch die hohe Prävalenz bei Personen mit schlechterer Sehschärfe und nach postoperativen Augenkorrekturen bestätigt. Die Prävalenz des Charles-Bonnet-Syndroms steigt bei Personen mit beidseitig schlechterer Sehschärfe.
Krebs-assoziierte Retinopathie
Krebs-assoziierte Retinopathie ist eine seltene Autoimmunerkrankung, bei der der Körper Autoantikörper gegen retinale Antigene entwickelt. Recoverin und a-Enolase sind die häufigsten retinalen Antigene, gegen die sich Autoantikörper entwickeln. Diese Antikörper entwickeln sich typischerweise bei Vorliegen einer bösartigen Erkrankung, am häufigsten bei kleinzelligem Lungenkrebs. Patienten, die diese Krankheit entwickeln, zeigen häufig eine Abnahme der Sehschärfe als Folge einer Dysfunktion der Photorezeptoren. Es kann zu Lichtempfindlichkeit, verstärkter Blendung nach Lichtexposition, nachlassendem Farbensehen und/oder zentralen Skotomen und würstchenförmigen Bogenskotomen (Bjerrum-Skotomen) aufgrund von Zapfenfunktionsstörungen kommen. Nachtblindheit, periphere Ringskotome oder eine deutliche Verschlechterung des peripheren Sehens können bei einer Stäbchenfehlfunktion auftreten. Photopsien treten auch bei krebsassoziierter Retinopathie in etwa 7-15 % der Fälle auf. Sie werden als flackerndes oder schimmerndes Licht beschrieben und sind vermutlich auf eine Netzhautdegeneration zurückzuführen. Eine Studie ergab, dass visuelle Symptome einer Krebsdiagnose vorausgehen können.
Entoptisches Phänomen
Wenn Personen ein Bild wahrnehmen, das aus ihren eigenen Augen stammt, wird dies als entoptisches Bild bezeichnet (Abbildung 3). Dieses Phänomen kann auftreten, wenn ein Lichtstift auf die geschlossenen Augenlider einer Person gerichtet und dann bewegt wird. Die Bilder, die dabei erscheinen, werden als verzweigtes Linienmuster beschrieben, das durch den Schatten entsteht, den die Netzhautgefäße auf andere Bereiche der Netzhaut werfen. Manchmal blinkt und pulsiert das Bild mit dem Herzschlag und bleibt einige Sekunden lang bestehen, während sich die Lichtquelle weiterbewegt. In der Vergangenheit wurde dieses Phänomen als alternativer Test für die Sehschärfe verwendet. Wenn eine Person in der Lage war, das verzweigte Muster auf einem Auge zu sehen, auf dem anderen aber nicht, wurde festgestellt, dass das Auge, das das Bild nicht sah, eine schlechtere Makulafunktion hatte.
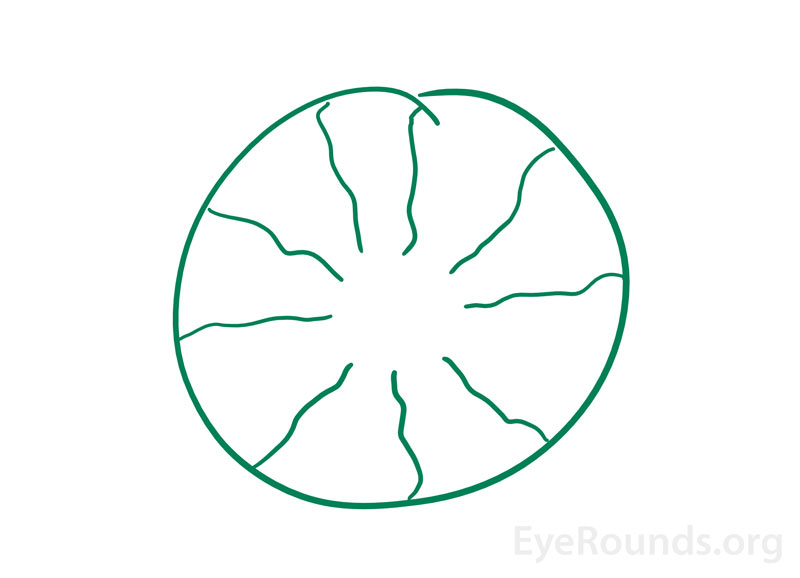
Abbildung 3. Illustration eines entoptischen Phänomens, das von einem sehr klugen Patienten in der neuro-ophthalmologischen Klinik beschrieben wurde. Er berichtete über das Auftreten eines “grünen Bildes wie ein Donut mit radialen, verschnörkelten Linien” beim Aufwachen in den letzten 6-12 Monaten. Frühere Augenuntersuchungen vor Ort waren unauffällig. Es wurde vermutet, dass dies auf ein Nachbild der avaskulären Foveazone (Loch im Donut) und der radialen Blutgefäße zurückzuführen ist.
Phosphene
Phosphene sind eine positive Photopsie, die ohne eine Lichtquelle gesehen wird. Sie werden als Lichtblitze, Lichtbalken/-flecken oder farbige Flecken beschrieben. Sie können durch Reiben der Augen, Husten, Kopftrauma oder andere pathologische Ursachen ausgelöst werden. Man geht davon aus, dass diese Mechanismen auf die Erregung der Photorezeptoren in der Netzhaut durch mechanischen Druck zurückzuführen sind. Die anderen zugrundeliegenden Mechanismen variieren je nach der im Auge festgestellten Pathologie. Retinale Traktion, Netzhautablösungen, krebsbedingte Retinopathie und Release-Halluzination sind allesamt pathologische Ursachen von Phosphenen und treten wie oben beschrieben auf. Phosphene treten auch bei Substanzintoxikationen oder Bestrahlung des Auges auf.
Positive und negative Dysphotopsien
Positive und negative Dysphotopsien treten häufig nach einer Kataraktextraktion mit Einsetzen einer Intraokularlinse auf. Die typische Beschreibung positiver Dysphotopsien sind Lichtblitze, Blendungen oder Halos in der Peripherie. Sie treten auf, wenn die Augen geöffnet sind, und variieren je nach Lichteinfall. Am häufigsten treten sie auf, wenn eine Person aus dem Dunkeln einen beleuchteten Raum betritt und die Pupillen geweitet sind. Sie stehen im Gegensatz zu Photopsien aufgrund von Glaskörperwanderungen, die typischerweise im Dunkeln auftreten und durch Augenbewegungen ausgelöst werden. Im Gegensatz zu Netzhautablösungen sind positive Dysphotopsien nicht persistent und nehmen nicht an Größe zu. Der zugrunde liegende Mechanismus positiver Dysphotopsien ist das Ergebnis abweichender Lichtreflexionen am Rand der Augenlinse.
Im Gegensatz dazu werden negative Dysphotopsien üblicherweise als bogen- oder halbmondförmige Schatten in der Peripherie beschrieben. Der zugrundeliegende Mechanismus negativer Dysphotopsien ist auf den Anteil des Lichts zurückzuführen, der vom Auge weg reflektiert wird, wodurch ein kleiner Bereich entsteht, in dem das Licht die Netzhaut nicht erreicht. Negative Dysphotopsien lösen sich in der Regel auf, wenn der Patient geweitet wird. Sowohl positive als auch negative Dysphotopsien treten häufiger bei kleinen, scharfkantigen IOLs auf. Multifokale IOL sind im Vergleich zu monofokalen IOL auch mit einer Zunahme von Blendung und Photopsien verbunden. Diese Symptome treten am häufigsten in der frühen postoperativen Phase auf, klingen aber in der Regel mit der Fibrosierung der Kapsel ab. Obwohl sie relativ selten auftreten, können sie von einigen Patienten als so störend empfunden werden, dass eine Neupositionierung oder eine zweite Platzierung der Intraokularlinse erforderlich wird.
- Brown GC, Brown MM, Fischer DH. Photopsias: A Key to Diagnosis. Ophthalmology 2015;122(10):2084-2094. https://PubMed.gov/26249730. DOI: 10.1016/j.ophtha.2015.06.025
- Sharma P, Sridhar J, Mehta S. Flashes and Floaters. Prim Care 2015;42(3):425-435. https://PubMed.gov/26319347. DOI: 10.1016/j.pop.2015.05.011
- Horton JC. Disorders of the Eye. In: Kasper D, Fauci A, Hauser S, Longo D, Jameson JL, Loscalzo J, editors. Harrison’s Principles of Internal Medicine, 19e. New York, NY: McGraw-Hill Education; 2014.
- Hollands H, Johnson D, Brox AC, Almeida D, Simel DL, Sharma S. Acute-onset floaters and flashes: is this patient at risk for retinal detachment? Jama 2009;302(20):2243-2249. https://PubMed.gov/19934426. DOI: 10.1001/jama.2009.1714
- Aminoff MJ, Greenberg DA, Simon RP. Headache & Facial Pain. Clinical Neurology, 9e. New York, NY: McGraw-Hill Education; 2015.
- Vincent MB. Vision and migraine. Headache 2015;55(4):595-599. https://PubMed.gov/25758366. DOI: 10.1111/Kopf.12531
- Marzoli SB, Criscuoli A. The role of visual system in migraine. Neurol Sci 2017;38(Suppl 1):99-102. https://PubMed.gov/28527076. DOI: 10.1007/s10072-017-2890-0
- Pelletier AL, Rojas-Roldan L, Coffin J. Vision Loss in Older Adults. Am Fam Physician 2016;94(3):219-226. https://PubMed.gov/27479624
- Masharani U. Diabetes mellitus & Hypoglycemia. In: Papadakis MA, McPhee SJ, Rabow MW, editors. Aktuelle medizinische Diagnostik & Behandlung 2018. New York, NY: McGraw-Hill Education; 2018.
- Zhao Q, Zhou F, Zhang Y, Zhou X, Ying C. Fasting Plasma Glucose Variability Levels and Risk of Adverse Outcomes Among Patients with Type 2 Diabetes: A Systematic Review and Meta-analysis. Diabetes Res Clin Pract 2018;10.1016/j.diabres.2018.12.010. https://PubMed.gov/30583033. DOI: 10.1016/j.diabres.2018.12.010
- Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. The Wisconsin epidemiologic study of diabetic retinopathy. II. Prävalenz und Risiko der diabetischen Retinopathie, wenn das Alter bei der Diagnose weniger als 30 Jahre beträgt. Arch Ophthalmol 1984;102(4):520-526. https://PubMed.gov/6367724
- Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. The Wisconsin epidemiologic study of diabetic retinopathy. III. Prävalenz und Risiko der diabetischen Retinopathie, wenn das Alter bei der Diagnose 30 oder mehr Jahre beträgt. Arch Ophthalmol 1984;102(4):527-532. https://PubMed.gov/6367725
- Basic ophthalmology: essentials for medical students. 10th ed: American Academy of Ophthalmology, 2016.
- Lima Neto AC, Bittar R, Gattas GS, Bor-Seng-Shu E, Oliveira ML, Monsanto RDC, Bittar LF. Pathophysiologie und Diagnostik der vertebrobasilären Insuffizienz: Ein Überblick über die Literatur. Int Arch Otorhinolaryngol 2017;21(3):302-307. https://PubMed.gov/28680502. DOI: 10.1055/s-0036-1593448
- Pang L. Hallucinations Experienced by Visually Impaired: Charles Bonnet Syndrome. Optom Vis Sci 2016;93(12):1466-1478. https://PubMed.gov/27529611. DOI: 10.1097/opx.0000000000000959
- Vahdani K, Poon JS, Antoniou E, Giasin O, Makrygiannis G. Charles Bonnet Syndrome Following Eyelid Reconstruction Surgery. Ophthalmic Plast Reconstr Surg 2017;33(3):229-230. https://PubMed.gov/28475529. DOI: 10.1097/iop.0000000000000892
- Beaulieu RA, Tamboli DA, Armstrong BK, Hogan RN, Mancini R. Reversibles Charles-Bonnet-Syndrom nach okuloplastischen Eingriffen. J Neuroophthalmol 2018;38(3):334-336. https://PubMed.gov/27984353. DOI: 10.1097/wno.0000000000000477
- Moyer K, DeWilde A, Law C. Cystoid macular edema from cancer-associated retinopathy. Optom Vis Sci 2014;91(4 Suppl 1):S66-70. https://PubMed.gov/24531653. DOI: 10.1097/opx.0000000000000184
- Grange L, Dalal M, Nussenblatt RB, Sen HN. Autoimmune Retinopathy. Am J Ophthalmol 2014;157(2):266-272.e261. https://PubMed.gov/24315290. DOI: 10.1016/j.ajo.2013.09.019
- Grewal DS, Fishman GA, Jampol LM. Autoimmunretinopathie und antiretinale Antikörper: ein Überblick. Retina 2014;34(5):827-845. https://PubMed.gov/24646664. DOI: 10.1097/iae.0000000000000119
- Adamus G. Autoantibody targets and their cancer relationship in the pathogenicity of paraneoplastic retinopathy. Autoimmun Rev 2009;8(5):410-414. https://PubMed.gov/19168157. DOI: 10.1016/j.autrev.2009.01.002
- Chang DF. Chapter 2. Ophthalmologic Examination. In: Riordan-Eva P, Cunningham ET, editors. Vaughan & Asbury’s General Ophthalmology, 18e. New York, NY: The McGraw-Hill Companies; 2011.
- Coppola D, Purves D. The extraordinarily rapid disappearance of entoptic images. Proc Natl Acad Sci U S A 1996;93(15):8001-8004. https://PubMed.gov/8755592
- Mark HH. Der entoptische Blick auf die Netzhautgefäße. Acta Ophthalmol 2014;92(3):e237-240. https://PubMed.gov/23890291. DOI: 10.1111/aos.12192
- Ropper AH, Samuels MA, Klein JP. Chapter 13. Disturances of Vision. Adams and Victor’s Principles of Neurology, 10e. New York, NY: The McGraw-Hill Companies; 2014.
- Salari V, Scholkmann F, Vimal RLP, Csaszar N, Aslani M, Bokkon I. Phosphenes, retinal discrete dark noise, negative afterimages and retinogeniculate projections: A new explanatory framework based on endogenous ocular luminescence. Prog Retin Eye Res 2017;60:101-119. https://PubMed.gov/28729002. DOI: 10.1016/j.preteyeres.2017.07.001
- Mathis T, Vignot S, Leal C, Caujolle JP, Maschi C, Mauget-Faysse M, Kodjikian L, Baillif S, Herault J, Thariat J. Mechanisms of phosphenes in irradiated patients. Oncotarget 2017;8(38):64579-64590. https://PubMed.gov/28969095. DOI: 10.18632/oncotarget.18719
- Bournas P, Drazinos S, Kanellas D, Arvanitis M, Vaikoussis E. Dysphotopsia after cataract surgery: comparison of four different intraocular lenses. Ophthalmologica 2007;221(6):378-383. https://PubMed.gov/17947823. DOI: 10.1159/000107496
- Davison JA. Positive und negative Dysphotopsie bei Patienten mit Acryl-Intraokularlinsen. J Cataract Refract Surg 2000;26(9):1346-1355. https://PubMed.gov/11020620
- Hu J, Sella R, Afshari NA. Dysphotopsie: ein vielschichtiges optisches Phänomen. Curr Opin Ophthalmol 2018;29(1):61-68. https://PubMed.gov/29084005. DOI: 10.1097/icu.0000000000000447
- Wang SY, Stem MS, Oren G, Shtein R, Lichter PR. Patientenzentrierte und visuelle Qualitätsergebnisse der Premium-Kataraktchirurgie: eine systematische Überprüfung. Eur J Ophthalmol 2017;27(4):387-401. https://PubMed.gov/28574135. DOI: 10.5301/ejo.5000978
Suggested Citation Format
Morrow N, Chung AT, Wall M. Photopsias. EyeRounds.org. June 24, 2019; Available from https://EyeRounds.org/tutorials/photopsias/index.htm